长双歧杆菌BBMN68寡糖利用预测与验证
2020-01-16欧扬雯珊刘松玲刘治麟陈巧燕夏兵兵
欧扬雯珊 刘松玲 刘治麟 陈巧燕 夏兵兵 赵 亮,*
(1 教育部功能乳品重点实验室 中国农业大学食品科学与营养工程学院 北京 100083
2 北京市高等学校畜产品工程技术研究中心 北京 100083
3 北京和益源生物技术有限公司 北京 100088
4 深圳市晨光乳业有限公司 广东深圳 518107)
双歧杆菌(Bifidobacterium)是一类安全有效的益生菌,然而其环境耐受与营养供应问题一直影响着它的有效利用。双歧杆菌定植能力弱[1-3],其丰度受肠道内营养物质含量、种类的制约[4]。特定糖类则可促进双歧杆菌生长[4],帮助其定植。
寡糖(亦称为低聚糖)是指由3~10个单糖组成的糖类[5]。根据生理功能,寡糖可分为消化性寡糖与无法被人体利用的非消化性寡糖[5-7],后者可被双歧杆菌代谢利用[8-11],因此膳食会影响肠道微环境[12]。不同菌株对糖的利用范围、种类、方式存在特异性[13],如婴儿双歧杆菌主要利用母乳寡糖[14]、两歧双歧杆菌主要利用 mucin寡糖[15]。Vulevic等[9-10]发现低聚半乳糖可提高老年人与肥胖成人肠道中双歧杆菌含量,分别提升IL-10水平与降低总胆固醇含量;Lewis等[11]发现喂养含岩藻糖基化寡糖母乳的婴儿,肠道中双歧杆菌丰度显著高于对照组。
不同于多数婴儿来源的双歧杆菌,来自中国广西巴马长寿老人肠道的BBMN68(Bifidobacterium longum subsp.longum BBMN68)对寡糖的利用具有特异性[15-17]。该菌株具有增强免疫[18],缓解过敏[19],改善便秘[20]的功能。生物信息学技术从基因层面揭示了菌株对环境的适应特性,是研发菌株营养利用的有效手段[15-16]。本研究旨在通过生物信息学技术预测BBMN68糖苷水解酶及碳水化合物转运系统,获得潜在可利用寡糖,对开发利用特有BBMN68益生元具有重要意义。
1 材料与试剂
1.1 试验菌株
B.longum subsp.longum BBMN68(CGMCC No.2265;GenBank assembly accession GCA_000166315.1)分离自广西巴马长寿老人粪便,由教育部功能乳品重点实验室保藏。
1.2 主要仪器(表1)

表1 主要仪器与设备Table1 Main instruments and equipment
1.3 主要试剂及配制
1.3.1 菌株培养 碳源:低聚甘露糖、低聚木糖、低聚半乳糖、低聚异麦芽糖、低聚麦芽糖、低聚果糖、葡萄糖。
半合成培养基[21]:细菌蛋白胨10 g/L;酵母浸粉5 g/L;磷酸氢二钾 2 g/L;乙酸钠 5 g/L;柠檬酸氢二胺 2 g/L;MnSO4·4H2O 0.25 g/L;MgSO4·7H2O0.58 g/L;Tween-80 1 g/L;Cys-HCl 0.5 g/L。
1.3.2 定量PCR细菌RNAout试剂盒,天恩泽公司;cDNA第一链合成试剂盒、SYBR Green I Real-time PCR Master Mix,日本TAKARA公司。
2 试验方法
2.1 BBMN68寡糖相关基因功能预测
2.1.1 糖苷水解酶分析 使用CAZy数据库(http://www.cazy.org)比对分析BBMN68基因组,获取糖苷水解酶编码基因。利用PSORTb数据库(http://www.psort.org/psortb/)定位上述基因编码的糖苷水解酶在细胞中的位置。通过EC数据库(http://www.ebi.ac.uk/)对 BBMN68 中糖苷水解酶进行编码归类。
2.1.2 寡糖转运子分析 获取BBMN68基因组中所有COG(G)蛋白,使用 TCDB 数据(http://www.tcdb.org/)库BLAST功能,对所有蛋白进行检索分析。根据TCDB数据库分类信息:分类号3.A.1.1及3.A.1.2为碳水化合物ABC转运子;2.A.1.X为MFS转运子;8.A.7及8.A.8为PTS转运系统[22]。
2.2 功能验证
2.2.1 生长试验验证 按照2%接种量,将BBMN68接种于含不同寡糖的半合成培养基中,37℃厌氧培养12 h,测定OD600条件下的吸光值。
2.2.2 定量PCR 总RNA的提取及cDNA合成:使用TIANDZ细菌RNAout试剂盒提取对数期长双歧杆菌BBMN68的总RNA。收集5~8mL新鲜菌液于离心管中,4℃,12 000×g离心1min,弃尽上清;加入1mL细菌RNAout并用枪充分吹打,确保细菌充分裂解,没有块状物;加入0.2mL氯仿,充分振荡混匀,以打断DNA并去除蛋白质;4℃,12 000×g离心3min,吸取无色上清液(注意不要吸取中间层的蛋白质)于新的离心管中,并加入等体积异丙醇,轻轻颠倒混匀;4℃,12 000×g离心10min,吸弃上清;加入75%乙醇,充分振荡混匀,4℃,12 000×g离心 3min,吸弃上清;加入 50μL的0.1%DEPC水沉淀溶解。将RNA用1.2%的琼脂糖凝胶电泳检验所提取RNA的完整度及纯度。使用cDNA第一链合成试剂盒,作为后续实时荧光定量PCR的模板。
引物的设计、合成与实时荧光定量PCR:利用NCBI数据库中PRIMER BLAST在线引物设计软件设计引物,并对选自文献中的引物进行比对验证。引物由上海英骏生物技术有限公司合成(表3)。PCR 反应体系 25μL:cDNA 模板 1μL,上下游引物各 1 μL,SYBR Green I Real-time PCR Master Mix 12.5 μL,ddH2O 9.5 μL。反应条件:95℃预变性10 s,95℃变性5 s,61℃退火延伸31 s,45个循环。相对表达量计算公式:相对表达量=2[(CT目的基因-CT内参基因)对照组-(CT目的基因-CT内参基因)处理组]。在以葡萄糖为唯一碳源的半合成培养基中BBMN68基因表达量作为对照组,在以其它寡糖为唯一碳源的半合成培养基中其基因表达量为处理组。CT目的基因指BBMN68中糖苷水解酶基因拷贝数,CT内参基因指 BBMN68 16S rRNA拷贝数。每个目标基因进行3个生物重复。
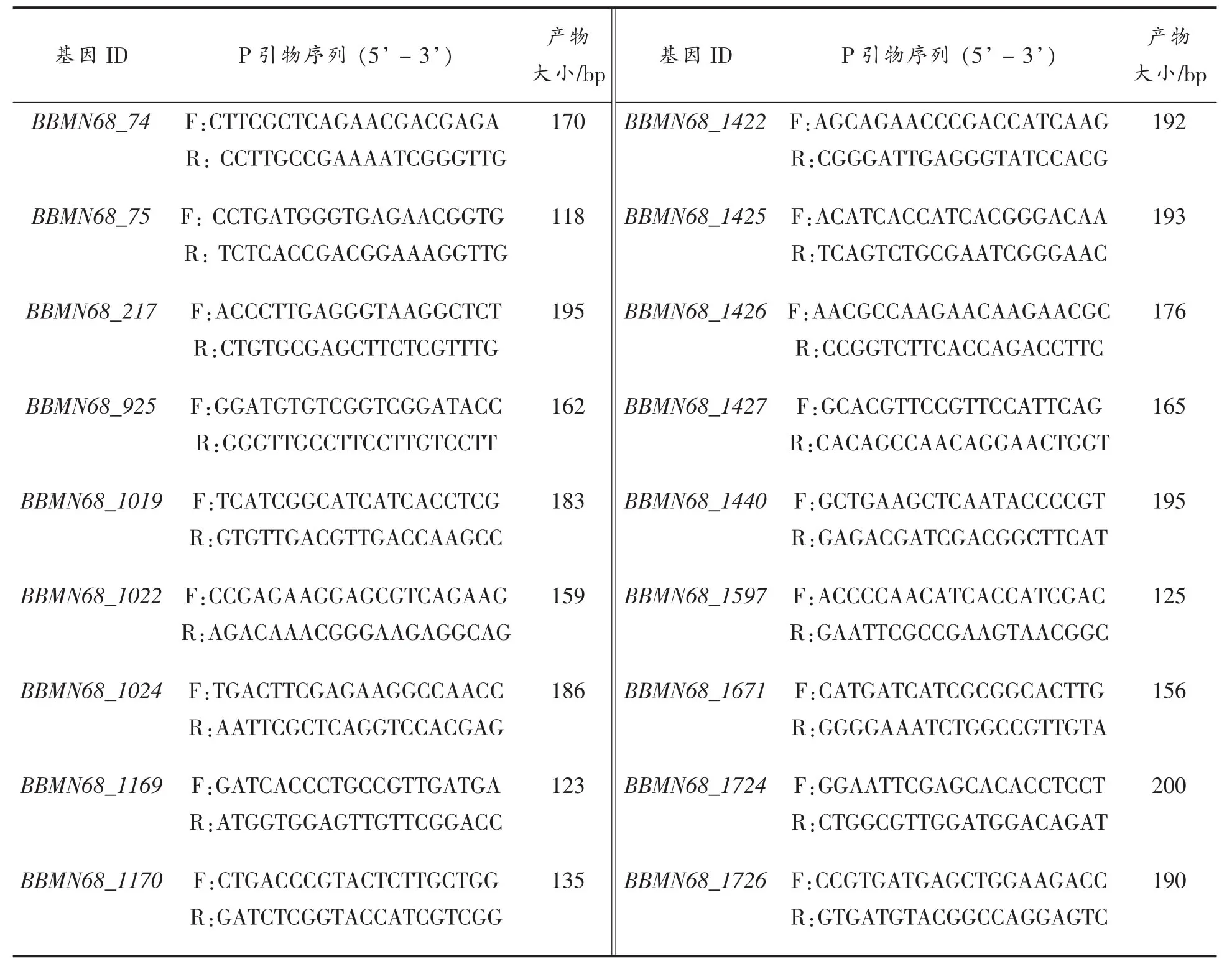
表2 RT-PCR引物Table2 The primer of RT-PCR
3 结果与分析
3.1 BBMN68寡糖相关基因功能预测
3.1.1 糖苷水解酶预测 CAZy数据库显示BBMN68基因组中含有58个编码糖苷水解酶的基因。通过PSORTb数据库进一步对58个编码蛋白进行亚细胞定位,发现其中有16个蛋白位于胞外,占总数的28%。全部糖苷水解酶可归纳为24个蛋白家族,其中 GH13家族数量最多(13),GH43家族其次(9),且GH43家族糖苷水解酶均位于胞外或锚定于细胞壁。
结果显示,BBMN68主要以细胞壁多糖及淀粉为底物。以植物细胞壁为底物的糖苷水解酶数目最多,包括26个编码基因,其中12个位于胞外或细胞壁;其次是以淀粉为底物的糖苷水解酶,包括15个编码基因,全部属于胞内酶。
EC数据库显示,33个糖苷水解酶可注释EC编码,共编码14种酶。水解获得的单糖产物包括半乳糖、葡萄糖、N-乙酰葡萄糖胺、N-乙酰半乳糖胺、果糖、甘露糖、阿拉伯糖和木糖。
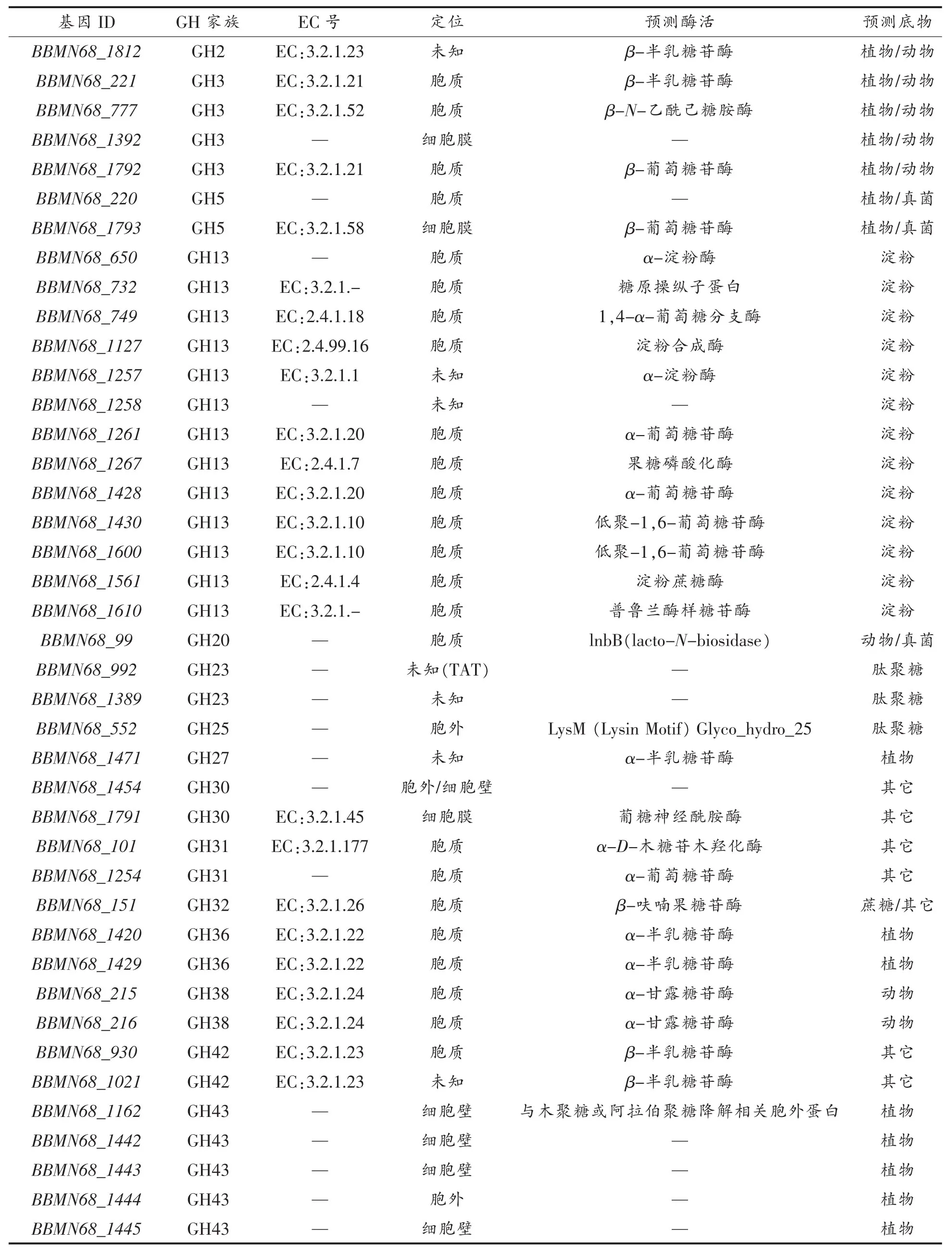
表3 BBMN68糖苷水解酶Table3 Glycoside hydrolyses of BBMN68
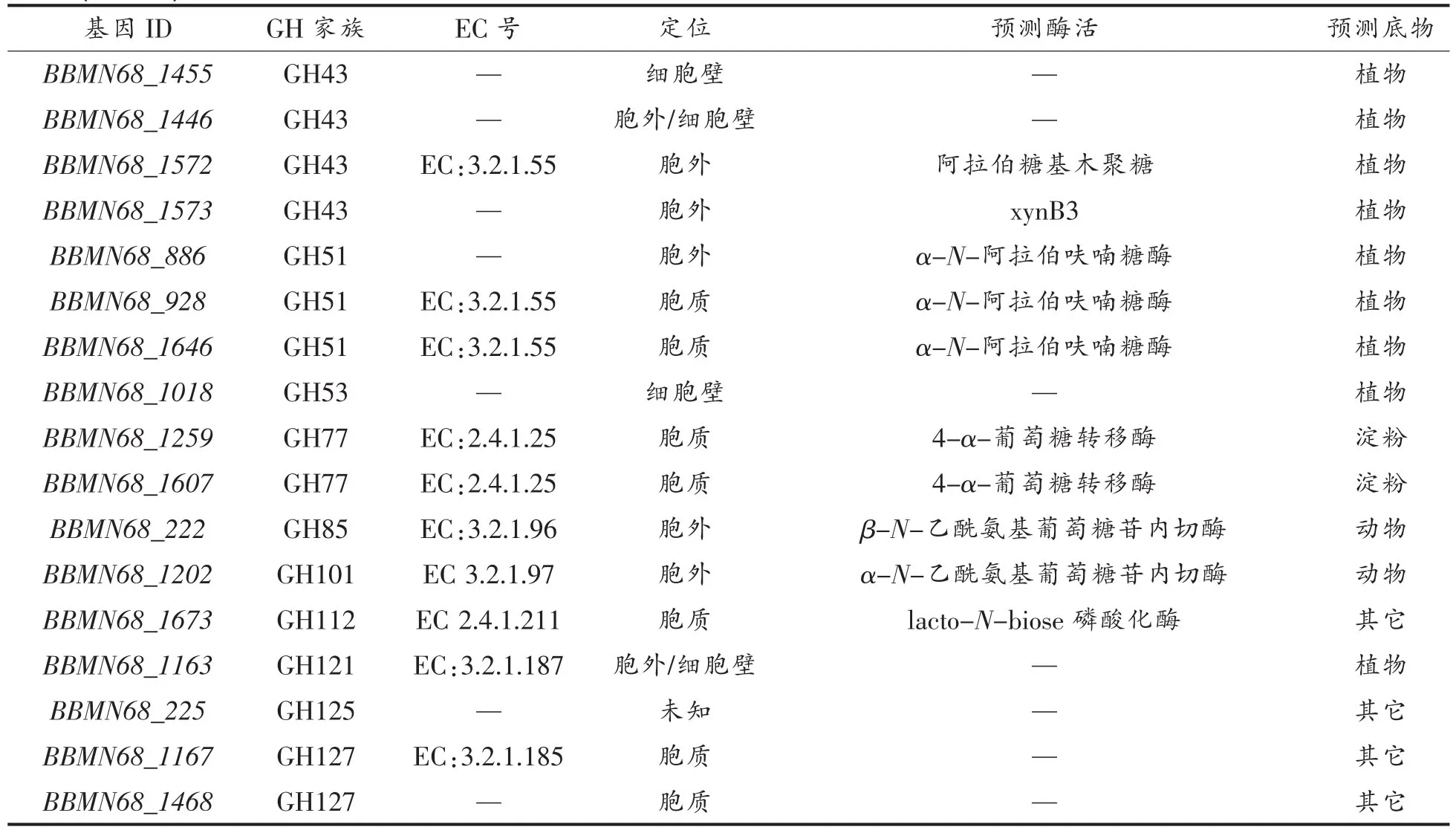
(续表3)
3.1.2 寡糖转运系统预测 与糖苷水解酶不同,多数寡糖的转运蛋白为膜蛋白,限制了该类蛋白的深入研究。目前,学者主要通过蛋白质组学[23]、转录组学[24]和糖组学[25],开展对双歧杆菌寡糖转运系统底物的研究。TCDB数据库显示BBMN68寡糖转运系统主要包括ABC(ATP binding cassette)转运系统和PEP-PTS(Phosphoenolpyruvate-phosphotransferase)转运系统,以及MFS(Major facilitator superfamily)系统及少量的MIP(Major intrinsic protein)[26]系统。

表4 BBMN68碳水化合物转运子Table4 Carbohydrate transporters in BBMN68
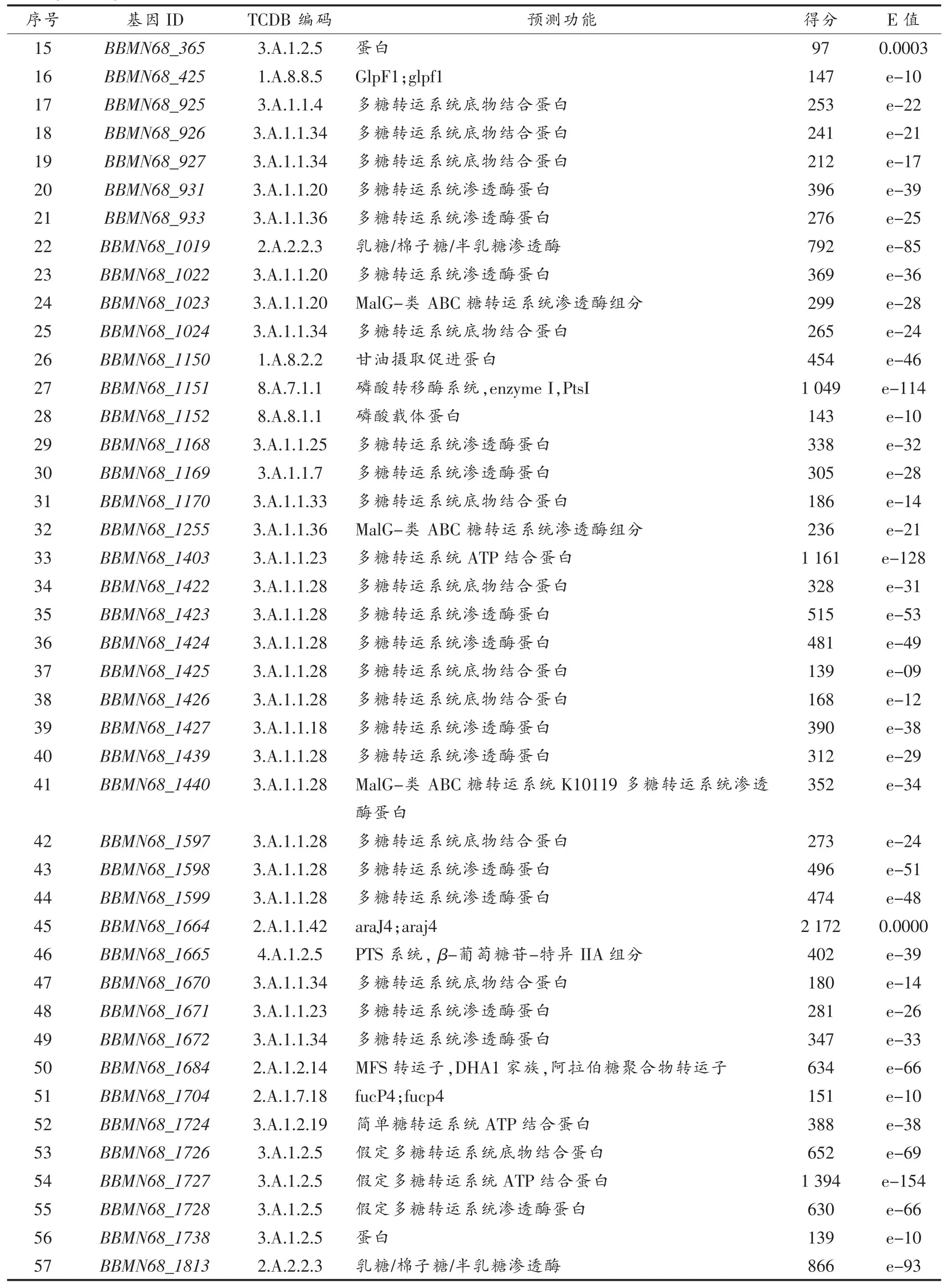
(续表4)
TCDB数据库显示,BBMN68基因组共编码57个碳水化合物转运子基因(表5),包括ABC转运子41个,MFS转运基因11个,PTS转运系统基因3个和MIP基因2个,介于已报道的双歧杆菌碳水化合物转运基因数目(21~68)[24]。通常双歧杆菌MFS基因数目在1~6个之间,而BBMN68具有11个MFS基因。
BBMN68中ABC转运子基因多位于基因簇内,其中,36个基因分布于11个基因簇中,仅5个基因单独存在。通常,每个基因簇包括1~3个糖特异性连接蛋白,1~2个通透酶和1~2个ATP酶。结果显示,BBMN68_925-BBMN68_927编码3个糖连接蛋白,BBMN68_933-BBMN68_934编码2个连续的通透酶。不同于已有文献,11个ABC转运子基因簇中仅有2个基因簇(BBMN68_73-BBMN68_78 与 BBMN68_1723-BBMN68_1730)包含ATP连接蛋白基因。而BBMN68基因组中发现一个单独存在的ATP连接蛋白(BBMN68_1403),该蛋白氨基酸序列与已报道的BL0673相似度大于60%。该蛋白在B.longum NCC2705与Streptomycescoelicolor A3中的注释信息为ABC转运子通用ATP酶,该酶可被其它缺少ATP酶的ABC转运子共用[27],因此 BBMN68_1403可能作为BBMN68 ABC转运子的通用ATP酶。该现象可帮助有限的基因发挥最大的作用,体现了BBMN68的遗传优势。此外,ABC转运子基因簇常与糖苷水解酶基因及转录调节子基因毗邻,表明转录子的特异性可能与糖苷水解酶的特异性相关,基因簇的表达可能受底物水平的调控。
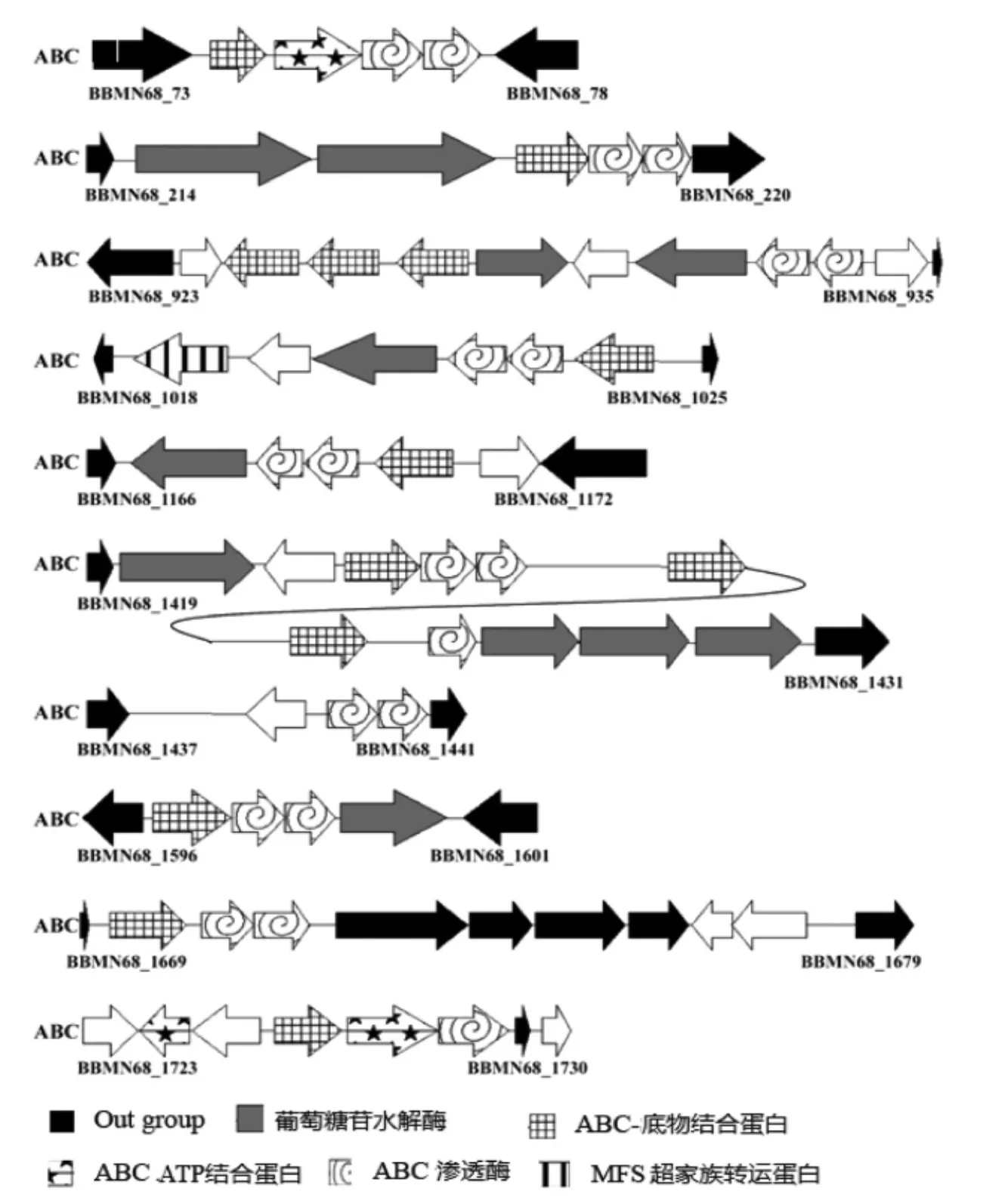
图1 碳水化合物转运子基因簇Fig.1 Gene clusters of carbohydrate transporters
3.2 BBMN68寡糖相关基因功能验证
3.2.1 生长试验验证 生长试验结果显示BBMN68对不同来源的寡糖具备利用能力。BBMN68在植物细胞壁来源的低聚半乳糖、低聚木糖培养基中生长良好。菌株在淀粉不完全降解寡糖产物——低聚异麦芽糖和低聚麦芽糖中亦可良好生长,而在未降解的淀粉中不生长(数据未显示)。结果显示BBMN68可在低聚果糖中生长,无法在动物来源的低聚甘露糖中生长。
3.2.2 碳水化合物转运基因的验证 RT-PCR结果显示,在寡糖半合成培养基中,碳水化合物转运子基因mRNA水平表达量发生了不同程度的变化,存在以下特点:(1)不同基因对寡糖的反应不同,例如BBMN68_925,BBMN68_1022,BBMN68_1724基因对试验底物的反应较低,表明试验所用寡糖可能并非其真正底物,或者上述基因属于组成型表达。(2)单糖组成相似,碳链长度不同的底物诱导表达的基因相似,如低聚果糖、果糖和蔗糖(数据未显示)均可诱导BBMN68_74,BBMN68_75表达。(3)同种底物可诱导多个转运子基因表达,例如:低聚麦芽糖可诱导BBMN68_1170,BBMN68_1422,BBMN68_1024,BBMN68_1169,BBMN68_1170,BBMN68_1422,BBMN68_1427,BBMN68_1597,BBMN68_1671基因表达。

表5 BBMN68预测寡糖底物中的生长情况Table5 Growth profile of BBMN68 in predicted oligosaccharide substrates
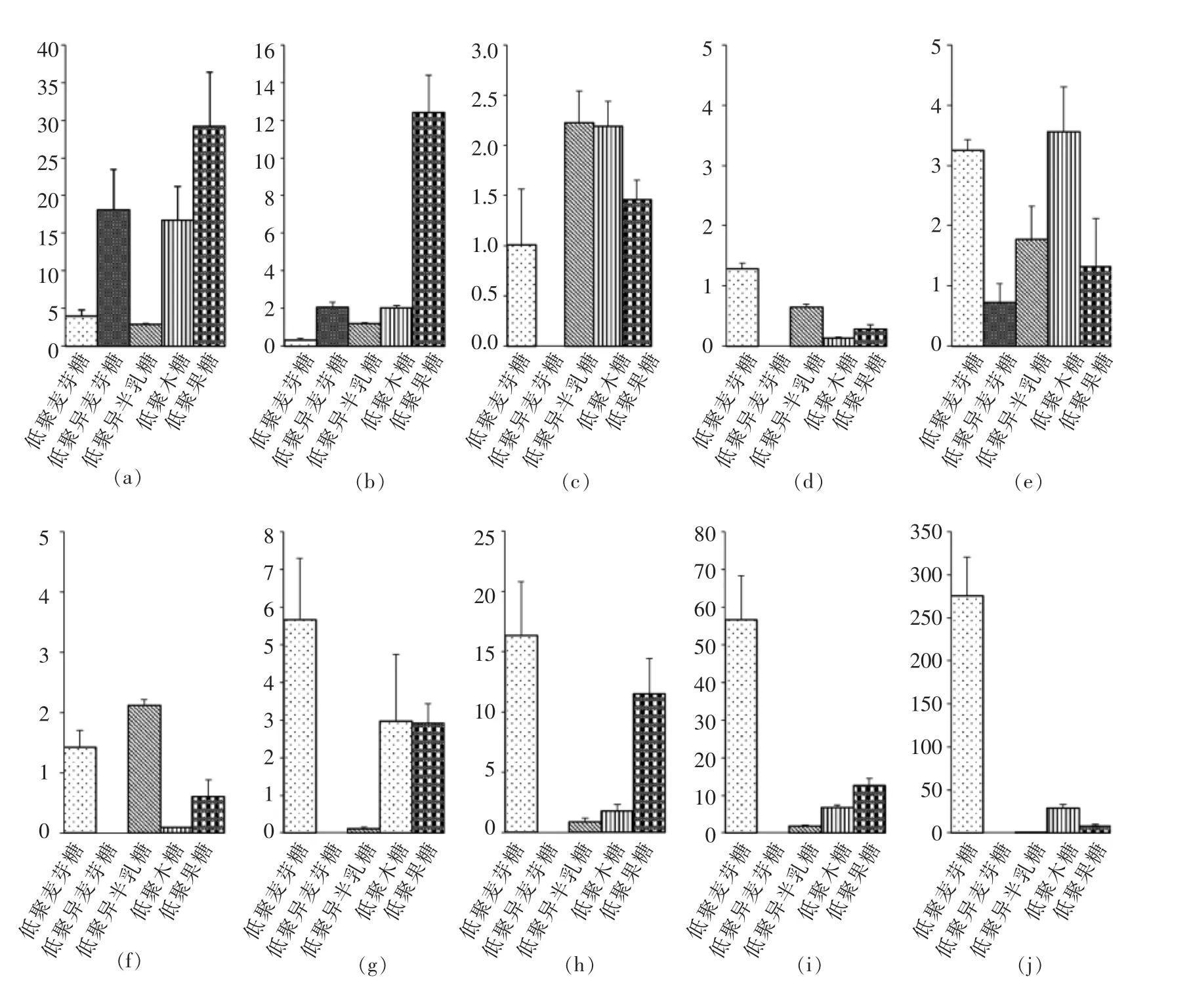
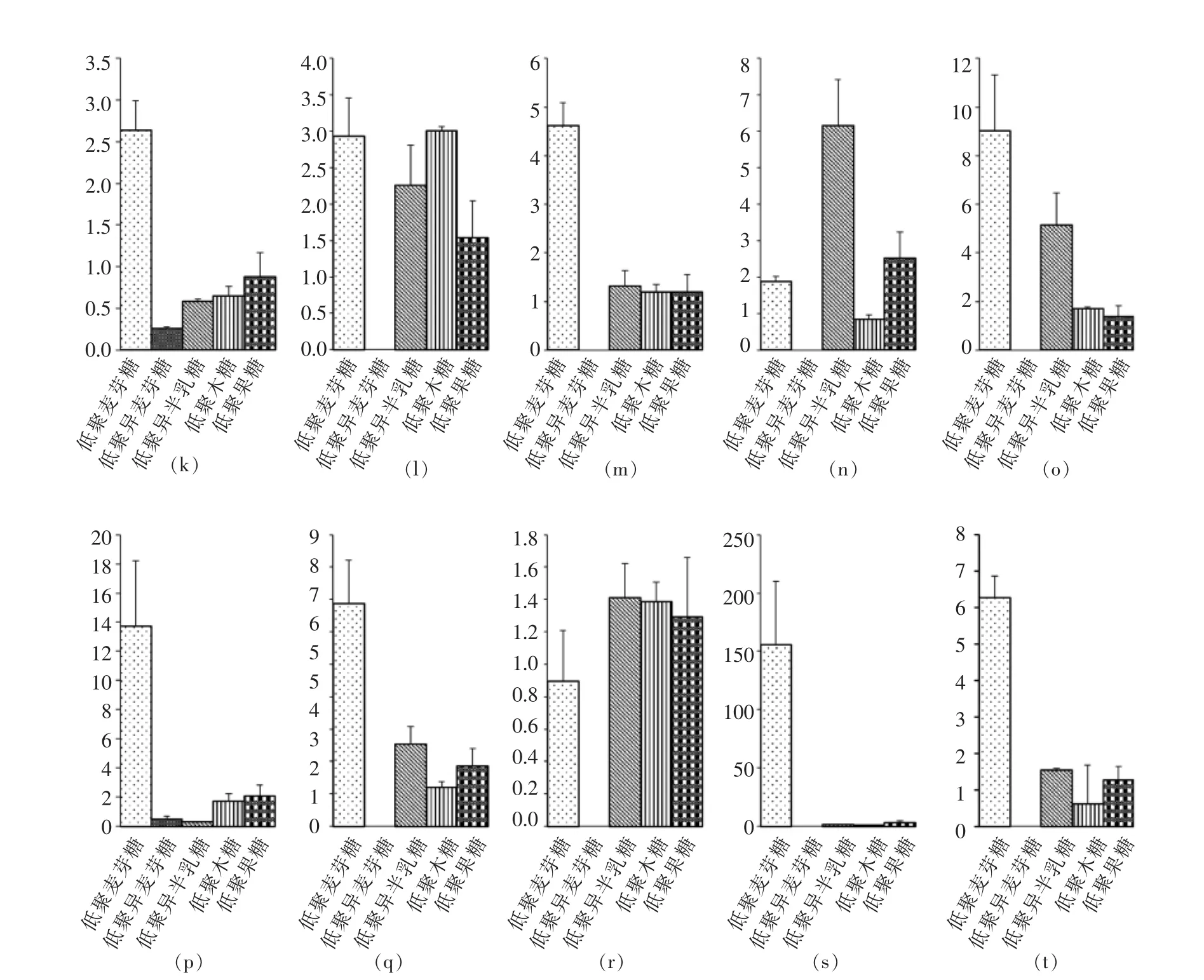
图2 转运子基因在预测寡糖底物中的表达变化Fig.2 Relative transcription levels of carbohydrate transporter-encoding genes from BBMN68 upon cultivation in MRS medium supplemented with various oligosaccharides
4 讨论
本文预测并验证了BBMN68对多种寡糖的影响,发现BBMN68具有转运和降解低聚木糖、低聚半乳糖、低聚异麦芽糖、低聚麦芽糖、低聚果糖的酶系统,可有效利用上述寡糖。
研究显示,BBMN68不能利用动物来源的低聚甘露糖,推测原因:(1)该菌株可能缺少特异性的甘露糖转运子;(2)该菌株可能缺少利用甘露糖的基因。低聚甘露糖糖苷水解酶将低聚甘露糖水解成甘露糖单体,提供给其它肠道微生物,实现共生。
BBMN68糖类酶系明显异于其它双歧杆菌。BBMN68中26%(16/58)的糖苷水解酶位于胞外,比例显著高于多数双歧杆菌。其中,有12个胞外糖苷水解酶的预测底物为植物细胞壁多糖。结果显示BBMN68可在常见植物细胞壁多糖降解寡糖产物中生长,却无法在未降解的多糖中生长(数据未显示)。推测原因:植物细胞壁多糖水解酶仅有外切活性,而植物细胞壁多糖结构复杂,需多种糖苷水解酶共同降解。如B.longum B667中GH51家族的糖苷水解酶AbfB,仅可内切阿拉伯聚糖、阿拉伯木聚糖等多糖,推测AbfB与其它肠道共生菌群分泌的糖苷水解酶,共同实现对多糖的降解[28]。研究发现,将长双歧杆菌与拟杆菌共同定植于无菌小鼠肠道后,拟杆菌细胞壁多糖降解基因表达量显著高于拟杆菌单独定植时,表明双歧杆菌对拟杆菌的多糖代谢过程有促进作用[29]。胞外植物细胞壁多糖降解基因帮助BBMN68实现与其它肠道微生物的和谐共生。
本文发现,双歧杆菌优势底物——淀粉,无法被BBMN68利用。BBMN68不具备胞外淀粉酶,无法降解淀粉,仅能利用糊精等淀粉部分降解产物,该特点与BBMN68的特殊来源相关。广西巴马长寿人群的饮食以未经深加工的玉米及蔬菜为主,玉米是抗性淀粉的主要来源。摄入玉米后,小肠及粪便中可检测到较高含量的糊精[30]。宿主为BBMN68提供足量的糊精,以保证其在肠道中稳定的生态位。长寿老人肠道中含有大量拟杆菌,可降解膳食纤维,为BBMN68提供除淀粉以外的纤维寡糖,保证BBMN68在肠道中的定植生长。
受限于寡糖组成结构的多样性和糖苷水解酶的特异性两点因素,本研究尚不能对全部寡糖进行精准预测。本文仅选取部分代表性寡糖,证明了寡糖代谢对BBMN68生态适应的重要性,对开发菌株特异性寡糖有重要意义。
