牡丹籽油复方软胶囊增强免疫力的功能研究
2020-01-16张梦兰张冰洁王洪新马朝阳
张梦兰,杨 琴,张冰洁,王洪新,马朝阳
(江南大学 食品学院,江苏 无锡 214122)
牡丹籽油是一种新型食用油脂,已于2011年获批为新资源食品。牡丹籽油中富含不饱和脂肪酸(>82%),主要成分为α-亚麻酸(>38%),还含有黄酮、甾醇等多种药理活性成分[1]。研究表明,牡丹籽油具有抗氧化、抗衰老、降血糖、降血脂、免疫增强、保护急性肝损伤等多种功效[2-6]。另外,姚思宇等[7]研究表明,α-亚麻酸能增强小鼠的免疫力,提高NK细胞活性,增强巨噬细胞吞噬能力。
茶叶提取物可以回升荷瘤小鼠的T细胞和NK细胞活性,其中:茶氨酸可以增强巨噬细胞吞噬活性和NK细胞活性;茶叶多糖可以显著增强IL-2、IFN-γ 水平;茶多酚可提高血清中免疫球蛋白IgG、IgM、IgA的含量,可延缓胸腺衰退,保护淋巴细胞受损,促进胸腺淋巴细胞增殖,增强人体免疫功能[8-12]。
苦瓜果肉可诱导IFN-γ 产生,促进巨噬细胞的激活;苦瓜提取液可以明显增强小鼠的非特异性免疫和体液免疫功能,其中苦瓜皂甙可通过改变T细胞各亚群比例,促进脾脏分泌IL-2,增强腹腔巨噬细胞分泌TNF-α的能力和吞噬指数;苦瓜多糖能刺激小鼠脾淋巴细胞增殖,提高巨噬细胞吞噬中性红、分泌NO的能力[13-16]。
现代社会忙碌的工作和学习使得免疫力低下的亚健康人群增多,关于增强免疫力保健品的研究也越来越多。因此,我们选择了上述3种可以增强免疫力的食品原料复配以期达到多靶点、多途径增强免疫力的目的,并且按照卫生部颁布的《保健食品检验与评价技术规范 增强免疫力功能评价方法(征求意见稿)》(2012版)的要求,对由上述3种原料组成的牡丹籽油复方软胶囊的增强免疫功效进行了研究。
1 材料与方法
1.1 实验材料
1.1.1 受试物
牡丹籽油复方软胶囊(内容物配方为牡丹籽油、茶叶提取物、苦瓜提取物,三者质量比15∶5∶3),由安徽哈博药业有限公司提供,人体推荐量0.06 g/(kg·d);牡丹籽油(α-亚麻酸含量>38%),铜陵瑞璞牡丹产业发展有限公司;茶叶提取物(茶多酚含量>30%),遵义陆圣康源有限公司;苦瓜提取物(苦瓜总皂甙含量>1.5%),桂林莱茵生物科技有限公司。
1.1.2 实验动物
C57BL/6J小鼠,由上海斯莱克实验动物有限公司提供,生产许可证号为SCXK(沪)2013-0018,SPF级,雄性,体重18~22 g。小鼠饲养于江南大学动物房,实验动物使用许可证号为SYXK(苏)2016-0045,实验环境条件为室温20~26℃、相对湿度40%~70%、光照/黑暗周期12 h/12 h。
1.1.3 主要试剂
刀豆蛋白A(ConA),西格玛奥德里奇(上海)贸易有限公司;2,4-二硝基氟苯(DNFB)、绵羊红细胞(SRBC)、RPMI 1640培养基、胎牛血清、青霉素-链霉素混合溶液、Hank’s液、豚鼠血清、琼脂糖、二甲氧唑黄(XTT)试剂盒,上海哈灵生物科技有限公司;乳酸脱氢酶(LDH)试剂盒,南京建成生物工程研究所;印度墨汁,北京化学试剂公司;YAC-1细胞,中科院上海细胞库;单分散荧光微球(聚苯乙烯微球),上海阿拉丁生化科技股份有限公司;牛血清白蛋白(BSA)、KH2PO4、Na2HPO4·12H2O、硫化钡,国药集团化学试剂有限公司。完全培养基:RPMI 1640培养液过滤除菌,用前加入10%胎牛血清、1%谷氨酰胺(200 mmol/L)、青霉素(100 U/mL)、链霉素(100 μg/L)及5×10-5mol/L的2-巯基乙醇,用无菌的1 mol/L HCl或1 mol/L NaOH调pH至7.0~7.2。ConA液:用双蒸水配制成100 μg/mL的溶液,过滤除菌,于-20℃保存。
1.1.4 主要仪器
UV-2100紫外分光光度计,上海尤尼柯仪器有限公司;AR224CN电子天平,奥豪斯仪器(上海)有限公司;ELISA全自动酶标仪,济南博鑫生物技术有限公司;CO2培养箱、生物安全柜,赛默飞世尔科技公司;耳肿打孔器,北京环球生物科技有限公司。
1.2 实验方法
1.2.1 淋巴细胞体外增殖实验(XTT法)
脱颈椎处死小鼠,无菌取脾,将脾磨碎后,用全自动细胞计数仪计数活细胞,调整浓度为2×107个/mL,取100 μL加入96孔板;用完全培养基分别配制牡丹籽油、茶叶提取物和苦瓜提取物不同浓度的样液,对照组加100 μL完全培养基,过无菌滤膜,加入上述培养板中,每个样做6个平行,其中3个孔加入7.5 μL ConA液,分别加入完全培养基补足体积至200 μL,使得培养时样品质量浓度分别为4、6、8 mg/mL。在CO2培养箱中孵育72 h,结束前4 h加入XTT,用酶标仪在450 nm处检测光密度。计算不加ConA的孔和加入ConA的孔的光密度差值[17],以光密度差值表征淋巴细胞体外增殖能力。
培养方法同上,以8 mg/mL为总作用质量浓度,根据牡丹籽油复方软胶囊3种成分比例计算得到牡丹籽油、茶叶提取物、苦瓜提取物的质量浓度分别为5.22、1.74、1.04 mg/mL,以对照组、牡丹籽油组(A组)、茶叶提取物组(B组)、苦瓜提取物组(C组)、牡丹籽油+茶叶提取物组(A+B组)、牡丹籽油+苦瓜提取物组(A+C组)、茶叶提取物+苦瓜提取物组(B+C组)和牡丹籽油+茶叶提取物+苦瓜提取物组(A+B+C组)为受试样液,测定各组对淋巴细胞的体外增殖能力。
1.2.2 动物分组与给药
将160只小鼠随机分为4个大组:免疫I组,进行ConA诱导的小鼠淋巴细胞转化实验、NK细胞活性的测定;免疫Ⅱ组,进行迟发型变态反应实验和脏体比测定;免疫Ⅲ组,进行小鼠腹腔巨噬细胞吞噬荧光微球实验,抗体生成细胞数的测定;免疫Ⅳ组,进行碳廓清实验。每个大组随机分为4个小组,每组10只,分别为阴性对照组和低、中、高剂量组。
以人体推荐摄入量的5、10、30倍,设置低、中、高3个剂量组,分别为0.3、0.6、1.8 g/(kg·d),其中α-亚麻酸剂量分别为74.4、148.8、446.4 mg/(kg·d)。小鼠灌胃体积为10 mL/kg。取牡丹籽油复方软胶囊内容物3、6、18 g,分别用1%羧甲基纤维素钠水溶液定容至100 mL,即为不同质量浓度的灌胃剂。各组灌胃给予受试物,阴性对照组给予等体积1%羧甲基纤维素钠水溶液,每天1次,连续灌胃1个月。
1.2.3 脏体比测定
脱颈椎处死动物,取其胸腺及脾脏,称重,计算胸体比和脾体比。
1.2.4 ConA诱导的小鼠淋巴细胞转化实验(XTT法)
脱颈椎处死动物,无菌取脾,将脾磨碎后,用全自动细胞计数仪计数活细胞,调整浓度为5×107个/mL,取100 μL加入96孔板,每个动物做4个平行,其中2个孔加入7.5 μL ConA液,2个孔不加,然后所有孔加入完全培养基补足体积至200 μL,在CO2培养箱中孵育72 h,结束前4 h加入XTT,用酶标仪在450 nm处检测每孔的光密度。计算不加ConA的孔和加入ConA的孔光密度的差值[18]。
1.2.5 二硝基氟苯诱导小鼠迟发型变态反应(DTH)
在给药实验结束前6 d,每鼠腹部皮肤用硫化钡脱毛,范围约3 cm×3 cm,用DNFB溶液50 μL均匀涂抹致敏。5 d后,用DNFB溶液10 μL均匀涂抹于小鼠右耳(两面)进行攻击。攻击24 h后颈椎脱臼处死小鼠,剪下左右耳壳。用打孔器取下直径8 mm的耳片,称重,并计算左右耳片的质量差[18]。
1.2.6 抗体生成细胞数的测定
在给药实验结束前5 d,每鼠腹腔注射0.2 mL 2%压积SRBC,5 d后脱颈椎处死小鼠,脾细胞磨碎后用RPMI 1640培养基制备成(5~10)×106个/mL 的悬液,在底层培养基(0.5 g琼脂糖加入100 mL灭菌生理盐水中,加热溶解,50℃左右时,以1 mL/孔的量加至6孔培养板中,琼脂凝固后备用)上加入脾细胞悬液和顶层培养基(0.5 g琼脂糖加入100 mL Hank’s液(pH 7.2~7.4)中,加热溶解,以0.5 mL/试管的量加至46~50℃恒温的试管中),将培养板放入CO2培养箱中孵育1 h,然后每孔加入500 μL补体,继续孵育2 h,自动图像分析仪读取溶血空斑图像,分析软件计数溶血空斑数[18]。
1.2.7 小鼠碳廓清实验
每鼠尾静脉注入用生理盐水稀释4倍的印度墨汁,注射量按0.1 mL/10 g计算,待墨汁注入后,立即计时。注入墨汁后第2、10 min,分别从内眦静脉丛取血20 μL,加入到2 mL 0.1% Na2CO3溶液中,在600 nm波长处测定光密度。第二次采血结束后,立即处死小鼠,取肝脏和脾脏,用滤纸吸干脏器表面血污,称重,计算吞噬指数[18]。
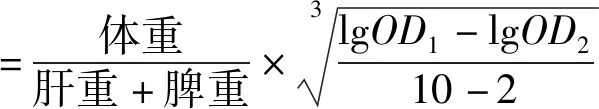
式中:OD1和OD2分别为血样在2、10 min时测定的光密度。
1.2.8 小鼠腹腔巨噬细胞吞噬荧光微球实验
脱颈椎处死小鼠,腹腔注射3 mL加胎牛血清的Hank’s液,轻轻按揉腹部充分洗出腹腔巨噬细胞,然后将腹壁剪开一个小口,吸取腹腔洗液2 mL,用75 μm过滤器过滤至试管内,调整巨噬细胞数为(4~6)×105个/mL,取1 mL于6孔培养板中,加入荧光微球,CO2培养箱37℃避光孵育90~120 min,弃上清,用磷酸盐缓冲液(PBS)洗涤2次后,用细胞刮刮下贴壁细胞,吹打均匀,过滤,上流式细胞仪检测分析,计算吞噬率和吞噬指数[18]。
吞噬率=吞噬荧光微球的巨噬细胞数/计数的巨噬细胞数×100%
吞噬指数=被吞噬的荧光微球总数/计数的巨噬细胞数
1.2.9 NK细胞活性的测定
无菌取小鼠的脾,将脾磨碎并裂解红细胞后,用全自动细胞计数仪计数活细胞,调整浓度为2×107个/mL,调整靶细胞(YAC-1)浓度至4×105个/mL,在U型96孔板中加入100 μL靶细胞和100 μL效应细胞(NK细胞)即为反应孔,加入100 μL靶细胞和100 μL培养液即为自然释放孔,加入100 μL靶细胞和100 μL 2.5% Triton即为最大释放孔。于37℃ CO2培养箱培养4 h,离心后吸取上清液100 μL于平底96孔板中,加入LDH,反应3 min后加入250 μL 0.4 mol/L NaOH溶液,测定490 nm处的光密度,并计算NK细胞活性[18]。
NK细胞活性=(反应孔OD-自然释放孔OD)/(最大释放孔OD-自然释放孔OD)×100%
1.2.10 数据处理与结果判定
采用SPSS 10.0统计软件分析。根据《保健食品检验与评价技术规范》,在细胞免疫功能、体液免疫功能、单核-巨噬细胞功能、NK 细胞活性4个方面任何2个方面结果为阳性,可判定该受试样品具有增强免疫力的功能。在每个方面需要该方面下的2个实验结果均为阳性,或NK细胞活性测定实验的1个以上剂量结果为阳性,才能判定该方面的结果为阳性[17-18]。
2 结果与讨论
2.1 受试物对小鼠淋巴细胞体外增殖能力的影响(见表1、表2)
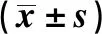
表1 3种质量浓度受试物对小鼠淋巴细胞体外增殖能力的影响
由表1可知,茶叶提取物在4、6、8 mg/mL时均可以显著增强小鼠淋巴细胞体外增殖能力,苦瓜提取物在6、8 mg/mL时可以显著增强小鼠淋巴细胞体外增殖能力,而牡丹籽油在8 mg/mL时能显著增强小鼠淋巴细胞体外增殖能力。在相同质量浓度时,茶叶提取物增强小鼠淋巴细胞体外增殖能力的效果最好。
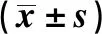
表2 在复方软胶囊配方比例下受试物对小鼠淋巴细胞体外增殖能力的影响
由表2可知,在复方软胶囊的配方比例下,苦瓜提取物对小鼠淋巴细胞体外增殖能力几乎没有增强效果,茶叶提取物和牡丹籽油则具有显著增强效果,且茶叶提取物的效果强于牡丹籽油,3种成分之间并不具有拮抗作用。该配方中,茶叶提取物起主要作用,牡丹籽油次之,最后是苦瓜提取物。
2.2 受试物对小鼠体重的影响(见表3)

表3 受试物对小鼠体重增长率的影响
由表3可知,各大组的3种剂量组的小鼠体重增长率与阴性对照组比较均无显著性差异(P>0.05)。说明受试物不会影响正常小鼠的体重。
2.3 受试物对小鼠脏体比的影响(见表4)

表4 受试物对小鼠脏体比的影响
由表4可知,与阴性对照组比较,3个剂量组小鼠胸体比与脾体比均无显著性差异(P>0.05)。说明不能通过增加免疫器官的质量来发挥增强免疫力的作用。
2.4 受试物对ConA 诱导的小鼠淋巴细胞增殖能力的影响(见表5)
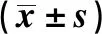
表5 受试物对ConA 诱导的小鼠淋巴细胞增殖能力的影响
由表5可知,各剂量组小鼠淋巴细胞增殖能力均增加,与阴性对照组比较,中剂量组差异显著(P<0.05),高剂量组差异极显著(P<0.01)。这说明受试物能显著增强小鼠的淋巴细胞增殖能力,增强细胞免疫功能。有研究表明茶多酚可保护淋巴细胞受损、促进淋巴细胞增殖,这可能是脾脏中原始细胞向T细胞分化的结果;苦瓜皂甙和α-亚麻酸均可以增强CD8+细胞的增殖,降低CD4+/CD8+比值,改善机体免疫状态;苦瓜多糖能刺激小鼠淋巴细胞增殖[12,15-16,19]。
2.5 受试物对DNFB诱导小鼠DTH的影响(见表6)
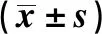
表6 受试物对DNFB诱导小鼠DTH的影响
由表6可知,各剂量组小鼠左右耳质量差值均增加,与阴性对照组比较,差异均有显著性意义(P<0.05)。这说明该受试物可以显著增强小鼠的细胞免疫功能。有研究表明给药量为88.8 mg/kg 纯α-亚麻酸时,可显著增加小鼠左右耳质量差值,增强迟发型变态反应,本实验低剂量组中牡丹籽油的添加量按α-亚麻酸计为74.4 mg/kg ,实验结果与文献[7]结果一致。
2.6 受试物对小鼠抗体生成细胞数的影响(见表7)

表7 受试物对小鼠抗体生成细胞数的影响
由表7可知,与对照组比较,各剂量组小鼠的溶血空斑数均不具有显著性差异(P>0.05)。这说明该受试物不能显著增强小鼠的体液免疫功能。
2.7 受试物对小鼠碳廓清实验吞噬指数的影响(见表8)

表8 受试物对小鼠碳廓清实验吞噬指数的影响
由表8可知,高剂量组小鼠的吞噬指数与对照组比较,差异有显著性意义(P<0.05)。说明该受试物可以增强小鼠的碳廓清能力。有研究表明给药量为355.4 mg/kg 纯α-亚麻酸,可显著提高小鼠碳廓清能力,本实验高剂量组α-亚麻酸剂量为446.4 mg/kg,实验结果与文献[7]结果一致。
2.8 受试物对小鼠巨噬细胞吞噬荧光微球的影响(见表9)

表9 受试物对小鼠巨噬细胞吞噬能力的影响
由表9可知,与对照组比较,各剂量组小鼠的吞噬率和吞噬指数差异均不具有显著性意义(P>0.05)。说明该受试物不能增强小鼠的巨噬细胞吞噬功能。
2.9 受试物对小鼠NK细胞活性的影响(见表10)

表10 受试物对小鼠NK细胞活性的影响
由表10可知,与对照组比较,中、高剂量组小鼠的NK细胞活性差异均具有极显著性意义(P<0.01)。说明该受试物可以增强小鼠的NK细胞活性。有研究表明给药量为177.7 mg/kg纯α-亚麻酸,可显著提高小鼠NK细胞活性,本实验中剂量组α-亚麻酸剂量为148.8 mg/kg ,实验结果与文献[7]结果一致,同时茶叶提取物也可以回升荷瘤小鼠NK细胞活性[9]。
3 结 论
体外细胞实验结果表明,3种成分(茶叶提取物,苦瓜提取物和牡丹籽油)在体外均可以增强淋巴细胞增殖能力,相同质量浓度下茶叶提取物效果最好,苦瓜提取物次之,牡丹籽油最差;在复方软胶囊所用的配方比例下,茶叶提取物效果最好,牡丹籽油次之,苦瓜提取物最差。细胞免疫功能检测项目中的2个实验(小鼠淋巴细胞转化实验和迟发型变态反应实验)结果均为阳性,可判定细胞免疫功能测定结果阳性。体液免疫功能测定项目中,抗体生成细胞数检测结果为阴性,可判定体液免疫功能测定结果为阴性。单核巨噬细胞功能测定项目中,小鼠碳廓清实验结果为阳性,小鼠腹腔吞噬细胞吞噬荧光微球实验结果为阴性,可判定单核巨噬细胞功能结果为阴性。NK细胞活性测定实验中1个以上剂量组的结果呈阳性,可判定NK 细胞活性结果为阳性。在本实验条件下细胞免疫功能和NK细胞活性结果为阳性,体液免疫功能和单核-巨噬细胞功能均为阴性,表明牡丹籽油复方软胶囊具有增强免疫力功能。
