丁基苯酞对脑出血大鼠血管内皮生长因子、血管生成素-2蛋白表达及血管新生的影响
2020-01-16涂鄂文刘秋庭谭莉曾艳香陈琼
涂鄂文,刘秋庭,谭莉,曾艳香,陈琼
脑出血(intracerebral hemorrhage,ICH)引起的神经功能缺损除了血肿本身引起占位效应外,血肿周围局部血流量降低和结构性缺血性损害进一步加重神经功能损伤[1-2]。依据神经血管单元(neurovascular unit,NVU)治疗新观点,血管新生有望成为卒中治疗的新靶点。通过刺激血肿周围局部缺血部位的血管新生,重建微血管系统,改善脑组织血氧供应,稳定血脑屏障,可发挥神经保护作用从而减轻神经功能缺损[3]。本研究通过观察大鼠ICH后脑组织中血管内皮生长因子(vaseular endothelial growth factor,VEGF)、血管生成素-2(angiopoietin-2,Ang-2)蛋白在不同时间点的动态表达及其在不同剂量丁基苯酞干预后的变化,探讨丁基苯酞对ICH大鼠可能的神经保护作用及机制。
1 研究对象与方法
1.1 实验动物与实验试剂 健康雄性成年清洁级SD大鼠,体重210±20 g,8~12周龄,均由湖南中医药大学东塘动物实验中心提供,生产许可证号:SCXK(湘)2016-0002。兔抗VEGF多克隆抗体、兔抗Ang-2多克隆抗体、兔抗鼠CD34单克隆抗体均由武汉博士德生物制剂公司提供。丁基苯酞原液由石药集团恩必普药业有限公司提供。
1.2 动物造模与实验分组 参照Gary A.Rosenberg等[4]的方法制备ICH大鼠模型,大鼠经10%水合氯醛(400 mg/kg)腹腔注射麻醉,俯卧位,沿头皮正中线切口,充分暴露前囟,然后定位于前囟前0.2 mm,正中线向右旁开3 mm处钻一小孔,直径为0.5 mm,进针约5.5 mm,用微量进样器以10 μL/min的速度注入自体血100 μL。麻醉苏醒后,根据Longa评分法[5]进行神经功能缺损评分,1~3分造模成功大鼠。造模成功后,将大鼠随机分为脑出血模型组、丁基苯酞低剂量组及丁基苯酞中剂量组。假手术组于相同部位注入等量无菌0.9%氯化钠注射液。
假手术组、脑出血模型组、丁基苯酞低剂量组及丁基苯酞中剂量组各40只大鼠,每组分为1 d、3 d、7 d、15 d 4个亚组,每个亚组10只。
1.3 分组处理 于造模成功6 h后,分别给予丁基苯酞低剂量组和中剂量组大鼠丁基苯酞10 mg/kg、25 mg/kg,溶于大豆油中,每日2次灌胃,假手术组及脑出血模型组大鼠则在相同时间用同等体积大豆油代替灌胃。分别在术后1 d、3 d、7 d、15 d通过Longa评分法评估神经功能缺损。然后处死大鼠,取脑组织,其中每亚组取5只进行VEGF和Ang-2蛋白表达、新生血管计数和血管场面积测定;另外5只7 d、15 d进行血肿体积测定(1 d、3 d做脑水含量测定观察脑水肿)。
1.4 血管内皮生长因子和血管生成素-2蛋白测定 分别在术后1 d、3 d、7 d、15 d,取以大鼠右侧苍白球(血肿)为中心的基底节部分脑白质,在机械匀浆器中加入5倍体积量的裂解液,裂解完全,4 ℃离心收集上清液,采用BCA蛋白定量法测定裂解蛋白浓度。采用SDS-PAGE凝胶电泳(时间4~6 h,电压100 V)。将电泳后的蛋白转移至经甲醇活化的PVDF膜上,加入封闭缓冲液室温振荡1 h,依次孵育一抗、二抗,化学发光法曝光显色。胶片用扫描仪将图像输入电脑,ImagePro-plus 6.0图像分析软件,β-actin蛋白作为内参照,计算VEGF和Ang-2蛋白吸光度值/内参照蛋白吸光度值的比值。
1.5 微血管计数及血管场面积测定 分别在术后1 d、3 d、7 d、15 d,取大鼠右侧血肿周围脑组织进行梯度酒精脱水、透明、浸蜡、石蜡包埋、切片。采用免疫组化法(SP法染色,DAB显色)观察CD34的表达。
先在低倍镜下寻找条索状或圆形空洞的褐色新生血管,寻找阳性血管表达最密集处,随机选取5个区域进行高倍镜(×200)统计视野血管数,以条索状或中心空洞算一条进行计数,进行微血管计数(单个内皮细胞或内皮细胞簇均算为一个血管计数,管腔>8个红细胞直径或带有较厚基层的血管不计数),取平均值,采用图像处理系统进行图像分析,血管场面积为所测得有效血管截面面积与统计场面积的千分比。
1.6 测量血肿体积 分别在术后7 d、15 d,将大鼠脑组织从额部至枕部均匀切成厚度约1 mm的冠状脑片,按顺序排列后拍照,将图片扫描输入奥申影像采集系统测量脑血肿面积,根据公式:V=T1×A1+T2×A2 ……+Tn×An(V为血肿体积,A为单个层面血肿面积,T为对应冠状脑片的切片厚度)计算血肿体积(mm3)。
2 结果
2.1 丁基苯酞对神经功能缺损的影响 ICH模型制作成功后,除假手术组外,其他各组神经功能缺损评分均呈先升高后降低的趋势,脑出血模型组神经功能缺损评分的高峰是在术后3 d,而丁基苯酞低剂量、中剂量组神经功能缺损的高峰在术后1 d。在术后3 d、7 d、15 d,丁基苯酞中剂量组神经功能缺损评分均低于脑出血模型组(P=0.044,P=0.010,P=0.006),丁基苯酞低剂量组术后3 d神经功能缺损评分低于脑出血模型组(P=0.047),差异有统计学意义(表1)。
2.2 丁基苯酞对VEGF蛋白表达的影响 假手术组不同时间点VEGF蛋白均极少表达,脑出血模型组及丁基苯酞组术后1 d开始VEGF蛋白表达上升,并随出血时间延长表达逐渐增加,术后15 d达高峰;丁基苯酞低剂量组在术后7 d、15 d VEGF蛋白表达与脑出血模型组比较增加(P=0.042,P<0.001),差异有统计学意义。而丁基苯酞中剂量组则在1 d、3 d、7 d和15 d各时间点VEGF蛋白表达与脑出血模型组比较均增加(P<0.001,P=0.008,P=0.016,P<0.001),差异有统计学意义(表2)。
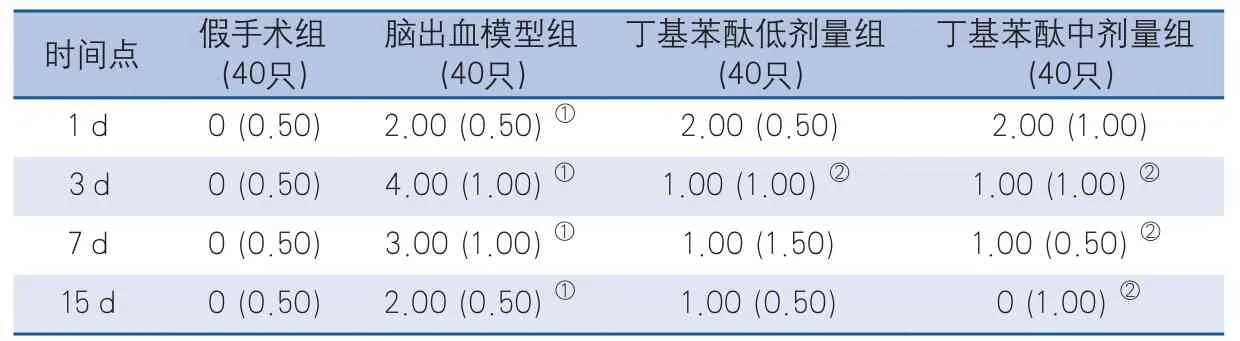
表1 不同时间点各组大鼠Longa神经功能缺损评分(单位:分)
2.3 丁基苯酞对Ang-2蛋白表达的影响 假手术组少量表达Ang-2蛋白,脑出血模型组和丁基苯酞组从术后1 d开始Ang-2蛋白表达上调,术后15 d达高峰;与脑出血模型组相比,丁基苯酞低、中剂量组在各时间点的Ang-2蛋白表达明显增加(均P<0.001);1 d、3 d、7 d和15 d丁基苯酞中剂量组Ang-2蛋白表达均明显高于低剂量组(P=0.031,P<0.001,P<0.001,P<0.001),差异均有统计学意义(表3)。
2.4 丁基苯酞对新生血管的影响 假手术组不同时间点新生血管计数极少,脑出血模型组和丁基苯酞组新生血管计数均明显增加,并随出血时间延长表达逐渐增加,于15 d达高峰;与脑出血模型组相比,丁基苯酞低(P=0.038,P<0.001,P<0.001,P=0.016)、中剂量组(均为P<0.001)新生血管计数在1 d、3 d、7 d和15 d均增加,差异有统计学意义;1 d、3 d、7 d和15 d丁基苯酞中剂量组新生血管计数均高于低剂量组(P=0.033,P=0.008,P<0.01,P=0.019),差异有统计学意义(表4,图1)。
2.5 丁基苯酞对血管场面积的影响 术后3 d、7 d、15 d脑出血模型组较假手术组相比血管场面积均增加(均为P<0.001),并随出血时间延长逐渐增大,于15 d达高峰;术后3 d、7 d、15 d丁基苯酞中剂量组与脑出血模型组比较血管场面积均增加(均为P<0.001);术后7 d、15 d丁基苯酞中剂量组与丁基苯酞低剂量组比较血管场面积均增加(P=0.044,P=0.031),差异有统计学意义(表5)。
2.6 丁基苯酞对血肿体积的影响 丁基苯酞低、中剂量组与脑出血模型组在术后7 d、15 d血肿体积均无明显差异(表6)。
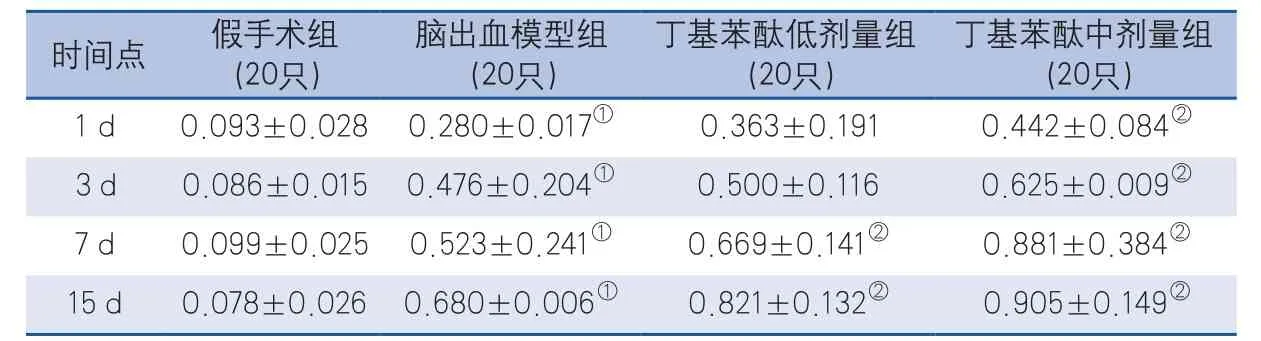
表2 不同时间点各组大鼠VEGF蛋白与β-actin光密度比值

表3 不同时间点各组大鼠Ang-2蛋白与β-actin蛋白光密度比值
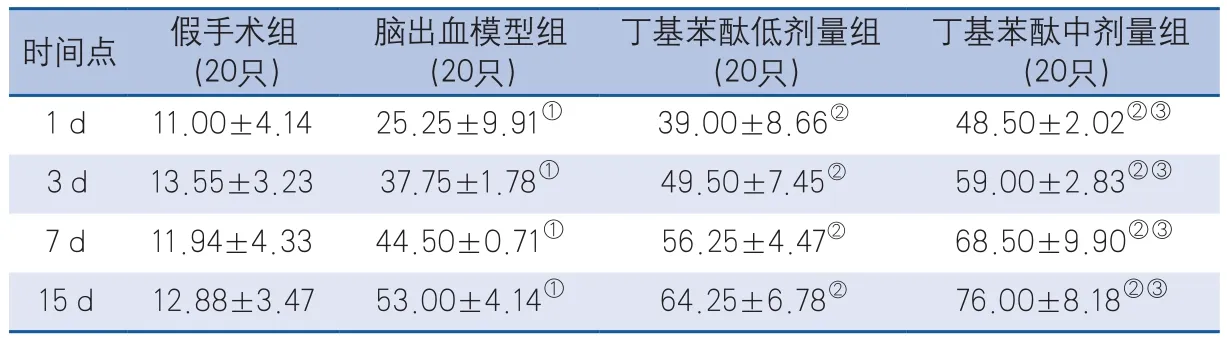
表4 不同时间点各组大鼠新生血管计数(单位:个)
3 讨论
近年来,NVU已成为卒中研究的热点。NVU是由神经元、星形胶质细胞、微血管内皮细胞、周细胞及细胞外基质等细胞组分构成的一种结构和功能相对独立的多细胞复合体[7]。NVU这一概念的提出引导了治疗策略从对单一神经元的保护向对神经元、微血管及支持细胞复合体的保护。血管新生是指从原有的血管上以出芽的方式形成新的血管的过程[8-10],治疗性血管新生又称为促血管新生,是人为的诱导缺血组织周围的血管新生和侧支血管形成,在ICH中可改善NVU中的微血管系统,为损伤的神经元修复及突触重建创造良好的微环境。因此,促进血管新生有望成为出血性卒中治疗的新靶点。
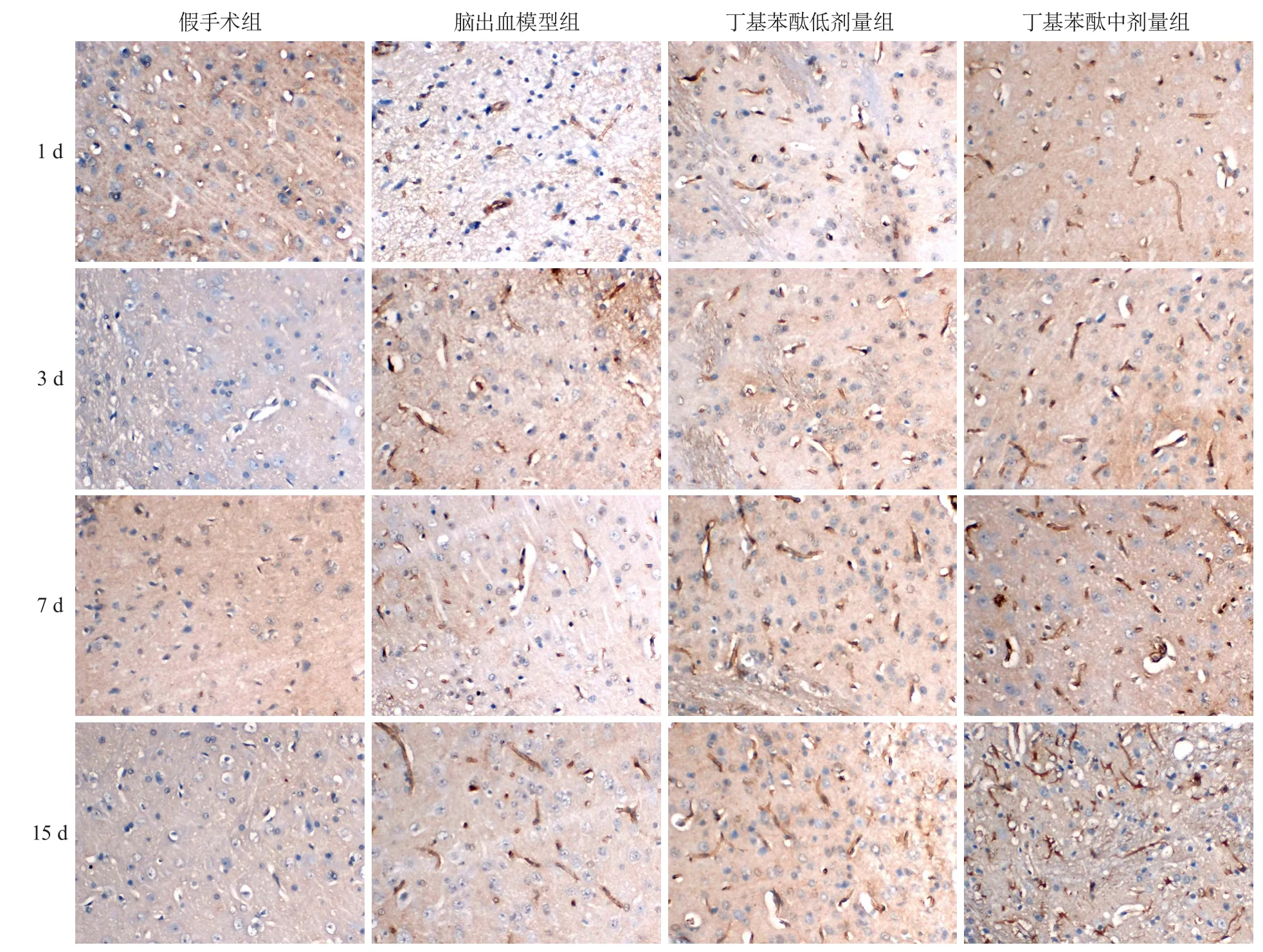
图1 不同时间点各组大鼠新生血管计数(SP法染色,×200)
VEGF是序列高度保守的二聚体糖蛋白,是血管内皮细胞特异性的有丝分裂原,是目前发现的机体内最重要的促血管生长因子。VEGF与受体VEGFR-1、VEGFR-2等结合后,激活络氨酸激酶,导致大量钙离子内流从而引发级联放大反应过程,引起血管内皮细胞通透性增加及形成临时基质、介导内皮细胞增殖、分化等一系列生物效应,促进血管生成[11]。Ang-2是血管生成素家族成员之一。当VEGF等促血管生成因子存在时,Ang-2通过抑制Ang-1促血管稳态的作用,使细胞外基底膜及管周细胞松解,并使血管内皮细胞处于对VEGF的高反应状态,有利于血管出芽、生长,与VEGF协同作用促进内皮细胞的迁移、血管的新生,增加缺血区血管密度,重建微血管系统[12-15]。Jeremy Ben-Shoshan等[16]发现经导管主动脉瓣置换术(Transcatheter aortic valve replacement,TAVR)患者潜在血管生成转变与VEGF和Ang-2蛋白的表达增加具有明显相关性。Siobhan Conroy等[17]研究表明,Ang-2和VEGFA蛋白的高表达与胶质母细胞瘤(Glioblastoma,GBM)的血管生成具有很强的正相关性。
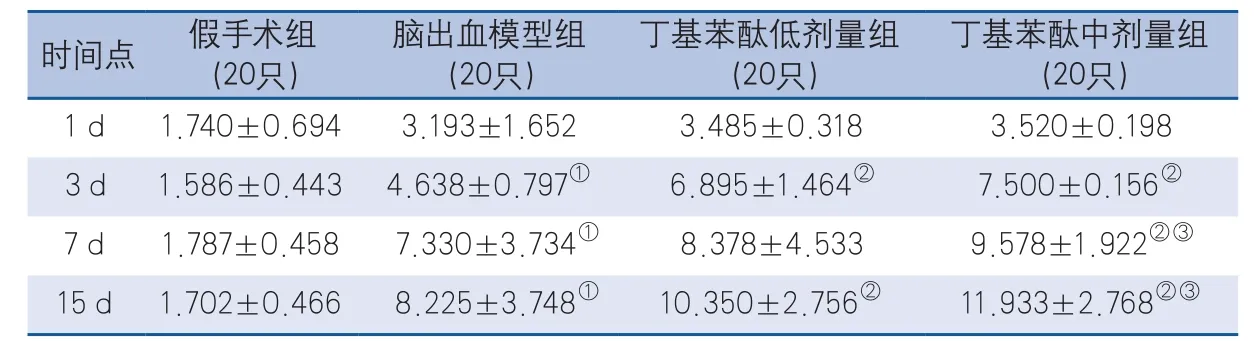
表5 不同时间点各组大鼠血管场面积(单位:‰)

表6 不同时间点各组大鼠血肿体积(单位:mm3)
研究发现CD34抗原在新生血管内皮中表达远远大于非新生血管内皮,是最敏感的新生血管内皮标志物,CD34阳性表达是检测早期新生血管的良好方法[18],可作为缺血组织周围微循环改善的依据。本研究利用CD34标记新生血管,发现脑出血模型组新生血管计数随出血时间延长表达逐渐增加,与VEGF、Ang-2蛋白表达呈现并行关系,均在ICH后7~15 d达到高峰,与Peng Zhengrong等[19]和Rebecca Senn等[20]的研究结果相一致。进一步证明ICH后新生血管与VEGF、Ang-2蛋白表达的持续升高密切相关。其原因可能与ICH时血肿的压迫导致局部微循环破坏,血肿及血肿周围区缺血缺氧进而启动了脑组织抵抗缺血和缺氧的防御性反应,使脑组织VEGF及其受体表达上调有关。
丁基苯酞(dl-3-n-butylphthalide)是由芹菜籽中提取出的有效成分左旋丁基苯酞与其合成的异构体右旋丁基苯酞两者的混合物。目前对于丁基苯酞的研究也主要集中在缺血性脑血管病的治疗方面。研究发现丁基苯酞具有重构缺血区微循环、增加缺血区脑灌注[21]、保护线粒体、抑制神经细胞凋亡[22]、清除自由基[23]、减少炎症反应及氧化反应[24]、减轻脑水肿[25]等作用。Zhao Yujun等[26]采用Longa改良缝线闭塞法制备永久性大脑中动脉闭塞模型,发现丁基苯酞可增加VEGF的表达,缓解脑梗死小鼠的脑水肿,降低血脑屏障的通透性,改善小鼠神经功能缺损,与Tang S.C.等[27]研究结果相一致。Li Wenxin等[28]研究发现,在慢性脑低灌注大鼠模型中,经丁基苯酞治疗后Ang-2、VEGF蛋白表达量在相应的时间均明显增加。目前,丁基苯酞用于ICH的研究较少,本研究结果提示丁基苯酞干预后可以上调VEGF、Ang-2蛋白表达,增加ICH血肿周围新生血管密度,减轻神经功能缺损。同时,通过对血肿体积的测量,初步证明丁基苯酞并未增加颅内出血的风险。
【点睛】本研究显示丁基苯酞可以上调VEGF和Ang-2蛋白的表达,促进血肿周围血管新生并改善脑出血大鼠的神经功能缺损。
