肉桂腈的绿色合成及发光性能研究
2020-01-15肖尊宏
肖尊宏
(贵州师范大学 化学与材料科学学院,贵州 贵阳 550025)
0 引言
肉桂腈又名β-苯基丙烯腈,是一种优良的人工合成香料,其香气很像天然肉桂,具有强烈的辛香花香,在碱性介质中使用更显示出其强度高、稳定性好、持久的优点,是肉桂醛的优良代用品[1]。肉桂腈还对多种霉菌有杀(抑)菌作用,尤其对粮食、蔬菜、水果的霉菌有较好的杀菌效果[2],是一种广谱性的防霉制剂。随着国家对环保的高度重视,要求有机合成的研究重点放在对环境无污染的绿色合成上,绿色合成要求化学反应中采用环境友好的试剂、溶剂或催化剂。探索合成条件温和且环境友好的绿色合成工艺路线是现代化学面临的重要任务,绿色化学已经成为未来合成化学的发展方向。
肉桂腈的合成方法较多[3-4],通常以肉桂醛和盐酸羟胺为原料,通过缩合反应生成肟,再脱水生成肉桂腈[5],如黄祖良[6]报道了碱相转移催化脱水法、农容丰[7]用乙酐脱水法制备肉桂腈,这些肉桂腈的合成方法,大多数使用有机溶剂较多且对环境造成污染[4]。
本研究在无溶剂条件下,将商业上容易得到的ZnO催化肉桂醛和盐酸羟胺反应,“一锅煮法”合成了肉桂腈[5]。由于在合成过程中不使用有机溶剂,减少了对环境的污染,也简化了合成工艺。肉桂腈是一个共轭化合物,应具有较好的发光性质,但其发光性质报道很少,为了拓展肉桂腈的应用范围,我们对肉桂腈的发光性质做了研究。合成路线如下图1所示。
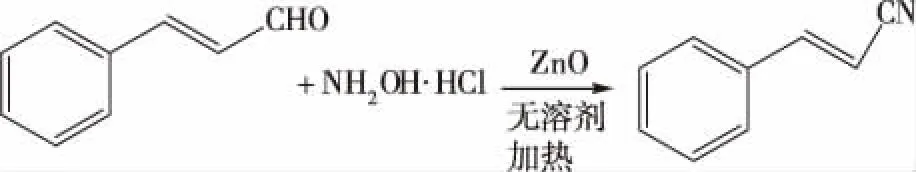
图1 肉桂腈的合成路线Fig.1 Synthetic route of cinnamonitrile
1 实验部分
1.1 实验试剂和仪器
肉桂醛,盐酸羟胺(AR,国药集团化学试剂公司),氧化锌、二氯甲烷、氯仿、无水硫酸镁均为分析纯。
元素分析采用Perkin-Elemer240c型分析(美国PE公司),采用BROKER-TENSOR 27傅里叶变换红外光谱仪测试红外光谱(KBr压片,德国 BRUKER公司);熔点采用X-6数字显微熔点测定仪测试;用Cary 100瓦里安紫外可见分光光度计测紫外光谱(美国瓦里安公司);采用INOVA-400MHz超导核磁共振波谱仪(TMS为内标,美国Varian公司)测1H NMR,荧光光谱采用CARY ECLIPSE荧光分光光度计测试(美国瓦里安公司)测试。
1.2 肉桂腈的合成
称取肉桂醛13.2 g(0.1 mol)、10.4 g(0.15 mol)盐酸羟胺和0.62 g氧化锌,混合均匀,一起加入到三口烧瓶中,加热到120 ℃反应1 h后,冷却到室温,先用二氯甲烷萃取反应混合物3次,每次用20 mL二氯甲烷萃取,然后用无水硫酸镁干燥萃取液,在常压下蒸除有机溶剂,再减压收集130~132 ℃/1.064 kPa的馏分[5],冷却到20 ℃时,得浅黄色固体10.1 g,产率78.3%。m.p.:22.1 ℃,肉桂腈C9H7N的元素分析(%)(括号内为理论值):C:83.43(83.69),H:5.49(5.46),N:10.84(10.80)。
2 结果与讨论
2.1 肉桂腈的合成探讨
由于反应物配比对产品收率有较大影响,在反应温度为120 ℃,反应时间为1 h,催化剂用量为肉桂醛质量的6%左右的条件下,肉桂醛和盐酸羟胺的量比为n肉桂醛∶n盐酸羟胺=1∶1.5,与肉桂醛相比,盐酸羟胺容易得,价格相对便宜,在反应中使盐酸羟胺过量,产率达到78.3%,与文献[5]报道的产率有一定降低,可能原因是在减压提纯过程中条件控制不好有一定损失。氧化锌是一种环境友好的催化剂,在反应合成过程中我们没有使用溶剂,达到了绿色合成的目的。
2.2 肉桂腈的氢谱(1H NMR)分析
用INOVA-400MHz超导核磁共振波谱仪(TMS为内标)测得1H NMR,如图2所示。从图2中看出,与腈基(-CN)相连的Ha原子,由于腈基是一个吸电子强的基团,使氢原子电子云密度减小而裸露,δHa向低场位移,反式肉桂腈与氰基相连的双键碳上的氢的δ值估算为5.88,与δHa实测谱图5.90和5.85处出现的峰吻合[8];Hb与C=C双键处于同一平面,双建的各向异性效应[9]使δHb向低场位移为7.38。在5.88产生二裂分的耦合常数为16.54 Hz,它对应于反式二氢的3J值[10-11]。由于肉桂腈结构属于单取代苯,且取代基为不饱和的烯基,与苯环形成共轭,使苯环电子云密度降低,表现为去屏蔽效应,苯环的氢核共振峰向低场位移,δHc:7.32,δHd:7.41,δHe:7.39。通过肉桂腈的氢谱分析,确定为反式肉桂腈。
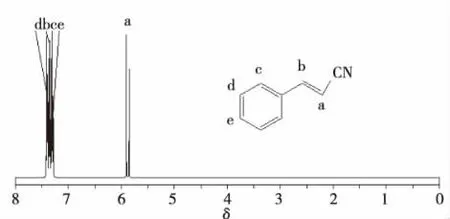
图2 肉桂腈的1HNMRFig.2 1H NMR of cinnamonitrile
2.3 肉桂腈的红外光谱分析
用BROKER-TENSOR 27傅里叶变换红外光谱仪测肉桂腈的红外光谱,如图3所示。3 089 cm-1,3 057 cm-1,3 026 cm-1处的吸收峰说明有不饱和碳原子上的氢存在,可能有苯环存在;3 000~2 800 cm-1没有吸收峰,说明化合物中不存在甲基或亚甲基,1 623 cm-1,1 597 cm-1,1 411 cm-1的吸收峰进一步说明有苯环存在,2 236 cm-1处的吸收是-CN的特征峰,说明化合物含有腈基,没有出现苯甲醛1 710 cm-1吸收峰出现说明化合物中没有羰基,已经反应完全,709 cm-1,740 cm-1处强吸收峰说明苯环上单取代[9-10], 红外光谱结果表明,该化合物正是目标化合物肉桂腈。
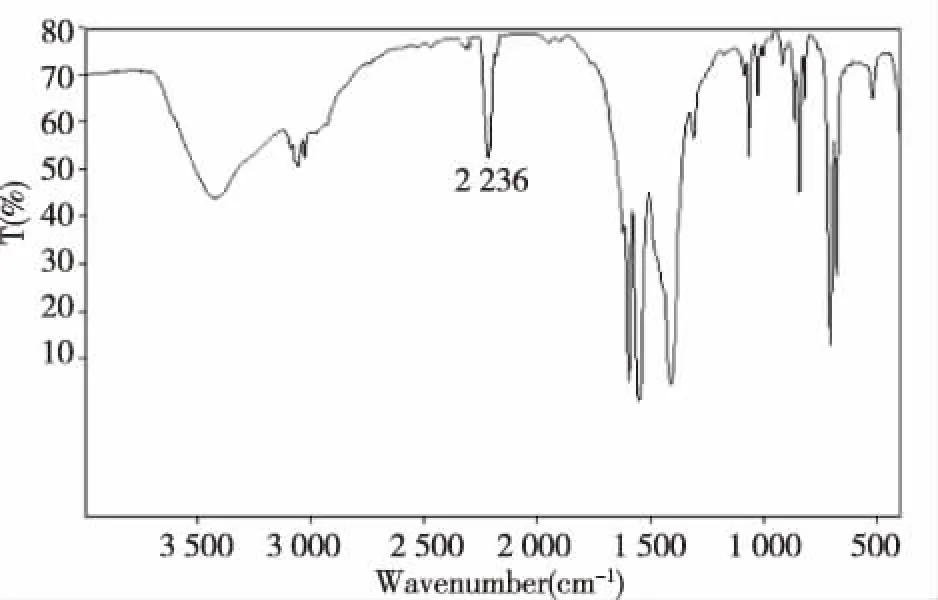
图3 肉桂腈的红外光谱图Fig.3 IR of cinnamonitrile
2.4 化合物肉桂腈紫外光谱分析
图4是肉桂腈的紫外吸收光谱。从图4看出:250~280 nm处呈现出了很强的吸收峰,最大吸收在267 nm处,这是肉桂腈腈基吸收峰,在280~380 nm处,是一系列小峰重叠在一起形成的较宽的吸收峰,这里包含了苯环由π→π*跃迁时所产生的吸收峰[11],从肉桂腈的紫外吸收光谱进一步说明我们所合成的是肉桂腈。
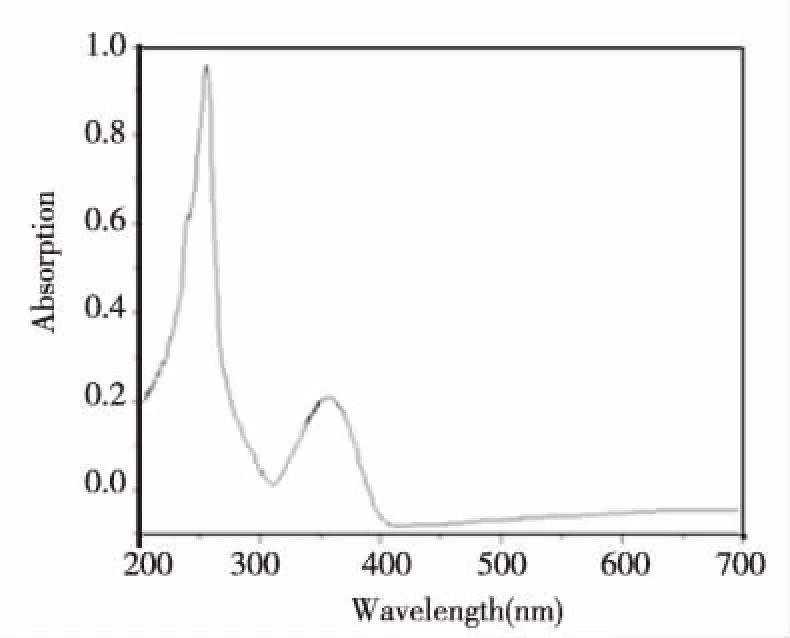
图4 肉桂腈的紫外吸收光谱图Fig.4 UV of cinnamonitrile
2.5 肉桂腈的光致发光
图5是肉桂腈的氯仿溶液的光致发光图,在359 nm的紫外光激发下,发出400~480 nm的蓝紫光,与植物光合作用所需要的蓝光420~460 nm比较吻合,图6是肉桂腈的固态发射光谱,在363 nm的紫外光激发下,发出465 nm左右的强荧光,是作物光合作用中叶绿素b、叶黄素和α叶胡萝卜素所需要的蓝光[12-15]。
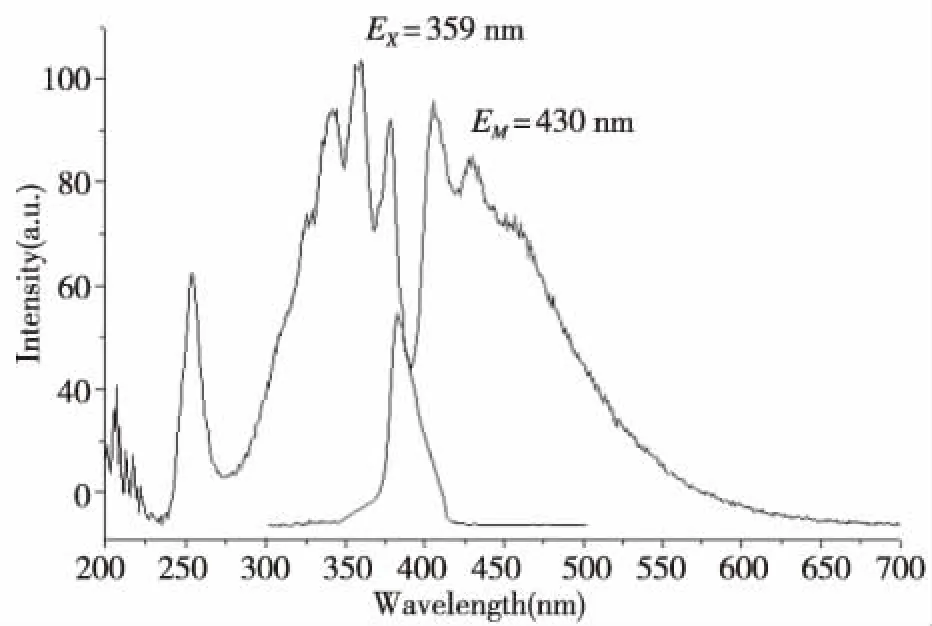
图5 肉桂腈的氯仿溶液的激发(EX)和发射光谱(EM)Fig.5 Excitation and emission spectra of cinnamonitrile chloroform solution
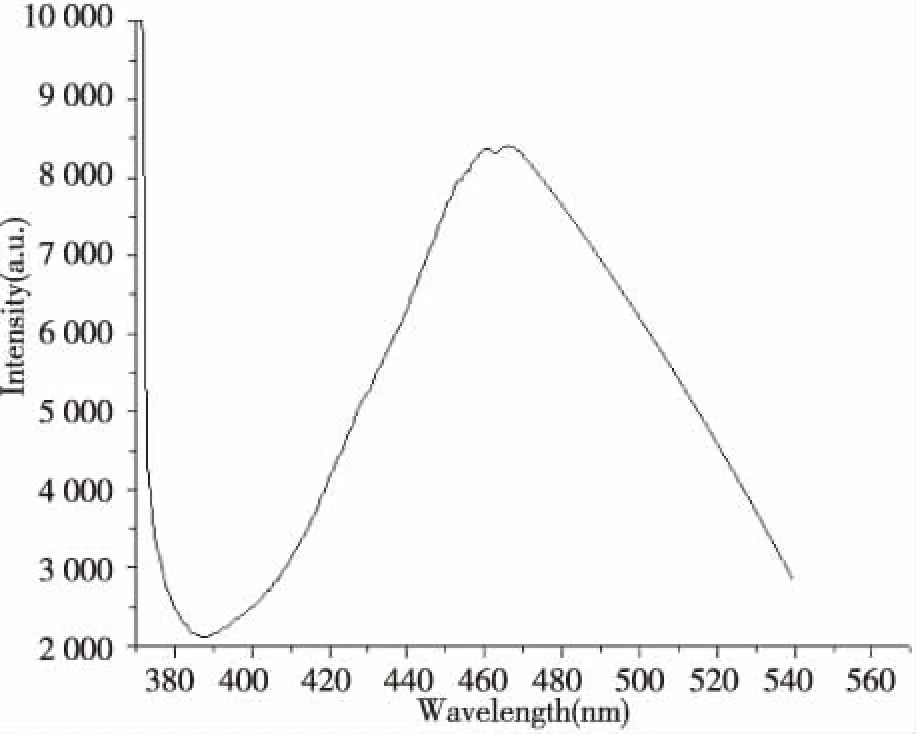
图6 肉桂腈固体的发射光谱Fig.6 Emission spectrum of solid state cinnamonitrile
3 结论
以肉桂醛、盐酸羟胺为原料,用“一锅煮法”合成了肉桂腈。在反应温度为120 ℃,反应时间为1 h,催化剂用量为肉桂醛质量的6%左右,肉桂醛和盐酸羟胺的量比为n肉桂醛∶n盐酸羟胺=1∶1.5,产率为78.3%,m.p.:22.1 ℃。在反应合成过程中我们没有使用溶剂,达到了绿色合成的目的。肉桂腈的固态荧光显示,在363 nm的紫外光激发下,发出465 nm左右的强荧光,是作物光合作用中叶绿素b、叶黄素和α叶胡萝卜素所需要的蓝光,肉桂腈是一种潜在的蓝光转光材料,有望应用于农膜中[16-17]。
