硫量子点/Ru(bpy电致化学发光法检测肌氨酸
2020-01-15董天涯罗祥瑞吴芳辉程源晟朱海威
董天涯,罗祥瑞,吴芳辉,程源晟,张 奎,朱海威
(安徽工业大学化学与化工学院,安徽马鞍山243032)
肌氨酸是甘氨酸代谢的中间体[1],作为代谢改变的指标,肌氨酸和肌氨酸相关酶水平的变化与各种疾病如肌氨酸血症和精神分裂症有关[2]。近年来,肌氨酸被发现是非侵袭性前列腺癌的生物标志物[3],可用于监测前列腺癌的发展程度。因此,在复杂环境中快速灵敏地检测肌氨酸具有非常重要的意义。
1 实验部分
1.1 仪器和药品
F-4800透射电子显微镜(日本日立公司);MPI-B型电致化学发光分析系统(西安瑞迈分析仪器有限公司);CHI650D型电化学工作站(上海辰华仪器有限公司);KH2200B型超声波清洗器(昆山禾创超声有限公司)。
聚乙二醇、联吡啶钌均购自Adamas试剂有限公司;硝酸、氢氧化钠、三(羟甲基)氨基甲烷盐酸盐(Tris)、硼酸、四硼酸钠购自阿拉丁试剂有限公司;升华硫购自天津市凯通化学试剂有限公司;磷酸二氢钾、磷酸氢二钾购自南京化学试剂有限公司;无水乙醇、亚铁氰化钾、铁氰化钾购自国药集团化学试剂有限公司;化学试剂均为分析纯,使用前未经进一步纯化;水为超纯水(18 MΩ·cm)。
1.2 S QDs的合成
参照文献[11],采用改进后的硝酸长时间氧化升化硫的方法制备硫量子点,即称取1.4 g升华硫(0.044 mol)加入100 mL圆底烧瓶中,再加入50 mL浓硝酸。然后将该混合物于70 ℃下搅拌加热回流48 h,接着将混合物离心并将所得沉淀物用超纯水洗涤两次,干燥后转移到另一个100 mL圆底烧瓶中,依次加入50 mL超纯水、3 mL聚乙二醇(PEG-400)和4 g氢氧化钠(0.1 mol)混合。再将混合物于70 ℃下搅拌反应一段时间后,将产物收集保存作为母液。
1.3 电化学发光检测方法
以玻碳电极为工作电极,铂丝电极为对电极、银-氯化银电极为参比电极组成三电极体系,采用MPI-B型电致化学发光分析仪在通氮除氧条件下对体系电化学发光进行检测。检测底液为0.1 mol/L磷酸盐缓冲溶液(PBS,pH 8.0),初始电位为0 V,扫描方向为正方向,扫描速度为100 mV/s,光电倍增管高压为800 V。检测时,先加入一定浓度的Ru(bpy)32+和S QDs,观察ECL信号,再加入肌氨酸,根据肌氨酸对S QDs/Ru(bpy)32+体系ECL信号的改变来识别检测肌氨酸。
2 结果与讨论
2.1 材料表征
采用透射电子显微镜和荧光分光光度计对制得的S QD 进行表征。图1 是S QDs 的透射电镜图。从图1 可以看出,制备的颗粒状S QDs 分布相对均匀,尺寸在4 nm左右。图2是反应时间分别为30,54,72,100,124 h 的激发波长的荧光光谱。由图2可发现:随着制备时间延长,S QDs在420 nm处发射出的荧光不断增强;而当反应时间超过124 h,荧光强度不再显著变化,几乎达到饱和。为了使后续ECL 响应效果更佳,实验中采用碱反应124 h 后S QDs母液作为耦合发光试剂。

图1 S QDs的透射电镜图Fig.1 TEM of S QDs
2.2 发光试剂ECL体系对肌氨酸响应的影响
2.3 实验条件的优化
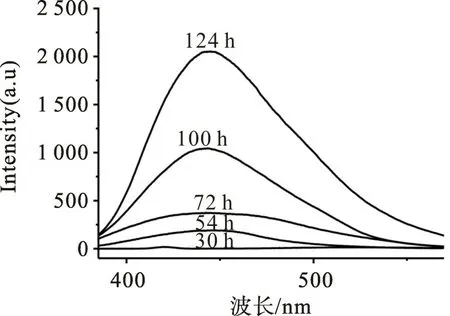
图2 不同反应时间下S QDs的荧光光谱Fig.2 Fluorescence spectra of S QDs with different times
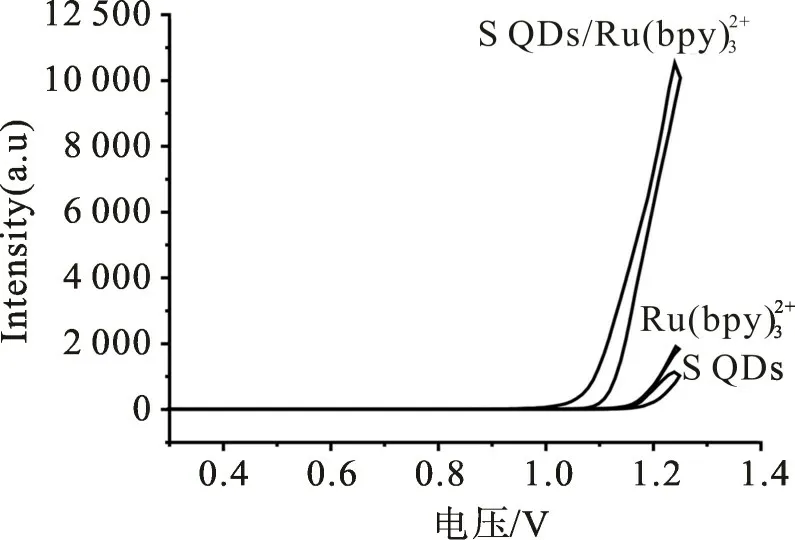
图3 8×10-5mol/L肌氨酸存在下,Ru(bpy)32+、S QDs、S QDs/Ru(bpy的电致化学发光曲线Fig.3 ECL curves of Ru(bpy、S QDs and S QDs/Ru(bpyat the presence of 8×10-5 mol/L sarcosine
pH 值为4.0~9.0 之间磷酸盐缓冲溶液体系对ECL 强度的影响结果如图4。由图4 可以看出:8×10-5mol/L肌氨酸存在下,随着磷酸盐缓冲介质pH值的增加,肌氨酸对S QDs/Ru(bpyECL体系响应强度不断增强;pH值为8.0时出现最佳拐点,之后开始下降。因此选择pH值为8.0的0.1 mol/L磷酸盐缓冲溶液作为后续研究介质。

图4 缓冲溶液pH值对ECL强度的影响Fig.4 Effect of buffer solution pH on ECL intensity
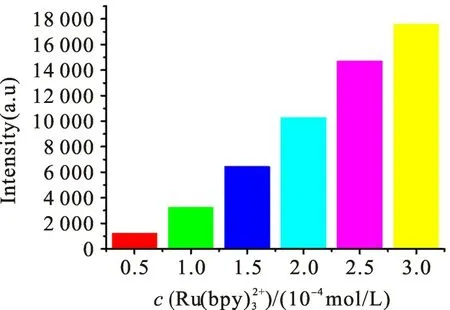
图5 Ru(bpy)32+用量对ECL强度的影响Fig.5 Effect of Ru(bpy)32+dosage on ECL intensity
考察扫描速率(分别为60,80,100,120,140 mV·s-1)对S QDs/Ru(bpy体系电致化学发光强度的影响。结果表明,随着扫描速率的增大,ECL发光强度增大,当达到100 mV·s-1时,ECL发光强度基本趋于稳定。这是因为扫描速率越大,电极表面Ru(bpy)33+扩散速度无法跟上电极反应速度,使得ECL信号不再增强[12]。故本实验体系中选择的扫描速率为100 mV·s-1。
2.4 S QDs/Ru(bpyECL体系对肌氨酸的响应
优化各项实验条件之后,研究不同浓度的肌氨酸对S QDs/Ru(bpy体系ECL信号的增敏作用,结果如图6所示,内图为该体系发光强度差值(ΔI)与肌氨酸浓度之间的校正曲线。由图6 可以发现:S QDs/Ru(bpy体系ECL 信号差值与肌氨酸的浓度在1.0×10-7~8.0×10-5mol/L 范围内呈良好的线性关系,检测限低至5.0×10-8mol/L(信噪比为3);线性回归方程△I=123.6c(肌氨酸)+428.1(△I=I-I0,I为加入肌氨酸后S QDs/Ru(bpy体系的ECL 强度,I0为S QDs/Ru(bpy体系未加肌氨酸时的初始ECL 强度)。
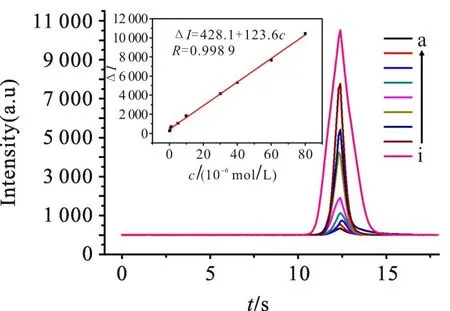
图6 不同浓度肌氨酸对应Ru(bpy/S QDs 体系的电致化学发光曲线Fig.6 ECL curves of Ru(bpyS QDs system with different concentrations of sarcosine
2.5 选择性检测
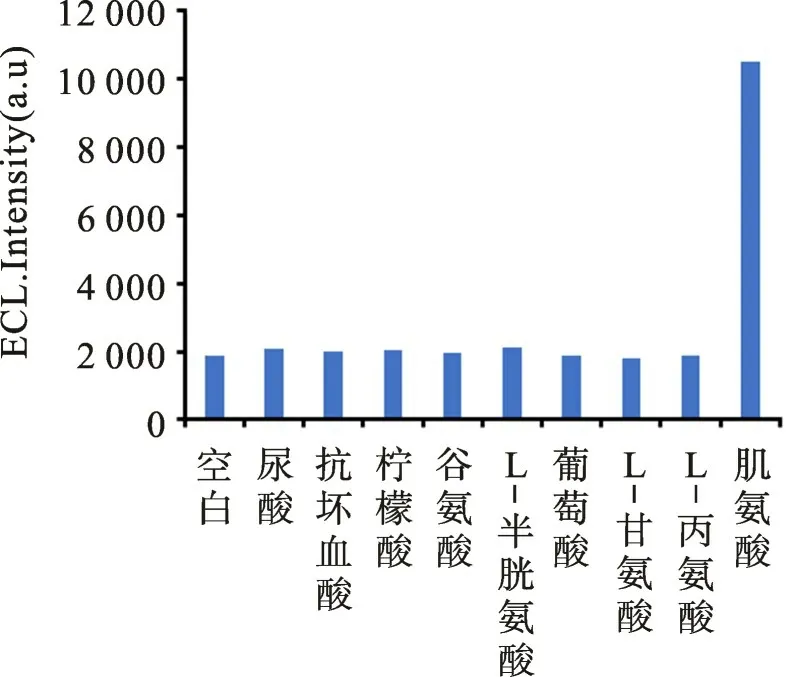
图7 Ru(bpyS QDs 体系的选择性考察Fig.7 Selective investigation of Ru(bpy/S QDs system
2.6 稳定性检测
在各项实验条件都处于最优状态时,采用S QDs/Ru(bpy体系在含有8.0×10-5mol/L 肌氨酸溶液中连续扫描10圈,得到的ECL强度-时间图,如图8 所示。计算得出10 次重复测定的相对标准偏差仅为3.04%,说明该S QDs/Ru(bpy)32+体系对肌氨酸的响应稳定性好。
2.7 实际样品的检测
3 结 论
采用较为简便的方法制备S QDs并进行充分表征,基于肌氨酸对S QDs/Ru(bpyECL体系的增敏建立检测肌氨酸的新方法,并得以下结论。
1)各项实验条件优化结果为:以pH 值为8.0 的0.1 mol/L磷酸盐缓冲溶液作为研究介质,以浓度为2.0×10-4mol/L 的Ru(bpy作为液相主体发光试剂,耦合发光试剂S QDs 母液的用量为60 μL,扫描速率选定为100 mV·s-1。
以上结果表明该方法操作简单、灵敏度高、选择性强,为检测生理样品中的肌氨酸提供了新思路。
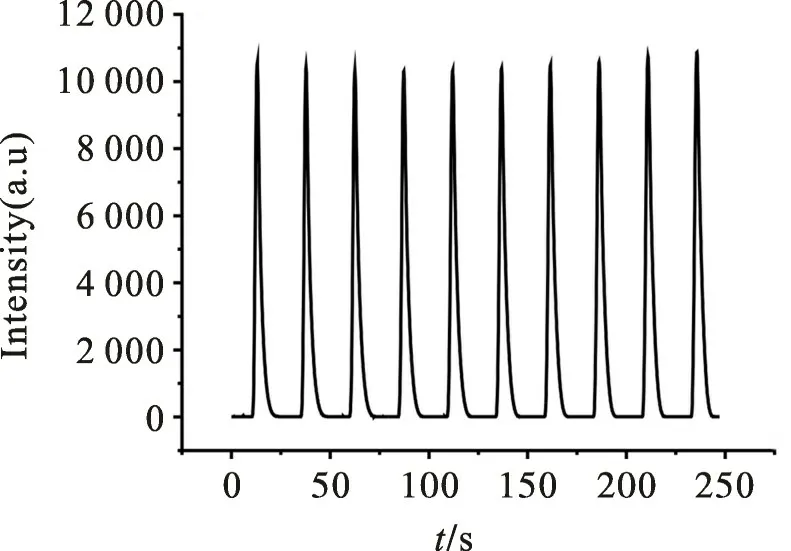
图8 Ru(bpy/S QDs 体系中连续扫描10圈的ECL曲线Fig.8 ECL curve of 10 consecutive scans of Ru(bpy/S QDs system
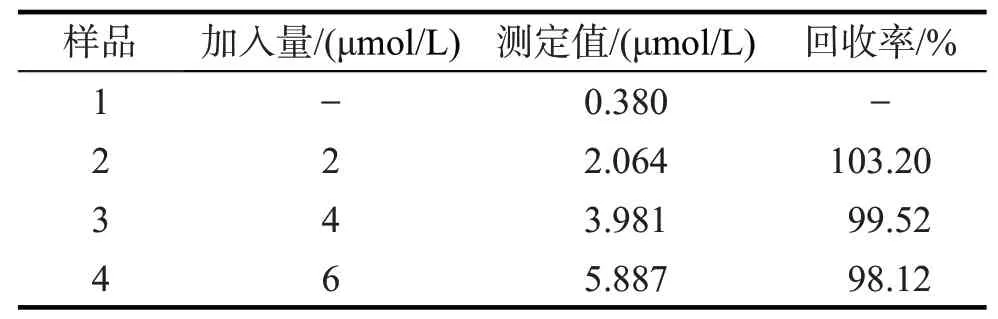
表1 真实样品中肌氨酸的分析结果(n=6)Tab.1 Results for sarcosine determination in real samples(n=6)
