我国口岸瓜实蝇监测样本的SSR 分子标记分析
2020-01-15许佳丹王书平蒋费涛朱雅君
许佳丹, 王书平, 蒋费涛, 朱雅君, 叶 军, 李 飞
1上海海关动植物与食品检验检疫技术中心,上海201708; 2浙江大学昆虫科学研究所,浙江 杭州310058; 3重庆三峡学院环境与化学工程学院,重庆404000
瓜实蝇Bactrocera cucurbitae(Coquillett) 俗称针蜂,幼虫称瓜蛆,其寄主广泛,适应性强,可危害120 多种蔬菜和水果(Christenson & Foote,1960),严重影响蔬菜瓜果的品质和产量(Nishida & Bess,1950)。 世界上很多国家和地区都将瓜实蝇列为重要的检疫性有害生物。 为了有效地控制检疫性实蝇的危害及传播,自2000 年起,国家质检总局在全国范围内开展实蝇监测工作,对防控检疫性实蝇的传播、蔓延起到了重要作用,也为开展检疫性实蝇的不同地理种群遗传结构研究提供了宝贵材料。
简单重复序列(simple sequence repeat, SSR)具有多态性高、重复性好、共显性、易检测、成本低等优点,因此被开发成为分子标记,广泛应用于亲子鉴定、遗传图谱和基因组结构分析等方面(Jones et al.,2010)。 SSR 标记可应用于昆虫的群体遗传结构与分化、不同生物型的鉴别、天敌昆虫的鉴定、种群间亲缘关系的鉴定等方面(何恒果,2008)。 随着测序技术的不断发展,转录组测序成为目前研究昆虫系统发育、种群遗传变异分化以及外部形态特征难以区分的近缘种鉴定等的方法之一(Badouin et al.,2013)。 利用转录组测序数据开发SSR 分子标记包含的遗传信息更丰富,可以提高遗传多样性分析的准确性。 罗梅等(2014)基于扶桑绵粉蚧Phenacoccus solenopsisTinsley 的研究表明,利用转录组数据开发SSR 标记是可行的,可应用于物种的遗传多样性分析。 李梅梅等(2018)利用转录组测序得到的SSR 序列在粘虫Mythimna separata(Walker)的7 个不同地理种群中成功筛选到7 个具有多态性且能稳定扩增的SSR 位点。 Pascoal & Kilner(2017)利用基因组及转录组数据开发出14 对SSR多态性引物并进行遗传多样性研究。
通过对瓜实蝇的转录组测序数据筛选SSR 序列,收集了国内11 个地区的口岸瓜实蝇监测种群,进行了实验验证及遗传多样性分析,为探索我国瓜实蝇的口岸监测工作提供理论依据和实用技术。
1 材料与方法
1.1 供试昆虫
用于转录组测序的瓜实蝇雌成虫,分别来自广州(113°E,23°N)海关植检实验室长期饲养的瓜实蝇、上海宝山地区(121°E,31°N)监测到的瓜实蝇种群。 其他转录组数据下载自美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI),包括来自美国夏威夷(SRX689016)、中国台湾(SRX1041320)的瓜实蝇种群。
用于实验验证的瓜实蝇监测样本分别来自上海、浙江、江苏、广西、海南、新疆、云南、四川、天津、北京、广东等11 个地区,共49 个监测样本(表1)。

表1 瓜实蝇监测样本收集信息Table 1 Geographic origin of B. cucurbitae samples
1.2 总RNA 的提取与检验
按照Trizol Reagent 方法提取总RNA,用1%琼脂糖凝胶电泳检测总RNA 的完整性,经Nanodrop 2000 分光光度计(IMPLEN,CA,USA)测定RNA 的纯度,依据Qubit RNA Assay Kit 使用说明定量测定RNA 浓度,并用Agilent 2100(Agilent Technologies,CA,USA)精确检测RNA 的完整性。
1.3 cDNA 文库构建和测序
RNA 样品检测合格后,在带有Oligo (dT)的磁珠富集mRNA 中加入fragmentation buffer,将mRNA打断成短片段,以mRNA 为模板构建测序文库。 文库构建完成后,使用Qubit 2.0、Agilent 2100 和Q-PCR方法对文库进行检测,以保证文库质量。 最后使用Illumina 高通量测序平台进行测序。 cDNA 文库构建与测序由上海美吉生物科技有限公司协助完成。
1.4 转录组组装
测序得到的原始数据(raw reads)经处理去接头、poly-N 和低质量序列后获得高质量的测序数据(clean data)。 在此基础上计算GC 含量(碱基G 和C 的数量总和占总体碱基数的百分比)、Q20(质量值≥20 的碱基占总碱基的百分比)、Q30(质量值≥30 的碱基占总碱基的百分比)和重复序列水平,再应用Trinity 软件对高质量的clean data 进行拼接、过滤和组装,最终获得高质量的unigene。
1.5 转录组SSR 的筛选
利用SciRoKo 3.4 软件(默认参数)获取瓜实蝇转录组中的SSR 位点信息(Kofler et al.,2007),根据重复单元碱基个数将SSR 定义为单核苷酸重复、二核苷酸重复、三核苷酸重复、四核苷酸重复、 五核苷酸重复、六核苷酸重复SSR。 用Excel 软件对不同地理种群瓜实蝇的SSR 信息进行统计分析。
1.6 DNA 提取、引物筛选设计及PCR 扩增
采用DNeasy Blood & Tissue 试剂盒(QIAGEN)提取单头瓜实蝇成虫基因组DNA。 利用Primer 5.0对筛选出来的SSR 序列进行引物设计(Untergasser et al.,2012),筛选出15 对多态性高的SSR 引物进行实验(表2),引物筛选以重复性好、具多态性、扩增条带清晰稳定为依据。 所有引物由生工生物工程(上海)股份有限公司合成。 PCR 反应体系为20 μL:Premix Taq (Takara) 10 μL,上下游引物各1 μL, DNA 模板1 μL,加ddH2O 至20 μL。 PCR 扩增程序:94 ℃3 min;94 ℃30 s,55 ℃30 s,72 ℃45 s,35 个循环;72 ℃10 min;4 ℃保存备用。 取8 μL PCR 产物于3%琼脂糖凝胶电泳检测,并在凝胶成像系统下拍照保存。
1.7 数据处理及分析
对聚丙烯酰胺凝胶图谱上每对应物的扩增条带进行分析,在相同的迁移率位置上,有带赋值为1,无带赋值为0,形成[0,1]数据矩阵。 先采用NTedit 软件进行数据的输入和保存,再使用NTsys 软件和Popgene 32 (Nei,1978; Yeh & Boyle,1997)软件统计分析基因分化系数、群体总基因的多样性和群体内基因多样性、基因流及遗传相似系数及遗传距离,以非加权类平均法(unweighted class average method,UPGMA) 进行聚类分析,构建树状聚类图。

表2 具有多态性的瓜实蝇SSR 引物信息Table 2 SSR primers with polymorphism of B. cucurbitae
2 结果与分析
2.1 RNA 提取及质量检测
通过普通PCR 及Agilent 2100 分析仪对提取的瓜实蝇总RNA 质量进行质检评估。 结果表明,RNA质量较好,可以进行后续的上机测序(图1、2、3)。
2.2 瓜实蝇雌成虫转录组数据组装质量
采用Illumina 二代测序平台对瓜实蝇(3 个重复)的转录组进行测序。 所有样本GC 含量均介于38.88%~42.31%;每个样本Q20 均大于94%,Q30均大于91%,测序结果准确度较高,可以用于后续分析;利用Trinity 软件进行组装,得到序列总长度分别 为29462159、20646356、44400736、46515243 bp,片段平均长度分别为151、126、101、100 bp,平均GC 含量分别为42%、41%、40%、39%(表3)。
2.3 瓜实蝇转录组SSR 位点及重复类型分析
从表4、表5 可知,广州实验室饲养、上海地区监测、中国台湾和美国种群的瓜实蝇转录组的SSR 位点分别为16415、25972、16277 和22719 个,SSR 的出现频率(SSR 数目与总unigenes 的数目比值)分别为27.40%、35.05%、27.04%、36.84%。 从出现频率来看,美国种群的瓜实蝇转录组SSR 位点最丰富,其次为上海、广州和台湾种群。
图1 广州实验室饲养种群总RNA 检测Fig.1 Agilent 2100 electrophoresis of total RNA of the B. cucurbitae populations from Guangzhou lab

图2 上海地区监测种群总RNA 检测Fig.2 Agilent 2100 electrophoresis of total RNA of the B.cucurbitae populations from Shanghai

图3 琼脂糖凝胶电泳检测图Fig.3 B. cucurbitae total RNA samples on agarose gel electrophoresis
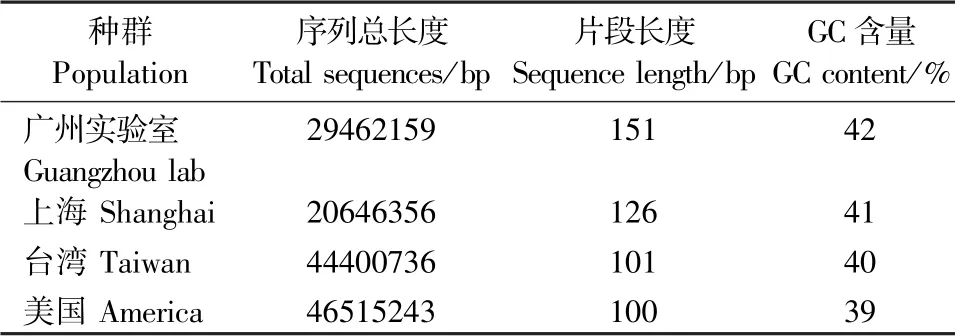
表3 瓜实蝇不同地理种群转录组测序数据评估统计Table 3 Summary of sequencing data of different geographical populations of B. cucurbitae
不同地理种群的瓜实蝇转录组中SSR 的主要重复类型为三核苷酸重复,广州、上海、台湾和美国种群瓜实蝇的三核苷酸重复类型的SSR 数量分别占各自总SSR 数量的41.23%、32.90%、34.58%、38.12%;其次为四核苷酸重复类型,占各自总SSR数量的21.57%、20.64%、22.94%、22.92%;对广州、台湾和美国种群而言,第三丰富的SSR 重复类型为二核苷酸重复类型,占各自总SSR 数量的11.93%、10.82%、13.67%,而上海种群占比第三的是单核苷酸重复类型,为17.23%。 总体上六核苷酸重复类型占比最少,上海、台湾和美国种群瓜实蝇的六核苷酸重复类型的SSR 数量分别占各自总SSR 数量的7.47%、8.50%、8.06%,广州种群的单核苷酸重复类型占比最少,仅占其总SSR 数量的7.48%。
广州、上海、台湾和美国种群的瓜实蝇转录组的不同重复类型SSR 中,单核苷酸重复类型的平均长度最大,分别为22.82、30.58、23.75 和23.82 bp;五核苷酸重复类型的平均长度最小,分别为17.97、18.55、17.78 和18.79 bp。 广州、上海和台湾种群瓜实蝇转录组的SSR 位点中,单核苷酸重复类型的平均错配数最大,分别为0.56、0.62、0.57,美国种群瓜实蝇转录组的SSR 位点中双核苷酸重复类型的平均错配数最大,为0.52。 平均错配数最小的是五核苷酸重复,分别为0.14、0.18、0.12、0.21。
广州、上海、台湾和美国种群的瓜实蝇转录组的不同重复类型SSR 中,平均距离最长的是三核苷酸重复类型,分别为112.43、107.32、100.12、106.35 kb;上海、台湾和美国种群的瓜实蝇转录组的不同重复类型SSR 中平均距离最短的是六核苷酸重复类型,分别为24.37、22.32、24.8 kb,对于广州种群的瓜实蝇转录组SSR 而言,平均距离最短的是单核苷酸重复类型,仅为20.4 kb。
广州、上海、台湾和美国种群的瓜实蝇转录组SSR 重复单元的重复次数分布最多的是5 次重复,分别占总SSR 数量的25.96%、20.48%、24.16%、22.07%,最少的为13、14 次重复。 广州种群的瓜实蝇转录组SSR 中特有的重复类型为五核苷酸15 次重复、六核苷酸14 次重复。 美国种群的瓜实蝇转录组SSR 中特有的重复类型为六核苷酸13 次重复。

表4 不同地理种群瓜实蝇转录组中SSR 的基本信息Table 4 SSRs information in transcriptomes of different geographical populations of B. cucurbitae
2.4 瓜实蝇不同地理种群监测样本间的系统发育分析
利用NTsys 软件对PCR 电泳结果(图4)进行统计和聚类分析,结果(表6)显示,遗传一致度在0.17~1.00之间,说明瓜实蝇不同地理种群监测样本间存在遗传分化,可能具有不同的来源背景。 从图5 可以看出新疆种群分布于A 组,四川种群分布于C 组,浙江种群分布于D 组,北京、云南、天津、海南种群分布于E 组,广西种群分布于B、E 组,上海、江苏和广东种群分布于D、E 组。 其中新疆、四川、北京种群瓜实蝇遗传结构较为单一,同一地区样本聚集在一起。 浙江地区监测到的瓜实蝇与上海、广东、江苏部分监测样本聚集成一支,上海、广东监测到的瓜实蝇个体分散在进化树的不同支。


图4 不同地理种群瓜实蝇监测样本SSR 引物的PCR 扩增图Fig.4 The PCR amplification of B. cucurbitae populations from different regions by using 15 pairs of SSR primers
2.5 瓜实蝇不同地理种群群体间的系统发育分析
2.5.1 遗传一致度和遗传距离 对11 个瓜实蝇不同地理种群的监测样本进行遗传一致度和遗传距离的计算,对角线上三角为遗传一致度,下三角为遗传距离。 结果(表6)表明,海南和天津的Nei′s遗传距离最近,为0.0210,北京和新疆的Nei′s 遗传距离最远,为0.8207。 遗传一致度范围为0.4401 ~0.9792,说明瓜实蝇的不同省市监测样本之间存在一定的基因交流,不同地区间的差异不同。
2.5.2 聚类分析 对11 个不同省市的瓜实蝇监测样本进行系统发育分析,通过UPGMA 构建的系统发育树如图6 所示,新疆、四川和广西种群归为一支(分支4),北京种群聚为一支(分支3),浙江、广东、江苏的种群归为一支(分支2),上海、云南、海南、天津的种群聚为一支(分支1)。
2.5.3 Nei′s 遗传变异分析 群体遗传分化分析表明,由Popgene32 软件聚类分析所得到的11 个省市监测样本间基因分化系数为0.6712,表明瓜实蝇不同地理种群间遗传分化,在总的变异中,67.12%的变异发生在种群间,32.88%的变异发生在种群内部,瓜实蝇的49 个监测样本中总遗传多样性和平均遗传多样性分别为0.2903 和0.0954,49 个监测样本间的基因流较低,为0.2449。
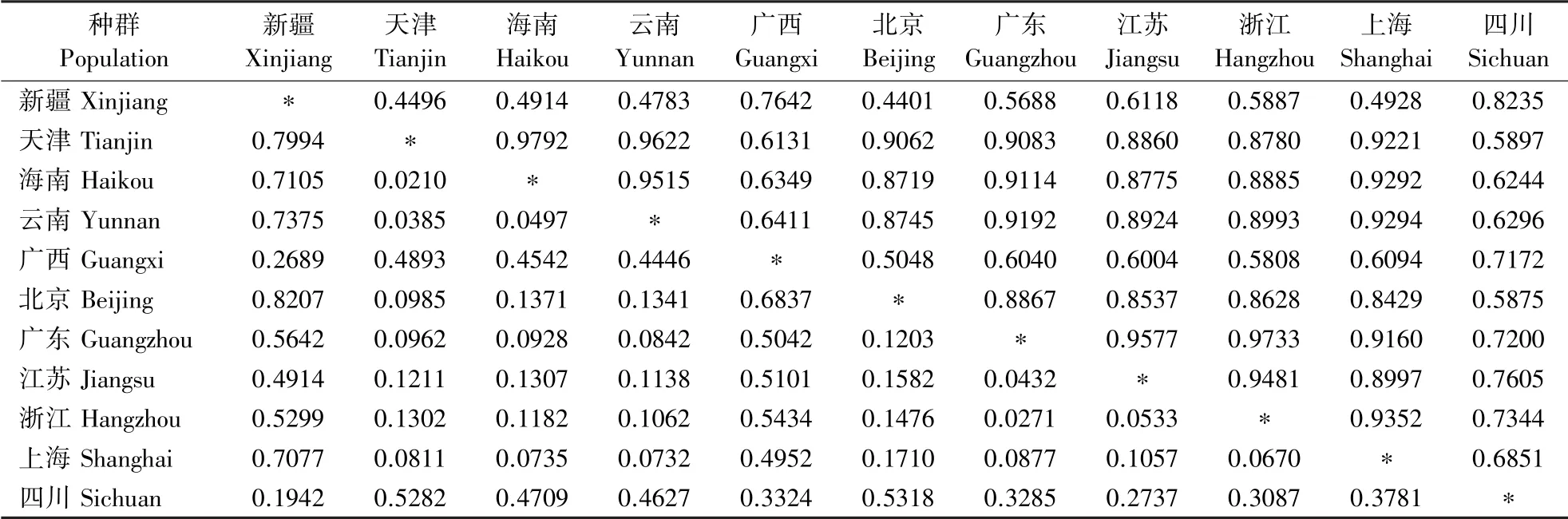
表6 不同地理种群瓜实蝇监测样本中Nei′s 遗传一致度和遗传距离Table 6 Nei′s genetic identity and genetic distance in B. cucurbitae populations from different regions
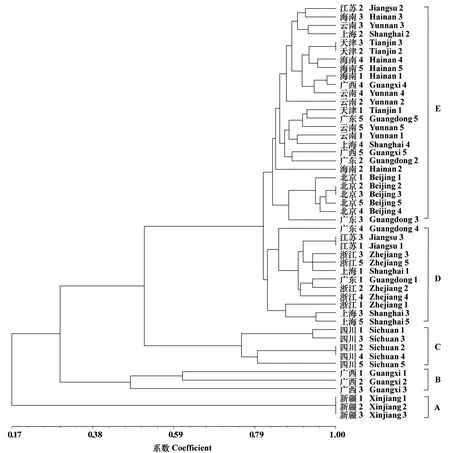
图5 不同地理种群瓜实蝇监测样本基于SSR 多态性的聚类分析图Fig.5 The neighbor-joining tree based on SSR data of B. cucurbitae populations from different regions

图6 基于Nei′s 标准遗传距离的不同地理种群瓜实蝇监测样本的聚类图Fig.6 Dendrogram of B. cucurbitae populations from different regions based on Nei′s standard genetic distance
3 讨论
随着国际贸易量及出入境人员交流的增加,越来越多新鲜水果和蔬菜等农产品通过口岸出入境,大大增加了危险性有害生物随农产品贸易、旅客携带或邮寄物等方式入境的可能,进而威胁我国农产品生产安全(韦兵等,2017)。 在这些有害生物种类中,截获频次最高且最具威胁的是实蝇类害虫,其主要以幼虫危害果实,使受害树大量落果,受害水果商品价值受到严重影响。 植物检疫性实蝇以离腹寡毛实蝇属的害虫种类最多,如瓜实蝇等所能造成的危害最严重(李磊等,2018; Mwatawala et al.,2015)。 早在1987 年,日本检疫部门为防止瓜实蝇传入日本地区,禁止从我国进口葫芦科瓜果,适逢新疆哈密瓜Cucumis melovar.saccharinus生长期,经过调研那时仅有南方地区有瓜实蝇分布,后才解除对新疆哈密瓜的进口限制(张遵雄,1988)。 2006年,中方和日方就中国蔬菜输日问题协商时曾再次关注瓜实蝇在我国的分布情况(孔令斌等,2008),因此采用分子生物学方法,利用口岸监测的瓜实蝇样本来研究我国瓜实蝇不同地理种群遗传结构是极有意义的。
本研究发现,瓜实蝇转录组数据的微卫星位点较为丰富,SSR 的出现频率远大于桔小实蝇Bactrocera dorsalisHendel 转录组(魏丹丹等,2014)、扶桑绵粉蚧转录组及齿缘刺猎蝽Sclomina erinaceaStal转录组(黎东海和赵萍,2019; 罗梅等,2014),可能与物种遗传信息丰富度、转录组测序质量、SSR 分析软件及其筛选标准有关。 不同地理种群的瓜实蝇转录组中的SSR 主要重复类型为三核苷酸重复,约占各自总SSR 数量的1/3 以上,三核苷酸重复类型更为稳定,符合遗传密码规律,与齿缘刺猎蝽转录组分析一致(黎东海和赵萍,2019)。 本研究在筛选多态性SSR 引物时,考虑到低级单元SSR 的普遍比高级单元的SSR 具有更为丰富的多态性(Dreisigacker et al.,2004),结合SSR 分析数据,从SSR 的平均长度来看,单核苷酸重复类型的平均长度最大,双核苷酸、三核苷酸次之,但单核苷酸重复类型错配率较高,因此重点设计双核苷酸及三核苷酸重复微卫星引物,以提高多态性引物筛选效率。
从本研究监测样本的聚类结果来看,新疆、四川、北京3 个地区的瓜实蝇样本同一地区聚集效果较好;浙江的监测样本与上海、江苏、广东的部分样本聚集成一支,可能与浙江和这3 个地区地理距离较为接近,水果运输较为频繁有关。 天津、海南、云南和上海、江苏、广西、广东的部分样本聚集在一起。 总体来看,上海、广东、云南的瓜实蝇监测样本遗传多样性最为丰富,上海和广东为我国主要水果进境指定口岸,云南的地理位置特殊,与实蝇高适生区东南亚接壤,瓜实蝇流动性较强。 不同地理种群瓜实蝇的种群间系统发育分析显示,基因分化系数为0.6712,在总的变异中,67.12%的变异发生在种群间,说明这11 个省市间的瓜实蝇种群具有不同的遗传背景。 聚类分析表明,天津、海南、云南、上海聚为一支,浙江、广东、江苏聚为一支,北京单独聚成一支,广西、四川、新疆聚为一支。 这些结果表明,我国不同口岸的瓜实蝇具有不同的来源地,因此具有不同的遗传背景。 也有部分口岸虽然相距较远,但其瓜实蝇具有相似的遗传背景,表明可能具有相同的来源地或者不同来源地的瓜实蝇具有相似的遗传背景。
本研究结果为检疫性外来有害生物监测提供了科学的理论依据和技术指导,对于上海、广东、云南这3 个瓜实蝇遗传结构较为丰富的地区,需重点监测瓜实蝇动态,对进出境水果及由于边境交流进入的检疫性有害生物需进行严格的实蝇检疫筛查。对于新疆、四川、北京地区瓜实蝇需进行综合防控,减少其对外交流,努力控制实蝇危害范围。 由于实蝇具有地理种群差异,后续可增加监测点,扩增实验样本,通过分析种间进化关系,有望对瓜实蝇的来源地进行初步的判断,为国际贸易争端提供谈判和解决的依据。
