不同植物对黄顶菊根际土壤微生物和土壤养分的影响
2020-01-15杜鄂巍孙建茹张风娟
杜鄂巍, 王 妍, 孙建茹, 闫 静, 张风娟
河北大学生命科学学院,河北 保定071002
外来植物的成功入侵不仅依赖于其自身和入侵生态系统的特性(Millbau et al.,2005),也取决于入侵植物与入侵生态系统的相互关系(Byun &Brisson,2013)。 不同植物对入侵植物的抵御能力不同,这既与植物的功能性状有关,也与土壤养分状况密切相关(Grigulis et al.,2013; Wagg et al.,2011)。 植物性状和土壤微生物是影响碳、氮输入和输出过程的重要因素。 在抵御入侵植物的替代植物筛选过程中,研究者大多关注替代植物的植物性状,忽略了土壤微生物在竞争中的作用。 实际上,植物性状与土壤微生物之间通过植物凋落物和植物根系分泌物建立了密切的联系,共同影响植物的竞争生长(Ehrenfeld & Scott,2011)。 目前,土壤微生物与植物生长和竞争能力之间的关系已有一些报道。 例如,土壤病原菌积累能够直接从植物组织获取碳源和其他营养(Vitousek et al.,1996),减少根部养分吸收能力(Klironomos,2002),不利于植物生长;而共生菌能够提高植物获取土壤中有限营养元素的能力(Der et al.,2008),提高植物产量,促进植物的生长(Wardle et al.,2004)。 关于外来入侵植物与土壤微生物方面的现有研究大多集中于外来入侵植物对土壤生态的影响(Wagg et al.,2011),认为外来入侵植物改变入侵域土壤微生物群落结构(王桔红等,2016),加速了土壤养分循环(Callaway et al.,2004; Reinhart & Callaway,2004),
促进了入侵植物的生长和快速扩散(刘潮等,2018;Marler et al.,1999)。 如Poon & Maherali (2015)发现葱芥Alliaria petiolate(M.) Cavara et Grande 入侵可以降低入侵地土壤中丛枝菌根真菌(arbuscular mycorrhizae fungi,AMF)的生物量,从而使本地植物在与葱芥竞争过程中受到排挤,最终实现外来种的入侵;Wang et al.(2013)发现许多外来入侵植物根部都会分泌一种对其根际病原体危害具有一定防御功能的化感物质(内消旋儿茶酚);Xiao et al.(2014)研究发现紫茎泽兰Ageratina adenophorumSpreng、飞机草Chromolaena odorataL.改变了土壤真菌群落,这种改变对入侵植物的生长具有积极影响,增加了紫茎泽兰和飞机草的生物量。 不同的地上群落结构会间接导致地下微生物群落结构的变化(Saggar et al.,1999),而微生物又能通过正反馈或负反馈作用调节地上植物的竞争与生长(Wagg et al.,2011)。 替代植物是否通过改变土壤微生物群落结构的变化,从而影响土壤养分的分配来抑制入侵植物的竞争与生长,这一机制尚不清楚。 因此,探究替代植物有效防控入侵植物的土壤生态学机制,可为替代植物的筛选提供理论依据。
恶性入侵杂草黄顶菊Flaveria bidentis(L.)Kuntze.为一年生草本植物,原产地南美洲,2001 年首次发现于我国天津、河北,是原环境保护部公布的第二批国家重点防控外来入侵植物(石青等,2017)。 黄顶菊对生物多样性、经济和环境造成了严重危害(Wan et al.,2017)。 至2017 年,黄顶菊已入侵华北4 省1 市(河北、山东、河南、山西和天津)的146 个县541 个乡镇(郑志鑫等,2018)。 研究表明,替代植物高丹草Sorghum bicolor(L.) Moench、紫花苜蓿Medicago sativaL.对土壤氮素转化利用能力比黄顶菊高,且能竞争性抑制黄顶菊对土壤磷素的吸收,有利于实现对黄顶菊的替代控制(马杰等,2011)。 黄顶菊和反枝苋Amaranthus retroflexusL.、苘麻Abutilon theophrastiMedicus 竞争生长时,黄顶菊处于弱势地位,究其原因是黄顶菊和这几种植物处于同一个生态位,竞争导致黄顶菊可利用营养资源减少,从而抑制其生长(吕远等,2011)。 替代植物地肤Kochia scoparia(Linn.) Schrad、苘麻、苏丹草Sorghum sudanense (Piper) Stapf 等对黄顶菊有一定的抑制作用(韩月龙等,2019)。 此外,不同本地植物在与黄顶菊竞争生长过程中增加了入侵域的细菌群落多样性(闫素丽等,2011)、降低了真菌群落多样性(常瑞恒等,2011)。 那么,竞争替代植物如何改变黄顶菊根际土壤微生物群落结构和土壤养分,从而达到抑制黄顶菊生长的目的? 本研究拟采用野外同质园试验,研究不同植物在与黄顶菊竞争生长时,对黄顶菊根际微生物群落结构和土壤理化性质的影响,以期从土壤生态角度来研究不同植物对黄顶菊的抵御能力及相关作用机理,研究结果将为竞争替代植物的筛选提供重要的理论依据。
1 材料与方法
1.1 试验样地概况
试验样地位于河北省廊坊市中国农业科学院廊坊科研中试基地(39°30′42″E,116°36′07″N),海拔(25±3)m,在气候分区上属于暖温带大陆性气候,该地土壤属棕色砂质黏壤土。
1.2 试验设计
根据植物的生长速度、是否耐贫瘠及其经济观赏效益,选择本地常见伴生种地肤、苘麻、苏丹草、反枝苋4 种植物。 采用田间同质园,设置不同植物与黄顶菊混种小区,分别为地肤与黄顶菊混种(H1)、苘麻与黄顶菊混种(H2)、苏丹草与黄顶菊混种(H3)、反枝苋与黄顶菊混种(H4)以及黄顶菊单种(H0),并以裸土小区(无种植植物,CK)作为对照,每个处理5 个重复,一共设置30 个小区。 各样地随机分布,小区大小3 m×2 m,所有样地间距均设置为1 m。 混种比例为1 ∶1。 每个小区平均种植6 行,混种每行各播150 粒种子,单种每行播300 粒种子。 播种后每2 周浇1 次水,每次滴灌36 h。 每2 周进行人工除草,保持每个小区的植物种类不变。 试验于2016 年4 月底播种。
1.3 土样采集
2016 年9 月,对同质园小区进行土样采集,采用五点取样法,每个小区选取生长状况良好且能代表小区生长状况的黄顶菊5 株,抖落根部非根际土壤,再用刷子将根上剩余的土壤轻轻刷下来,即得到根际土。 将同一小区的5 株黄顶菊的根际土壤混合为一个土样。 裸土对照小区土壤的采集,去除表层干土,沿对角线随机选取5 个点,挖取0 ~20 cm 深的土壤。 将采集的土壤样品放入自封袋,做好标记后立即带回实验室。 采回的土样过2 mm 筛后分成2 份:一份储存于4 ℃冰箱内,用于测定土壤微生物磷脂脂肪酸(phospholipid fatty acids,PLFAs)含量;一份常温风干,用于测定土壤养分和酶活性。
1.4 检测指标与方法
1.4.1 土样养分和酶活性的测定 土壤速效磷含量采用钼锑抗比色法测定;硝态氮和铵态氮含量的测定采用Smartchem 全自动间断化学分析仪(鲍士旦,1981);土壤pH 用电位法测定。 土壤蔗糖酶采用3,5-二硝基水杨酸比色法测定;土壤脲酶采用苯酚钠-次氯酸钠比色法测定;土壤磷酸酶采用磷酸苯二钠比色法测定;土壤蛋白酶采用茚三酮比色法(蔡燕飞,2002; 关松荫,1986)。
1.4.2 土壤微生物群落结构的测定 参照Frostegård et al. (1993)和Kourtev et al. (2002)的方法:①取4 g 待测土样后置于50 mL 离心管,然后向离心管中加20 mL KOH-甲醇溶液(0. 2 mol·L-1),于水浴锅中37 ℃水浴1 h,每10 min 涡旋一次(2000 r·min-1);②水浴1 h 完成后加入3 mL 的醋酸溶液(1 mol·L-1),充分摇匀;③再加入10 mL 正己烷,充分混匀后1000 r·min-1离心15 min,吸取上层液置于试管之中,在氮气流下吹干;④向吹干的试管中加入1 mL 含有内标19 ∶0 的正己烷-甲基丁基醚溶液(比例为1 ∶1),充分溶解后将溶液转至气相色谱进样(GC)小瓶。
测定标准品及提取的样品,气相色谱设置条件如下:首先使柱温以5 ℃·min-1的速率从170 ℃升高到260 ℃,然后以40 ℃·min-1的速率升高到310 ℃,维持90 s;将气化室温度设置为250 ℃、将检测器温度设置为300 ℃;以氢气(2 mL·min-1)作为载气,以氮气(30 mL·min-1)作为尾吹气;柱前压为68.95 kPa;进样量1 μL,分流比100 ∶1。 根据加入内标19 ∶0 的量可以计算出不同PLFAs 的峰面进而得出不同类型微生物的量。 不同土壤微生物类群与磷脂脂肪酸的对应关系如表1 所示, 参照表1 得出各种土壤微生物类群的总量。

表1 不同土壤微生物类群与磷脂脂肪酸的对应关系Table 1 Phospholipid fatty acids used in analysis of different soil microbial group
1.5 数据分析
磷脂脂肪酸成分分析采用美国MIDI 公司生产的基于细菌细胞脂肪酸成分鉴定的Sherlock MIS 4.5 系统。 根据加入内标19 ∶0 的量可以计算出不同PLFAs的吸光度,进而得出不同类型微生物的量。 试验数据采用平均值±标准差表示,用Excel 2010 软件统计作图,利用SPSS 21.0 统计软件进行单因素方差分析(One-way ANOVA),采用Duncan′s 多重比较进行之后的两两比较,P=0.05。 对各样地土壤微生物群落组成进行主成分分析(principal components analysis,PCA),计算各因子的贡献率,利用主成分分析因子的载荷量算出各因子作用的大小,以确定它们的权重。采用Canoco 4.5 软件对土壤微生物和土壤养分酶活性二者进行典范对应分析(canoninal correspondence analysis, CCA),以土壤微生物作为物种变量,土壤养分和酶活性数据作为环境变量进行典范对应分析,确定土壤微生物和各因子之间的关系。
2 结果与分析
2.1 不同植物对黄顶菊根际土壤酶活性和养分的影响
从表2 可见,与裸土对照(CK)相比,黄顶菊单种处理(H0)的酸性磷酸酶、脲酶、蛋白酶活性显著升高,碱性磷酸酶活性降低,表明黄顶菊入侵后改变了土壤的酶活性。 与黄顶菊单种处理(H0)相比,地肤与黄顶菊混种处理(H1)碱性磷酸酶、蛋白酶活性显著升高,脲酶活性显著降低;苘麻与黄顶菊混种处理(H2)脲酶、蛋白酶活性显著降低;苏丹草与黄顶菊混种处理(H3)酸性磷酸酶、脲酶活性显著升高;反枝苋与黄顶菊混种处理(H4)碱性磷酸酶和脲酶活性显著升高。 说明不同植物在与黄顶菊竞争生长中改变了黄顶菊根际土壤酶活性。
从表3 可知,黄顶菊入侵显著降低土壤硝态氮含量,显著增加土壤速效磷和铵态氮含量。 与黄顶菊单种(H0)处理相比,不同植物与黄顶菊混种处理中,土壤速效磷含量均显著减少。 地肤与黄顶菊混种处理(H1)中,土壤pH 值、铵态氮含量显著增加;苘麻与黄顶菊混种处理(H2)中,土壤pH 显著降低,铵态氮含量显著增加;苏丹草与黄顶菊混种处理(H3)中,铵态氮含量显著减少;反枝苋与黄顶菊混种处理(H4)中,土壤pH 值显著减少。 说明不同植物在与黄顶菊竞争生长中改变了黄顶菊根际土养分含量。
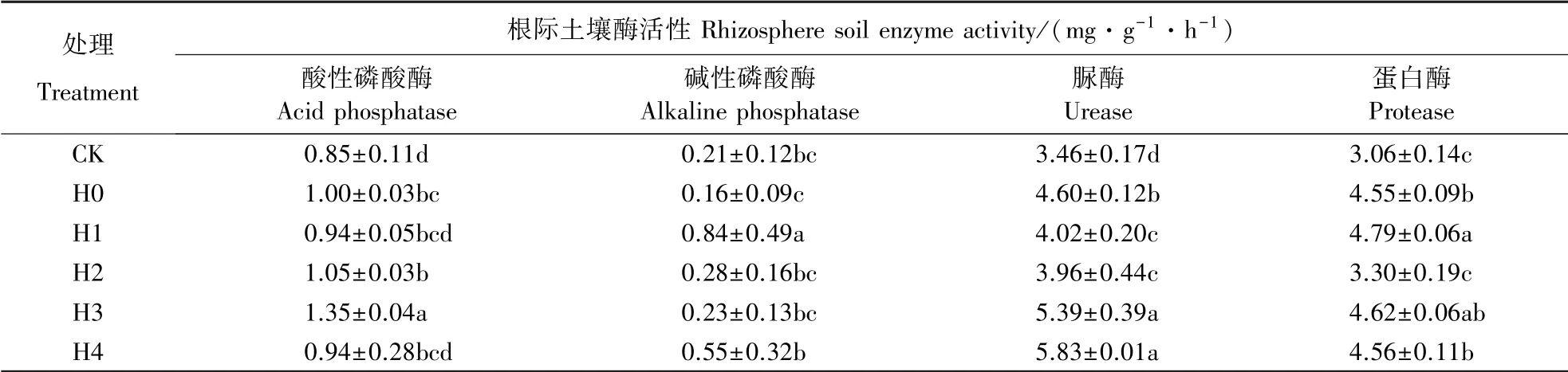
表2 不同植物对黄顶菊根际土壤酶活性的影响Table 2 Effect of different plants on rhizosphere soil activities of F. bidentis
2.2 不同处理中黄顶菊根际土壤养分与土壤酶活性相关性分析
从表4 可以看出,土壤碱性磷酸酶活性与酸性磷酸酶活性极显著正相关(r=0.57);蛋白酶活性与碱性磷酸酶活性显著正相关(r=0.42);铵态氮含量与脲酶活性极显著负相关(r=-0.53);速效磷含量与碱性磷酸酶活性极显著正相关(r=0.66),与蛋白酶活性显著正相关(r=0.42);硝态氮含量与蛋白酶活性显著负相关(r=-0.43),与速效磷含量极显著负相关(r=-0.56)。
2.3 不同植物对黄顶菊根际土壤微生物的影响
2.3.1 土壤微生物PLFAs 总量的变化 图1 表示不同植物(组合)对黄顶菊根际土壤微生物PLFAs总量的影响,与空白裸土对照相比,黄顶菊单种的PLFAs 含量增加了18%,说明黄顶菊入侵显著增加土壤中PLFAs 的含量。 与黄顶菊单种处理(H0)相比,地肤与黄顶菊混种处理(H1)中,黄顶菊根际土壤中PLFAs 含量降低11%。 表明地肤在与黄顶菊竞争生长中改变了黄顶菊根际微生物的含量。

表3 不同植物对黄顶菊根际土壤养分的影响Table 3 Effect of different plants on rhizosphere soil nutrients F. bidentis

表4 不同处理中黄顶菊根际土壤养分与土壤酶活性相关性Table 4 Correlations between soil nutrients and soil enzyme activities of rhizosphere of F. bidentis

图1 不同植物对黄顶菊根际土壤PLFAs 总量的影响Fig.1 Effect of different plants on the content of total PLFAs of rhizosphere soil of F. bidentis
2.3.2 不同植物对黄顶菊根际土壤微生物各类群的影响 从表5 可知,与裸土对照(CK)相比,黄顶菊入侵后革兰氏阳性菌、真菌、AMF 显著增加。 地肤与黄顶菊混种处理(H1)中,革兰氏阴性菌、放线菌、真菌、AMF 的PLFAs 含量均显著低于黄顶菊单种处理;苘麻与黄顶菊混种处理(H2)中,放线菌、真菌的PLFAs 含量均显著低于黄顶菊单种处理;苏丹草与黄顶菊混种处理(H3)中,革兰氏阳性菌PLFAs 含量显著高于黄顶菊单种处理;革兰氏阴性菌和真菌的含量显著低于黄顶菊单种处理;反枝苋与黄顶菊混种处理(H4)中革兰氏阴性菌的PLFAs 显著高于黄顶菊单种处理;放线菌、真菌的PLFAs 含量显著低于黄顶菊单种。 与黄顶菊单种处理(H0)相比,所有处理中原生生物的PLFAs 含量均显著增加。 真菌与细菌的比值(F/B)均呈降低趋势;革兰氏阴性菌与革兰氏阳性菌的比值(G-/G+)在地肤与黄顶菊混种处理(H1)中显著增加,在其他处理中均显著降低。
2.3.3 黄顶菊根际土壤微生物群落结构的主成分分析 不同植物与黄顶菊竞争生长对黄顶菊的根际土壤微生物的影响不同。 主成分分析结果(图2A)表明,主成分1(贡献率26.22%)、主成分2(贡献率17.61%)和主成分3(贡献率11.61%)的累计总贡献率为55.44%。 3 个主成分基本上能把不同处理的微生物群落结构区分开。 对土壤微生物群落结构来说,裸土对照处理(CK)在主成分1、主成分2 的负方向,主成分3 的正方向;黄顶菊单种处理(H0)在主成分1 负方向,主成分2、主成分3 的正方向,说明黄顶菊入侵后改变了土壤的微生物群落结构。 地肤与黄顶菊混种处理(H1)和苘麻与黄顶菊混种处理(H2)的主成分1、主成分2 和主成分3分布在原点附近,且两个处理有重叠,说明两个处理的土壤微生物群落结构差异不大;苏丹草与黄顶菊混种处理(H3)的土壤微生物群落结构在主成分1 的正方向,主成分2、主成分3 的原点附近;反枝苋与黄顶菊混种处理(H4)的土壤微生物群落结构在主成分1 的正方向,主成分2 的原点附近,主成分3的负方向;所有处理与黄顶菊单种处理均无重叠,说明不同植物与黄顶菊混种处理均改变了土壤的微生物群落结构。
载荷因子分析结果如图2B 所示,结合图2A 可以看出,不同的植物与黄顶菊混种的优势脂肪酸不同。 结合不同处理黄顶菊根际土壤微生物PLFAs量得出,黄顶菊单种处理(H0)的优势脂肪酸为18∶1 ω5c、17 ∶0 10-methyl、18 ∶3 ω6c (6,9,12);地肤与黄顶菊混种处理(H1)中的优势脂肪酸为11 ∶0 iso、15 ∶1 iso G;苘麻与黄顶菊混种处理(H2)的优势脂肪酸为11 ∶0 iso;苏丹草与黄顶菊处理(H3)的优势脂肪酸为14 ∶0 anteiso;反枝苋与黄顶菊混种处理(H4)的优势脂肪酸10 ∶0 3OH、18 ∶1 ω9c;对黄顶菊有抑制作用的植物地肤和苘麻的组合中黄顶菊的根际土壤的优势脂肪酸均含有11 ∶0 iso,且含量显著高于其他处理。 由此表明,不同的植物对黄顶菊根际土壤微生物群落结构的影响有明显不同。

表5 不同植物对黄顶菊根际土壤微生物各类群的影响Table 5 Effect of different plants on soil microbial groups of rhizosphere soil of F. bidentis

图2 黄顶菊根际土壤微生物群落结构的主成分分析及载荷因子贡献Fig.2 Principal components analysis of PLFAs profiles from rhizosphere soil microbial communities and loadings factors of PLFAs contributing to soil microbial communities ordination pattern of F. bidentis
2.4 不同处理中黄顶菊根际土壤微生物与土壤养分和酶活性的相关性分析
图3 为黄顶菊根际土壤微生物与土壤养分和酶活性的典范对应分析,前2 个排序轴的贡献率分别为51.5%和65.5%。 由图3 可知,其中14 ∶0 anteiso、18 ∶1 ω 9c、11 ∶0 iso、14 ∶0 iso 与铵态氮有关,14 ∶0 iso 还与蛋白酶有关,18 ∶1 ω7c 与pH 有关,18 ∶1 ω5c、17 ∶0 10-methyl 与硝态氮有关,12 ∶00、13 ∶00 与P、酸性磷酸酶有关。 12 ∶0 anteiso、15 ∶1 iso G 与脲酶有关,15 ∶0 iso、16 ∶1 ω5c与碱性磷酸酶有关。 综上所述,不同植物对黄顶菊根际土壤微生物的影响不同,其中大多数微生物与黄顶菊根际土氮营养含量有关。

图3 不同处理中黄顶菊根际土壤微生物与土壤养分和酶活性的典范对应分析Fig.3 Canonical correspondence analysis between soil microbes and soil nutrient and enzyme activities in the invaded land of F. bidentis
3 讨论与结论
替代植物在与入侵植物竞争过程中会改变对入侵植物有利的土壤条件,如土壤微生物、养分和酶活性,并借此增强自身的竞争能力,有效抑制入侵植物的扩散。 土壤酶活性对土壤有效养分的变化有重要作用,而养分吸收是影响植物间竞争生长的主要因素。 蒋智林等(2008)研究表明,非洲狗尾草Setaria ancepsStapf ex Massey 改变了紫茎泽兰的土壤酶活性,并认为土壤酶活性的差异是引起土壤有效养分变化的重要驱动之一。 本研究表明,地肤与黄顶菊混种、苘麻与黄顶菊混种与黄顶菊单种相比,黄顶菊根际土脲酶含量显著降低,铵态氮含量显著增加。 相关性分析脲酶与铵态氮含量显著负相关,脲酶是一种专性酶,分解有机物生成氨,氨是土壤氮素的直接来源,可表示土壤氮素的状况。 表明地肤、苘麻能提高土壤可利用氮的能力。 结合植物地上功能性状分析发现,与黄顶菊单种相比,地肤与黄顶菊混种、苘麻与黄顶菊混种中黄顶菊植株全氮含量显著降低(韩月龙等,2019),说明地肤、苘麻能竞争性抑制黄顶菊对氮的吸收。 而本研究从土壤方面发现地肤、苘麻与黄顶菊混种对黄顶菊根际土壤的铵态氮含量增加,硝态氮含量不变,说明地肤、苘麻能竞争性抑制黄顶菊后铵态氮的吸收。氮在植株体内和植株叶片水平分配的较小变化都会对植株生长和竞争产生较大影响(Feng et al.,2009)。 Zhang et al.(2015)研究表明,氮肥添加有利于黄顶菊的竞争生长,而且黄顶菊更倾向于吸收铵态氮(李科利,2018)。 因此,通过本研究获知替代植物可通过降低黄顶菊对铵态氮的吸收而达到有效抑制黄顶菊竞争生长的目的。
另外,土壤微生物在植物竞争生长中起着重要作用,其中替代植物可通过改变土壤微生物群落结构而影响土壤养分循环。 如闫素丽等(2011)研究表明高丹草、向日葵Helianthus annuusL.、紫花苜蓿和多年生黑麦草Lolium perenneL.4 种他替代植物与黄顶菊混种后,提高了土壤细菌群落多样性。 闫静等(2016)研究表明,藜Chenopodium serotinumL.、狗尾草Setaria viridisL.与三叶鬼针草Bidens pilosaL.混种改变了三叶鬼针草的微生物群落结构。 罗雪晶等(2018) 研究表明狗尾草、草木樨Melilotus suaveolensL.与黄顶菊混种改变了黄顶菊根际土的微生物含量和群落结构。 皇甫超河等(2010)研究表明,紫花苜蓿通过根系分泌物改变黄顶菊入侵地的土壤微生物群落结构,使其向有利于替代植物的群落结构转变。 常瑞恒等(2011)研究表明,替代植物降低了黄顶菊根际真菌群落多样性,形成了不利于黄顶菊生长的土壤环境,实现了对其替代防控。本研究表明,地肤、苘麻与黄顶菊竞争中黄顶菊根际土PLFAs 总量显著降低,说明地肤、苘麻在与黄顶菊竞争生长中改变了黄顶菊根际土壤微生物群落结构。 黄顶菊单种根际土优势脂肪酸为17 ∶0 10-methyl、18 ∶1 ω5c 和18 ∶3 ω6c (6,9,12),而地肤与黄顶菊混种时其优势脂肪酸为11 ∶0 iso 和15 ∶1 iso G,苘麻与黄顶菊混种时其优势脂肪酸为11 ∶0 iso。说明不同替代植物与黄顶菊竞争生长能改变根际土的优势脂肪酸。 通过典范性对应分析发现,11 ∶0 iso与铵态氮含量相关,说明地肤和苘麻通过改变土壤微生物使得土壤氮的活化能力提高。 这种改变可能与地肤和苘麻的根系分泌物有关。 Zu et al.(2007)研究表明,喜树Camptotheca acuminata能够通过根系分泌物改变紫茎泽兰根际真核微生物群落结构,从而抑制其传播。 黄顶菊根际聚集的AMF 在竞争生长中对黄顶菊产生了偏利反馈,有助于黄顶菊的入侵(张玉曼等,2015; Zhang et al.,2017)。 在本研究中,地肤与黄顶菊混种根际土中AMF 含量显著低于黄顶菊单种土壤。 土壤中根际分泌物可以直接或间接抑制或促进一些AMF 的生长,从而影响入侵植物的生长(于文清等,2012)。 推测地肤可能通过根系分泌物改变AMF 与黄顶菊的互惠共生关系从而影响黄顶菊的生长。
综上所述,地肤、苘麻能竞争性抑制黄顶菊对铵态氮的吸收从而对黄顶菊的生长产生抑制作用;地肤、苘麻能够改变黄顶菊入侵地的微生物群落结构从而影响黄顶菊对养分的吸收,这可能与其根系分泌物有关,而这些根系分泌物与黄顶菊的化感作用之间是否存在相互作用,到底是如何影响微生物群落结构变化,需要更进一步的研究。
