原产地和入侵地紫茎泽兰对泽兰实蝇的选择性、卵巢蛋白质含量与解毒酶活性的影响
2020-01-15刁跃珲孙圆圆赵云鹏杨国庆
刁跃珲, 高 鑫, 孙圆圆, 赵云鹏, 徐 刚, 杨国庆
扬州大学园艺与植物保护学院,江苏 扬州225009
生物入侵被认为是全球环境问题的主要促发因素之一,其中外来植物入侵更是严重威胁入侵地的生物多样性、经济发展甚至人畜安全(Ehrenfeld,2010; Sala et al.,2000)。 外来有害植物入侵后通常表现出不同的生态对策,使其能够在入侵地繁殖和扩散。 多个假说解释了外来入侵植物成功入侵的机制,天敌逃逸假说(Enemy Escape Hypothesis,ECH)指出,外来植物的成功入侵是由于逃避了原产地的天敌,从而导致其在新栖息地大面积生长、繁殖和扩散(Keane & Crawley,2002);而竞争力增强进化假说(Evolution of Increased Competitive Ability,EICA)认为,来自专食性天敌压力的缺乏导致入侵植物体内原本用于防御专食性天敌的资源会向营养生长和生殖生长转化(Bossdorf et al.,2005)。 研究表明,植食性昆虫更偏向于取食乌桕Sapium sebiferum(L.) Roxb.的入侵地种群,因为原产地种群拥有更高的抗性。 深入分析发现,入侵地种群比原产地种群单宁含量明显低(Siemann &Rogers,2003)。 但近来也有研究发现,新环境中入侵植物对植食者的抵抗力下降是不一定的(Rotter& Holeski,2018)。 这其中涉及的外来植物入侵前后天敌的压力差大小和类型等问题还有待探究。
紫茎泽兰Ageratina adenophora(Spreng.)是我国一种适应性很强的恶性外来入侵杂草(万方浩等,2011)。 泽兰实蝇Procecidochares utilisStone 是紫茎泽兰的专一性天敌,1984 年被引入中国,已在多个紫茎泽兰分布区形成自然种群(杜殿文,2007;李爱芳等,2006; 张智英等,1988)。 近年来,外来有害植物入侵后在生长发育和天敌防御资源再分配的变化,已成为外来植物入侵后适应性特性研究的一个热点。 已有实验证明,外来入侵植物在侵入后抗虫性会发生适应性变化。 如Feng et al.(2009)以紫茎泽兰为研究对象提出的氮分配进化假说(Evolution of Nitrogen Allocation Hypothesis),就是在竞争力增强进化假说上的延伸,认为入侵植物将更多的氮分配于进行光合作用中而不是防御天敌。 Inderjit et al. (2011)发现在入侵地种群与原产地种群间,紫茎泽兰落叶层中的凋落叶片挥发物有明显差异,因此导致了入侵地的紫茎泽兰对本地植物的化感抑制作用更明显。 研究表明,紫茎泽兰入侵地种群的几种主要抗虫物质的含量不同程度地低于原产地种群(高鑫等,2018)。 在前期研究的基础上,本研究比较了泽兰实蝇对原产地和入侵地紫茎泽兰植株的寄主选择性,并对比寄生于2 类植株上泽兰实蝇的卵巢蛋白质含量及乙酰胆碱酯酶、羧酸酯酶及谷胱甘肽S-转移酶活性,从而揭示紫茎泽兰入侵后的适应性机制,丰富外来植物入侵机制中天敌逃逸假说的内涵。
1 材料与方法
1.1 实验材料
供试植物:紫茎泽兰入侵地3 个种群的种子分别采自云南省的临沧市、昆明市西山区、昆明市落索坡村(C1、C2、C3),紫茎泽兰原产地3 个种群的种子(M1、M2、M3)来自墨西哥,由中华人民共和国农业农村部外来入侵生物预防与控制研究中心提供。 在温室(温度约25 ℃,湿度约45%,自然光照)内培养不同种群的紫茎泽兰幼苗,选择4 个月苗龄且长势基本一致的幼苗供试用。
供试虫源:泽兰实蝇虫瘿采自云南农业大学附近,在温室(温湿、光照条件同上)内建立实验种群。试验前,将被泽兰实蝇寄生且已生长至出现羽化窗(幼虫化蛹前取食形成的孔状带膜的“窗口”,以便成虫羽化后出来)阶段的紫茎泽兰单独套上网罩,每日把新羽化出的成虫单独取出,标记雌雄和日期,供实验配对接虫使用。
1.2 泽兰实蝇对原产地与入侵地紫茎泽兰植株的寄主选择性
选择长势一致的紫茎泽兰原产地和入侵地幼苗,每个种群10 株(单株每盆)为一个单位,共6 个种群,按对角线随机摆放,后加纱网罩(180 cm×180 cm×115 cm),接入30 对新羽化的泽兰实蝇成虫。成虫交配并自由选择寄主植物产卵,至死亡后移走纱网罩。 待紫茎泽兰植株上虫瘿出现羽化窗后进行单独套纱网袋,随后每天收集新羽化的成虫并记录数量。 统计每个紫茎泽兰种群被寄生后的每株虫瘿数和每个虫瘿的出虫数。
1.3 泽兰实蝇在原产地和入侵地紫茎泽兰植株寄生后的卵巢蛋白质含量和解毒酶活力测定
把新羽化出的成虫配对接入内置单株紫茎泽兰的网罩(直径10 cm,高60 cm,60 目)内,每个网罩接1 对虫,每个种群设10 株紫茎泽兰植株。 待接入的成虫交配并死亡后摘除网罩,待植株虫瘿部出现羽化窗后再单独套网罩,收集新羽化出的成虫并记录雌雄数量,单头存于-20 ℃冰箱中供测。
卵巢蛋白质含量测定:每个种群中以5 头新羽化的泽兰实蝇雌成虫为一个单位,每个种群随机取3 个重复。 在冰上用解剖镊在解剖镜下取出泽兰实蝇卵巢并摘除粘附物,准确称取各组泽兰实蝇卵巢蛋白质重量,根据试剂盒(南京建成生物工程研究所)说明和试剂,采用酶标仪法测定并计算每个单位的卵巢蛋白质含量。
解毒酶活力测定:每个种群中分别以5 头新羽化的泽兰实蝇雌成虫和雄成虫为一个单位,每个种群随机取3 个重复。 根据试剂盒(南京建成生物工程研究所)说明和试剂,采用酶标仪法测定并计算每个单位的乙酰胆碱酯酶、羧酸酯酶和谷胱甘肽S-转移酶的活力。
1.4 数据分析
数据的分析均采用统计分析软件DPS 7.05,组内多重比较采用Fisher′s PLSD 法,并作显著性检验。 原产地与入侵地种群整体差异性比较采用DPS 软件中的Student′s t 测验。 所有分析结果均用Excel 软件作图,所有图表数据表示均为平均数±标准误(Means±SE),同组内不同小写字母表示彼此在5%水平上差异显著。
2 结果与分析
2.1 泽兰实蝇对原产地与入侵地紫茎泽兰植株的寄主选择性
选择性实验结果表明,泽兰实蝇在原产地和入侵地的6 个种群紫茎泽兰植株寄生选择之间无显著差异(F=0.67,P=0.65)(图1A)。 比较每个种群每虫瘿出虫数可见,入侵地种群的平均每虫瘿出虫数比原产地种群高32%(F=0.99,P=0.43),其中C2 种群与M3 种群的差异最显著,C2 种群每虫瘿出虫数比M3 种群高95%(图1B)。

图1 原产地与入侵地紫茎泽兰植株上泽兰实蝇的虫瘿数(A)及每虫瘿出虫数(B)Fig.1 Number of galls (A) and emerged adults from each gall (B) in the native and invasive host individual of A. adenophora
2.2 泽兰实蝇在原产地和入侵地紫茎泽兰植株寄生后的卵巢蛋白质含量比较
寄生于原产地和入侵地不同种群紫茎泽兰后,泽兰实蝇卵巢蛋白质含量测定结果(图2)表明,3个入侵地紫茎泽兰植株上泽兰实蝇的卵巢蛋白质的平均含量比3 个原产地种群上的高119%(F=1.657,P<0.05)。 寄生于入侵地C1 种群的泽兰实蝇卵巢蛋白质含量最高,为1.23 mg·mL-1,比M1、M2 和M3 种群分别高96%、301%和185%。
2.3 泽兰实蝇在原产地和入侵地紫茎泽兰植株寄生后的解毒酶活力比较
泽兰实蝇乙酰胆碱酯酶活力测定结果表明,寄生于紫茎泽兰入侵地种群的泽兰实蝇该酶活力与原产地种群的总体差异不明显(图3)。 其中,入侵地C2 种群羽化的泽兰实蝇,无论雄虫还是雌虫,其乙酰胆碱酯酶活力较高,雄虫分别显著高于原产地M1 和M2 种群162%和183%,雌虫比M1、M2、M3分别显著高113%、83%、68%。

图2 原产地与入侵地紫茎泽兰植株上泽兰实蝇卵巢蛋白质含量Fig.2 Ovarian protein content in P. utilis raised on native and invasive host individuals of A. adenophora
寄生于紫茎泽兰入侵地种群的泽兰实蝇雌雄虫羧酸酯酶活力平均比原产地种群的低53.6%。在雄虫体内,原产地种群M1 上的泽兰实蝇羧酸酯酶活力,分别比入侵地C1、C2 和C3 种群高181%、271%和353%;在雌虫体内,羧酸酯酶活力最高的也是原产地种群M1,分别高于入侵地C1、C2 和C3种群172%、100%、222%(图4)。
谷胱甘肽S-转移酶活力比较结果表明,在雄虫中,原产地紫茎泽兰上泽兰实蝇种群的谷胱甘肽S-转移酶活力整体低于入侵地的(F=3.48,P<0.05),但种群之间差异不显著(图5)。 雌虫比较也是原产地紫茎泽兰上的泽兰实蝇的种群谷胱甘肽S-转移酶活力整体显著低于入侵地上的(F=11.22,P<0.01)。 入侵地C1 种群羽化的泽兰实蝇谷胱甘肽S-转移酶活力最高,比寄生于原产地种群M1、M2、M3 紫茎泽兰上的分别高94%、128%和85%。
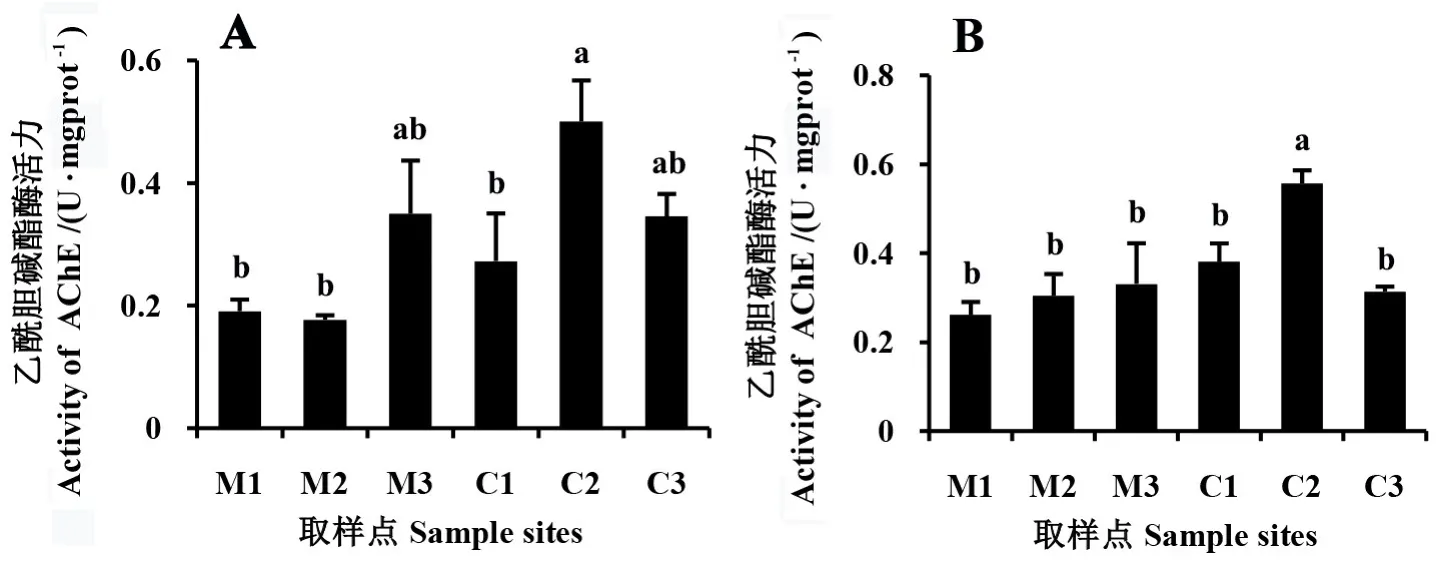
图3 原产地与入侵地紫茎泽兰植株上泽兰实蝇雄(A)和雌(B)虫体内AChE 活力Fig.3 Activities of AChE in males (A) and females (B) of P. utilis raised on native and invasive host individuals of A. adenophora

图4 原产地与入侵地紫茎泽兰植株上泽兰实蝇雄(A)和雌(B)虫体内CarE 活力Fig.4 Activities of CarE in males (A) and females (B) of P. utilis raised on native and invasive host individuals of A. adenophora

图5 原产地与入侵地紫茎泽兰植株上泽兰实蝇雄(A)和雌(B)虫体内GST 活力Fig.5 Activities of GST in males (A) and females (B) of P. utilis raised on native and invasive host individuals of A. adenophora
3 结论与讨论
本文研究结果表明,泽兰实蝇对原产地和入侵地紫茎泽兰的选择无显著性差异,而寄生于紫茎泽兰入侵地种群的卵巢蛋白质含量较原产地种群的更高,入侵地种群上的每个虫瘿中出虫数也偏高。寄生于入侵地种群紫茎泽兰的泽兰实蝇羧酸酯酶活性较寄生于原产地种群的低,乙酰胆碱酯酶活性无显著性差异,但雌虫的谷胱甘肽S-转移酶活性更高。 由此可见,入侵地种群的紫茎泽兰相比于原产地种群对泽兰实蝇的防御性有所下降。 其他相关研究也表明,外来植物入侵后会造成天敌,尤其是专食性天敌的适应性下降(高鑫等,2018; Siemann& Rogers,2003; Wan et al.,2019; Wang et al.,2012)。
泽兰实蝇成虫尤其是交配后待产卵的雌成虫,在选择寄主植物时受很多因素影响,其中植物挥发物常起着重要的作用。 已有研究发现,紫茎泽兰的入侵地种群与原产地种群的叶片挥发物有明显差异(Inderjit et al.,2011),其中入侵地种群的α-水芹烯和2-蒈烯的物质含量显著高于原产地种群,而β-蒎烯和(E)-β-石竹烯的物质含量显著低于原产地种群。 虽然植物种类、紫茎泽兰所处生育期及健康状况、重金属胁迫都会影响雌性泽兰实蝇成虫的寄主选择性(马沙等,2015),但本实验中,泽兰实蝇对原产地及入侵地紫茎泽兰种群的选择性无显著差异。 可见,α-水芹烯、2-蒈烯、β-蒎烯和(E)-β-石竹烯等物质的含量差异对泽兰实蝇寄主选择性影响不明显。 然而本实验发现,寄生于入侵地紫茎泽兰的泽兰实蝇每虫瘿出虫数要显著高于原产地。 同时,当控制在相同的寄生强度下,寄生于入侵地紫茎泽兰的泽兰实蝇卵巢蛋白质含量比寄生于原产地的高。 卵巢蛋白是影响昆虫生殖能力的关键因素,其含量增长直接与寄主营养成分相关(Sun et al.,2016)。 这表明,入侵地紫茎泽兰较原产地更适宜泽兰实蝇的生殖,应该与植株中对昆虫有利的营养物质类别和含量有关,还有待进一步深入研究。
本实验所测量的乙酰胆碱酯酶、羧酸酯酶、谷胱甘肽S-转移酶3 种酶都是昆虫体内重要的解毒酶(冯春富等,2011; 林永丽等,2001; 张红英等,2002; Soreq & Seidman, 2001)。 羧酸酯酶一般与植食性昆虫对植物的抗性有关,其活力大小明显受寄主植物类别的影响(林永丽等,2001; 张红英等,2002)。 寄生于入侵地紫茎泽兰种群的泽兰实蝇的羧酸酯酶活性普遍低于寄生于原产地的,可能与植物体内抗虫次生物质作用有关。 前期研究发现,入侵地的紫茎泽兰种群中一些抗虫次生物质含量显著低于原产地种群(高鑫等,2018),降低的某些次生物质含量减轻了对泽兰实蝇体内羧酸酯酶的激发潜力,其机制还需要进一步探索。 昆虫谷胱甘肽S-转移酶主要功能是保护DNA 及一些蛋白质免受损伤(Hayes et al.,2005)。 本文结果可见,寄生入侵地紫茎泽兰的泽兰实蝇雌虫的谷胱甘肽S-转移酶活性显著高于寄生原产地种群,但雄虫无显著差异。 研究表明,寄主植物的次生物质能够诱导谷胱甘肽S-转移酶,一些其他外源化合物也能诱导谷胱甘肽S-转移酶(林永丽等,2001; 张红英等,2002;Zou et al.,2015)。 因此认为,原产地与入侵地紫茎泽兰种群中次生物质及其他外源化合物之间的区别可能导致了该结果,换言之,入侵地紫茎泽兰种群可能随着入侵后环境及天敌种类的改变,其次生物质的种类及占比发生了变化。
泽兰实蝇于20 世纪80 年代进入我国,比紫茎泽兰侵入滞后约40 年(何大愚等,1987),这为紫茎泽兰在云南等入侵地对专一性天敌泽兰实蝇产生适应性改变提供了基础。 实际上,并非所有检测指标都是入侵地紫茎泽兰更加有利于泽兰实蝇的生长,如乙酰胆碱酯酶等活力比较结果。 为此,如何更好地监测和评价外来植物入侵后与原产地专一性天敌,随着入侵后时间同步的互作适应性及其内在演变机制,将是外来植物入侵后适应性进化和生物防治技术发展的科学问题之一。 此外,若将紫茎泽兰在原产地的泽兰实蝇进行介入比较研究,将有助于解释入侵植物与原产地天敌的协同进化机制。
