含环戊烷体系中二氧化碳水合物形成分解热特性
2020-01-15谢文俊李小森邹颖楠徐纯刚
谢文俊,李小森,邹颖楠,徐纯刚
(1中国科学院广州能源研究所,广东广州510640;2 中国科学院天然气水合物重点实验室,广东广州510640;3广东省新能源和可再生能源研究开发与应用重点实验室,广东广州510640;4中国科学院广州天然气水合物研究中心,广东广州510640;5中国科学院大学,北京100049;6广东食品药品职业学院化妆品与艺术设计学院,广东广州510520)
能源和环境问题是各国研究人员关注的重点。近年来,随着工业的不断发展,因化石燃料燃烧产生的CO2排放量逐年增加,成为导致全球气候变暖和温室效应的主要原因。因此,为了积极应对全球环境变化,如何高效节能地分离CO2成为目前亟待解决的问题[1]。传统分离CO2的方法包括吸收法、吸附法、膜分离法、低温蒸馏法、电化学法和化学循环燃烧法等,但是不同的方法存在各自的缺陷,如化学吸附法中的化学吸附剂容易造成设备腐蚀、低温蒸馏法费用昂贵等,所以上述方法并没有得到广泛应用[2-4]。最近水合物法分离CO2因其操作简单、能耗低等优点引起了人们的极大关注。气体水合物是由水分子作为主体分子,气体分子(CH4、CO2、H2等)作为客体分子而形成的一种非化学计量的笼型晶体结构化合物。水分子之间通过氢键构成水合物结构的晶格主体,气体分子作为客体分子进入晶格主体并被包裹在里面[5]。气体水合物主要有三种结构,即立方结构Ⅰ型,立方结构Ⅱ型和六方结构H 型。Sloan 等[6]和Sum 等[7]对气体水合物结构有更详细的描述。水合物法分离CO2的原理是根据相同条件下不同气体在水合物相和气相中的组分浓度差异而进行气体分离。比如,在相同的温度条件下,相比于H2和N2,CO2形成气体水合物的相平衡压力要低很多,更容易进入水合物相形成气体水合物,从而达到从CO2/H2或CO2/N2混合气中分离CO2的目的[8]。但是在纯水体系下形成CO2水合物的条件非常苛刻,因此可以通过添加不同类型的促进剂来改善CO2水合物的形成条件,比如降低CO2水合物形成的压力,提高CO2水合物形成的温度,缩短CO2水合物的成核时间等。目前国内所使用的促进剂主要有四氢呋喃(THF)、环戊烷(CP)和四丁基溴化铵(TBAB)等,研究的主要内容是添加促进剂后,测定CO2水合物形成的相平衡条件、分析CO2水合物的结构以及测定CO2水合物生成/分解过程中的焓变[9-12]。
激光Raman 是一种基于分子振动或转动能级对物质的分子、组成及结构等进行分析的微观手段,由于其准确、简单方便等特点已被成功应用于实验研究中,近些年来也有应用到水合物的研究中[13]。Chen 等[14]分析了sⅠ型CO2水合物和sⅡ型THF-CO2二元水合物的Raman 光谱图,结果显示sⅡ型THF-CO2水合物小笼子中CO2的Fermi 分裂峰出现在1274 cm-1和1380 cm-1。自20世纪80年代以来,量热法主要用于笼型水合物的热性能研究,比如分解焓和热容[15-17]。差式扫描量热法(DSC)是在程序控制温度下,测量输入到试样和参比物之间的功率差与温度关系的一种分析方法。DSC技术首先应用于Koh等[18]的研究,他们在环境压力下对模型水合物进行了实验,使用DSC 来量化和比较各种动力学抑制剂的效果。Dalmazzone 等[19]第一次将高压DSC 应用于气体水合物研究,以此来表征甲烷和天然气水合物在抑制剂溶液中的热力学稳定性极限。Zhang 等[20]通过高压DSC 测量了H2-CP 和CO2-CP 二元水合物在不同压力范围的分解温度,结果表明,H2水合物的分解温度取决于添加剂的性质,CO2水合物的分解温度受添加剂性质的影响不大。气体水合物的分解焓(ΔHd)是预测水合物分解成水和气体所需热量的关键参数[21]。为了揭示气体水合物形成的微观机理,本研究测定了恒容体系中CP 为5%(体积分数,下同),不同初始压力条件下CP-CO2水合物的生成速率及气体消耗量,并采用激光共焦Raman 光谱仪对不同条件下CPCO2二元体系生成的水合物Raman 峰进行了分析。为了进一步研究CO2水合物的生成和分解过程,探究其生成焓和分解焓的规律,本研究还利用低温高压DSC 来初步研究CP 为5%的体系,不同温压条件下CO2水合物的生成和分解规律,对CO2水合物生成和分解过程进行了热表征分析,以此来分析气体水合物形成微观机制。
1 实验材料和方法
1.1 实验设备和原材料
本次实验使用的低温高压DSC(BT2.15)设备购自法国塞特拉姆公司,该设备的使用压力范围为真空~60MPa,使用温度范围为-196~200℃,温度扫描速率范围为0.01~1℃/min,样品池的最大体积为12.5mL。激光共焦Raman光谱仪购自法国HORIBA JY仪器公司,实验中所用CO2(>99.99%)由广州盛盈气体有限公司提供,环戊烷(CP,分析纯,99.0%)出自厦门先锋化学试剂公司,去离子水为中科院广州能源研究所自制。
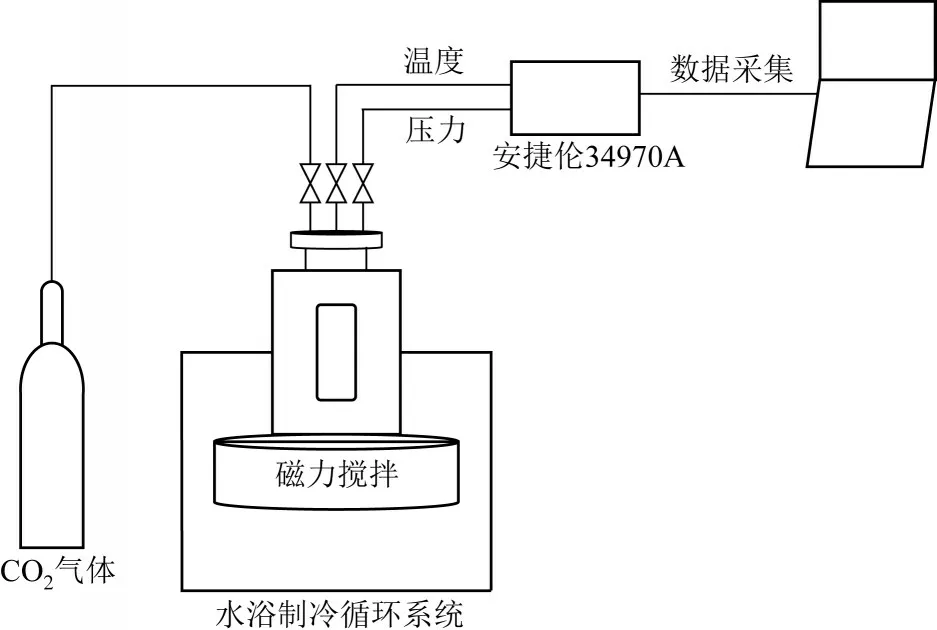
图1 实验装置示意图
实验装置示意图见图1,由可视化高压反应釜,水浴制冷循环系统及数据采集系统组成。高压反应釜由304 不锈钢材料制成,内体积为100mL,最大承受压力为10MPa。反应釜前后两侧有有机玻璃视窗,透过视窗可以观察反应釜内水合物形成分解过程。反应釜上有法兰,并通过导管与气瓶相连,反应釜内温度和压力则通过热电偶和Pt 100压力传感器进行测量,温度精度为±0.1K,压力精度为±0.01MPa。温度、压力通过数据采集系统直接传入电脑并通过软件进行分析。反应釜放在转速为0~2000 r/min的磁力搅拌器上,启动磁力搅拌器可实现反应釜内物质充分混合。反应釜外有一个水浴夹套,通过水浴制冷循环系统维持反应釜内温度。
1.2 实验过程
1.2.1 水合物的形成实验
配制5%的CP乳液30mL,超声分散30~60min,使CP 与水充分分散。用去离子水将反应釜清洗干净并干燥,设置水浴温度,待水浴温度稳定后将配制好的乳液倒入反应釜中,盖上法兰密封。注入实验气体CO2至0.6MPa,排气,将此步骤重复3~4次,排尽反应釜内的空气,注入实验气体CO2至目标压力,打开磁力搅拌,设置为1200r/min,当反应釜内的压力和温度维持60min以上不变时认为水合物生成完成,取水合物样进行激光Raman测试。
1.2.2 水合物形成分解过程热表征实验
配制5%的CP乳液30mL,超声分散30~60min,然后称取质量为1g(精确度为0.1mg)的乳液样品于低温高压DSC 设备的样品池中,本实验中样品质量为1.0550g。将高压样品池装入测量单元,用N2对测量单元吹扫3次,再用CO2气体吹扫样品池,排尽样品池的空气,第一组实验程序设定压力为2.5MPa,降温范围20.0~-5.0℃,降温速率为0.02℃/min,恒温8h,升温范围为-5.0~20.0℃,升温速率为0.02℃/min,通入CO2气体至目标压力;之后改变操作温度、压力条件进行第2~4组实验。
1.2.3 激光Raman测试
本实验中采用532nm 的Ar 离子激光发射器,1800L/mm 的光栅测量形成的CP-CO2二元水合物,在测量样品之前用520.7cm-1的标准硅(Si)晶体校准Raman光谱仪。
2 结果与讨论
2.1 水合物形成过程分析
气体水合物形成过程中压力和温度随时间变化见图2,与图2 中A、B、C 对应时间的水合物形貌见图3。可以看到压力剧烈下降,随着时间的推移,压力下降越来越慢,用一段时间内反应釜内的压降随时间的变化来表示体系中气体水合物的平均生成速率,计算如式(1)所示[22]。
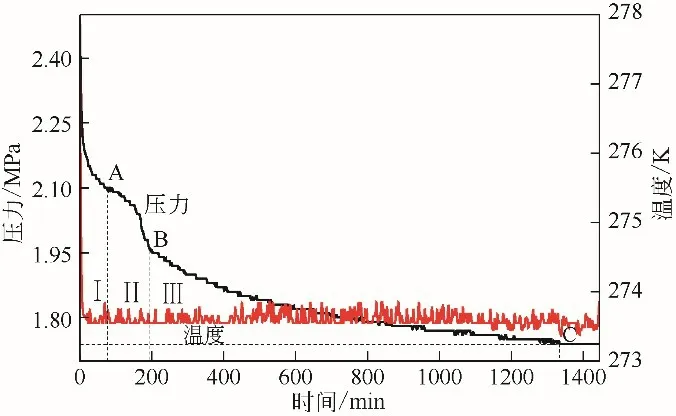
图2 CP-CO2体系压力和温度随时间变化关系(2.5MPa)

图3 水合物形成过程中不同时间的水合物形貌

其中,Δn为Δt时间内的气体消耗量,mol;t为时间,min;P为压力,Pa;V为反应釜内气体体积,L,z为压缩因子,由P-R方程计算得到;R为理想气体常数,J/(mol·K);T为温度,K。
根据图2中压力曲线存在的两个平台,将气体水合物的形成过程分为3 个阶段,分别为Ⅰ、Ⅱ、Ⅲ阶段。根据压力下降与对应时间,不同阶段的气体水合物生成速率可通过式(1)获得,其中,第Ⅰ阶段的气体水合物平均生成速率为1.902×10-4mol/min,第Ⅱ阶段气体水合物的平均生成速率为2.869×10-6mol/min,第Ⅲ阶段气体水合物的平均生成速率为1.294×10-6mol/min。由此,可以看到气体水合物的生成速率随着水合物形成时间的推移而逐渐下降。经计算,总的气体消耗量为0.0187mol/mol。这是因为,第Ⅰ阶段,CO2分子溶解在CP 水溶液中,并与CP 分子一起形成水合物。第Ⅰ阶段生成的水合物膜使得气体水合物生成过程中的传质受到阻碍,并且气体水合物在气-液界面和反应釜壁面聚集越来越多,液相中的水合物变得越来越黏稠,阻止了更多的气体与水进一步接触,进而导致第Ⅱ、Ⅲ阶段的水合物生成速率越来越慢。
初始压力为5.0MPa 时,水合物生成过程中压力和温度随时间变化见图4,与图4中A、B对应时间水合物形貌见图5。可以看到温度先升高后下降,说明此过程中有大量水合物生成,释放出热量,导致反应釜内温度升高。0~19min 内压力急剧下降,由5.0MPa下降到3.48MPa,该阶段气体水合物的平均生成速率为0.0652mol/min。这是因为压力较高时,气体在液相中充分分散,生成大量水合物,并且在反应釜底部聚集,表明生成的水合物密度比水大。19~123min内压力由3.48MPa下降到3.44MPa,123min 后压力保持不变,实验中总的气体消耗量为0.744mol/mol。
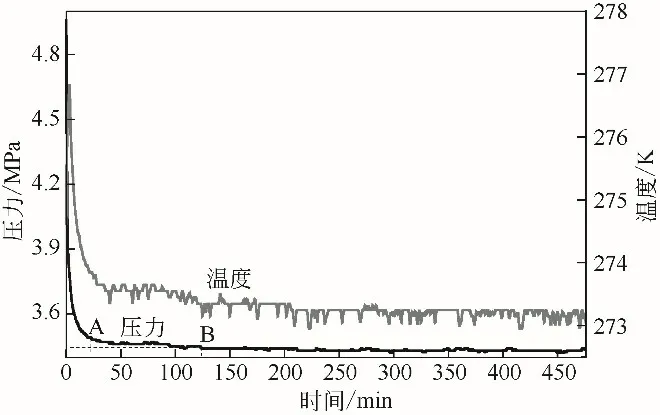
图4 CP-CO2体系压力和温度随时间变化关系(5.0MPa)

图5 水合物形成过程中不同时间的水合物形貌
对比图2 和图4 发现,恒容条件下,温度随时间变化的关系曲线中都出现了峰值,由于水合物的生成是一个放热过程,当水合物生成速率最快最集中时,温度也达到最大值,随后逐渐降低,最终趋于稳定。初始压力为5.0MPa 时的气体消耗量是初始压力为2.5MPa 时的39.8 倍。这是因为压力由2.5MPa 增加到5.0MPa 时,生成气体水合物的驱动力变大,此外溶液中溶解的CO2量更多,最终导致更多的气体进入水合物笼中形成水合物,体系中的气体水合物生成速率升高,气体消耗量变多。
2.2 水合物Raman光谱特征分析
初始压力为2.5MPa和5.0MPa时生成的CP-CO2二元水合物Raman光谱图见图6(a),为了更好地展现CO2分子的Raman 峰,将其放大见图6(b)。初始压力为2.5MPa 时,CO2分子的Raman 峰出现在1276.3cm-1和1379.6cm-1,峰强度的比值为1.43,初始压力为5.0MPa 时,CO2的Raman 峰出现在1276.1cm-1和1379.6cm-1,峰强度的比值为1.93,都与Ⅱ型结构水合物小笼子和大笼子的理论比值2接近,说明生成的CP-CO2二元水合物为结构Ⅱ型水合物,CO2分子在水合物笼中,CP分子的Raman峰出现在896cm-1和2876cm-1附近也表明CP分子在水合物笼中。
2.3 水合物形成分解过程热表征
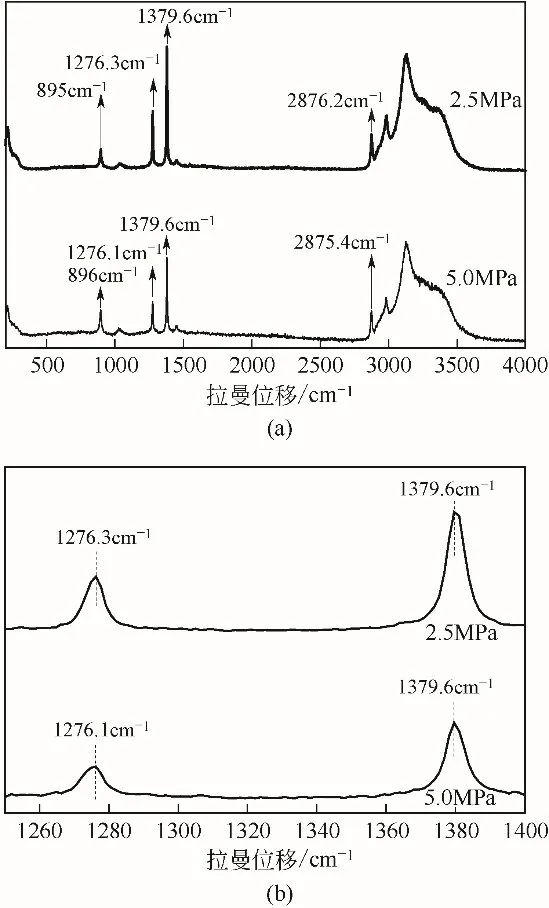
图6 不同实验条件下CP-CO2二元水合物Raman光谱图

表1 不同实验条件下水合物生成分解温度
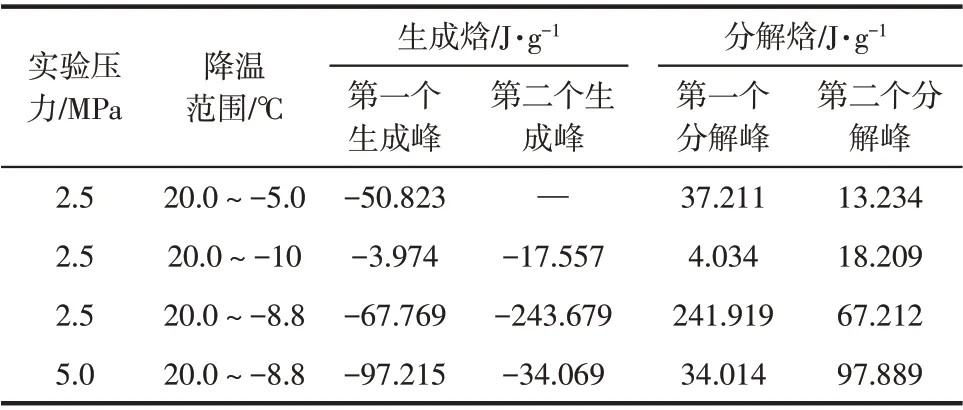
表2 不同实验条件下水合物生成分解焓
表1 和表2 分别为不同实验条件下水合物生成分解温度及焓变。从表1可以看到实验操作压力为2.5MPa 时,每次实验第一个放热峰出现的温度都不相同,这是因为在实验的升温阶段,溶液中的CP会挥发,导致再次进行实验时溶液中CP体积减小,进而CP 水合物的生成温度降低。压力增大,溶液中的CP 体积增大,水合物的生成温度也随之升高。由表2结果发现,水合物的生成焓和分解焓略有差别,这是由于降温阶段存在过冷现象,故根据升温阶段得到的分解焓来判断水合物的分解规律更准确。
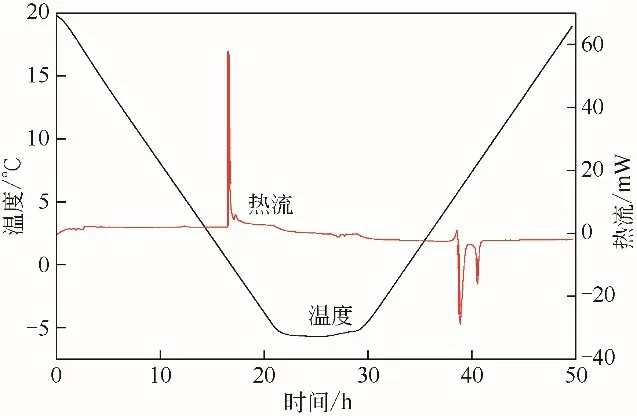
图7 20.0~-5.0℃降温范围内热流量温度曲线
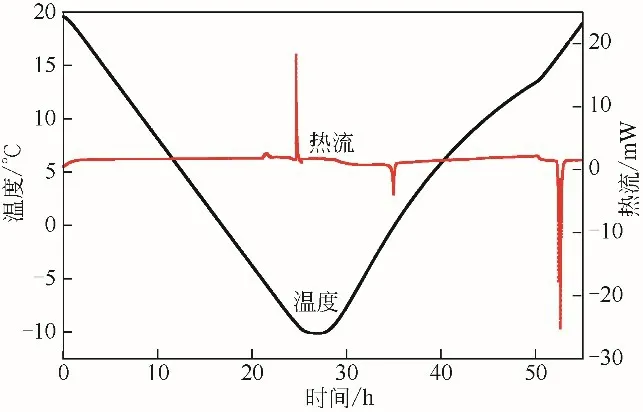
图8 20.0~-10.0℃降温范围内热流量温度曲线
图7 为第一组实验的热流量和温度曲线,图8是在相同体系中,降温范围为20.0~-10.0℃,升温范围为-10.0~20.0℃,其他实验条件不变的热流量和温度曲线。在图7、图8 中,放热峰为正值,吸热峰为负值。从图7可以看到,放热峰有两个峰值,出现第一个峰值对应的温度为0.95℃,此温度明显高于冰点温度,说明该放热峰对应生成的是水合物而不是冰,生成焓为-50.823J/g,在升温过程中,出现了两个吸热峰,对应的温度分别为5.74℃和6.93℃,分解焓为37.211J/g和13.234J/g,由此可以判断降温阶段生成的水合物为CP-CO2二元水合物和CO2水合物,由于CO2水合物和CP水合物在同一压力条件下的稳定性不同,吸热峰表示降温阶段生成的水合物先分解释放出CO2,随后CP 水合物分解。图8 中可以看到两个放热峰,在降温过程中,第一个放热峰出现在温度为-3.95℃,表示CP水合物的生成,将曲线积分得到该水合物的生成焓为-3.974J/g,其对应的吸热峰出现在温度为-1.90℃,表示水合物的分解,分解焓为4.034J/g。温度为-8.89℃时出现了第二个放热峰,生成焓为-17.557J/g,其对应的吸热峰出现在温度为15.64℃,分解焓为18.209J/g,表示CP-CO2二元水合物的分解,该吸热峰出现了两个峰值,说明该二元水合物分解释放出CO2,随后CP水合物分解。
根据前两组实验的结果,将降温范围调整为20.0~-8.8℃,其他实验条件相同,进行了第3 组实验,实验结果见图9。在实验条件下,降温阶段出现了两个放热峰,即生成了两种不同类型的水合物,第一种水合物的生成温度为-2.65℃,生成焓为-67.769J/g,第二种水合物的生成温度为-5.93℃,生成焓为-243.679J/g。升温过程中第一个吸热峰出现在-1.97℃,分解焓为241.919J/g,并且在升温阶段有一个二次生成峰,出现在温度为4.54℃,说明该温度下有水合物生成,温度为5.62℃时出现了第二个吸热峰,分解焓为67.212J/g。根据本次实验结果可以判断第一个放热峰为CP-CO2二元水合物的生成峰,第二个放热峰为CO2水合物的生成峰,第一个吸热峰对应CO2水合物的分解,并且分解释放的部分CO2在该温压条件下生成了二次水合物,即图中出现的二次生成峰,第二个吸热峰对应CPCO2二元水合物和二次生成水合物的分解。比较图7、图8、图9发现,降温范围对放热曲线有一定的影响,降温范围越大,放热峰与吸热峰之间的时间间隔越短。

图9 20.0~-8.8℃降温范围内热流量温度曲线(2.5MPa)
为了探究压力对水合物生成条件的影响,与第3组实验相比,其他实验条件不变,将压力恒定在5.0MPa,进行第4组实验,得到的热流量和温度曲线见图10。可以看到,在降温阶段出现了两个放热峰,升温阶段有两个吸热峰,并且升温过程中没有放热峰出现,温度降到14.33℃时出现了第一个放热峰,为CP 水合物的生成峰,第二个放热峰出现在温度为3.66℃,为CO2水合物的生成峰,其对应的水合物生成焓分别为-97.215J/g 和-34.069J/g。在升温过程中,水合物的分解温度分别为4.93℃和14.16℃,对应的水合物分解焓为34.014J/g 和97.889J/g,分别为CO2水合物和CP水合物的分解。
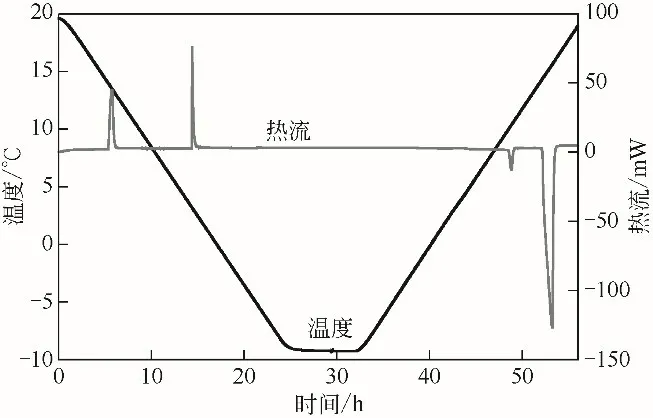
图10 20.0~-8.8℃降温范围内热流量温度曲线(5.0MPa)
第一组实验和第三组实验生成的第一种水合物是CP-CO2二元水合物,生成的第二种水合物是CO2水合物,但是第三组实验CP-CO2二元水合物的生成焓大于第一组实验,说明两组实验中生成的CP-CO2二元水合物中CP 分子和CO2分子数不同,故生成焓也不同。第三组实验CO2水合物的生成焓也大于第一组实验,这是因为不同温度时生成的CO2水合物在大小笼中的分子数不一样而导致CO2水合物的生成焓不同。通过对比图9和图10,发现压力由2.5MPa 增大到5.0MPa 时,水合物生成峰之间的时间间隔变大,放热峰与吸热峰之间的时间间隔也变大,这是因为随着压力增大,水合物的生成温度升高,同时水合物更容易稳定存在。实验还发现水合物的生成温度随压力的增大而升高,说明此实验条件有利于水合物的生成,压力增大时,生成的水合物不再是二元水合物,而是单一的一元水合物。换句话说,压力的增加更有利于一元气体水合物形成。
3 结论
为了理清气体水合物的形成分解机理,实验从宏观角度研究了恒容条件下,CP为5%的体系中初始压力为2.5MPa 和5.0MPa 时,气体水合物的生成速率及CO2气体消耗量。实验结果表明,初始压力越大,生成水合物的驱动力越大,进入水合物相的气体分子越多;初始压力越大,生成水合物的速率越快,气体消耗量越大。实验还利用激光Raman光谱仪和低温高压DSC 从微观角度分析了气体水合物的形成分解特性,CO2分子和CP分子的Raman峰显示CO2和CP 都进入了水合物笼中,但是根据客体分子的Raman 峰并不能确定CP 和CO2分子在大小笼子中的分布,这也将是下一阶段研究的重点。在低温高压差式扫描量热法中,不同的降温范围和压力条件对生成的水合物类型及水合物生成分解过程都有影响。相同的实验条件下,CP 比CO2更容易生成水合物,更能稳定存在;操作压力越高,水合物的生成温度越高;压力越高,水合物越容易稳定存在。增大操作压力可以提高水合物的生成温度,改善水合物的生成条件,还可以改变生成水合物的类型。该实验结果对研究CO2水合物生成分解过程的微观机理提供了一定的依据和参考价值。
