水力负荷与有机负荷协同作用对人工湿地微生物群落结构的影响*
2020-01-15丁海静游俊杰王敦球王荣华白少元
丁海静 游俊杰 王敦球, 王荣华 刘 良 白少元,#
(1.桂林理工大学广西矿冶与环境科学实验中心,广西 桂林 541004;2.桂林理工大学广西环境污染控制理论与技术重点实验室,广西 桂林 541004;3.广西恒晟水环境治理有限公司,广西 桂林 541004)
在人工湿地系统中,微生物对不同污染物的净化起重要作用,在物质转化、能量流动中也占有重要的位置,微生物的种群结构及多样性直接影响到湿地系统的净化功能[1-2]。为更好地了解湿地系统中微生物的多样性,前人对此展开了大量的研究。李新慧等[3]研究了多种氟喹诺酮对人工湿地净化能力和微生物群落的影响,通过在人工湿地进水中添加氧氟沙星、诺氟沙星和环丙沙星等,监测水质变化和微生物群落变化。裘湛[4]综述了湿地植物种类、光照条件、基质特性等对植物根际效应的影响,进一步阐释分析了湿地植物对根际微生物活性、降解性能和种群组成的影响机理。在人工湿地系统工艺设计中,通过筛选人工湿地植物种类和优化工艺条件来强化人工湿地植物根际效应,有助于提高人工湿地工艺的处理效率。陈慧萍等[5]采用高通量测序和网络分析对电解强化人工湿地系统中的功能微生物群落进行了研究。结果显示,电解强化人工湿地中有大量的自养型反硝化功能菌,保障了在低碳氮比下污水处理厂尾水中氮的脱除。
综上可知,人工湿地基质微生物的研究至关重要,鉴于此,本研究以3种基质结构构建人工湿地系统,分别在不同水力负荷、不同有机负荷运行条件下,利用高通量测序技术对人工湿地系统基质表面的微生物进行测序,分析不同填充结构形成不同流场分布的人工湿地床体中微生物的群落结构和多样性,最后分析不同基质结构与微生物群落结构分布的相关性[6-7]。
1 材料与方法
1.1 实验装置
本研究模拟水平潜流人工湿地系统,湿地系统长、宽、高分别为2.0、1.2、0.7 m,均由厚度为3 mm的不锈钢材构建而成。湿地基质填充深度0.6 cm,表层预留10 cm的超高区域,床体种植湿生挺水植物美人蕉,种植密度为20株/m2。湿地的布水区和集水区宽度均为20 cm,均用渗透系数为500 m/d的鹅卵石进行填充,床体其余区域均用石英砂填充。构建3个小型人工湿地装置:(1)单层基质结构人工湿地系统,记为CW1,该湿地基质用粒径为4.75~8.00、2.00~3.35 mm的石英砂以1∶1的质量比混合填充,基质渗透系数为65 m/d;(2)3层基质结构人工湿地系统,记为CW3,该人工湿地系统基质石英砂粒径分布为第1层0.20~0.40 mm,第2层0.40~0.60 mm,第3层0.90~2.00 mm,基质渗透系数从上到下依次为26、36、64 m/d;(3)6层基质结构人工湿地系统,记为CW6,该人工湿地系统基质石英砂粒径分布为第1层0.40~0.80 mm,第2层0.40~0.60 mm,第3层0.40~0.90 mm,第4层1.00~2.00 mm,第5层2.00~4.00 mm,第6层4.00~6.00 mm,其渗透系数从上到下依次为38、36、43、55、75、176 m/d。
1.2 进水水质
实验装置位于桂林理工大学污水处理站,原水来自调节池,实验采用连续进水运行方式,储水箱容积为2 m3,以乙酸钠为氮源,氯化铵为碳源,磷酸二氢钾为磷源,根据实验设计的水力负荷和有机负荷配置模拟污水,调节污水C∶N∶P(质量比)=80∶6∶1。
1.3 运行参数
实验设置2个水平的水力负荷及4个水平的有机负荷,实验运行参数设置见表1。为降低有机负荷变化对湿地基质的影响,实验过程逐步提高进水有机负荷,在低、高水力负荷交替下运行,即依次为L1、H1、L2、H2、L3、H3、L4、H4,运行过程中监测湿地进水和出水的COD和总悬浮固体(TSS),待出水监测指标稳定时视为实验结束,将储水箱残留物进行清理,然后进行下一运行条件的实验。
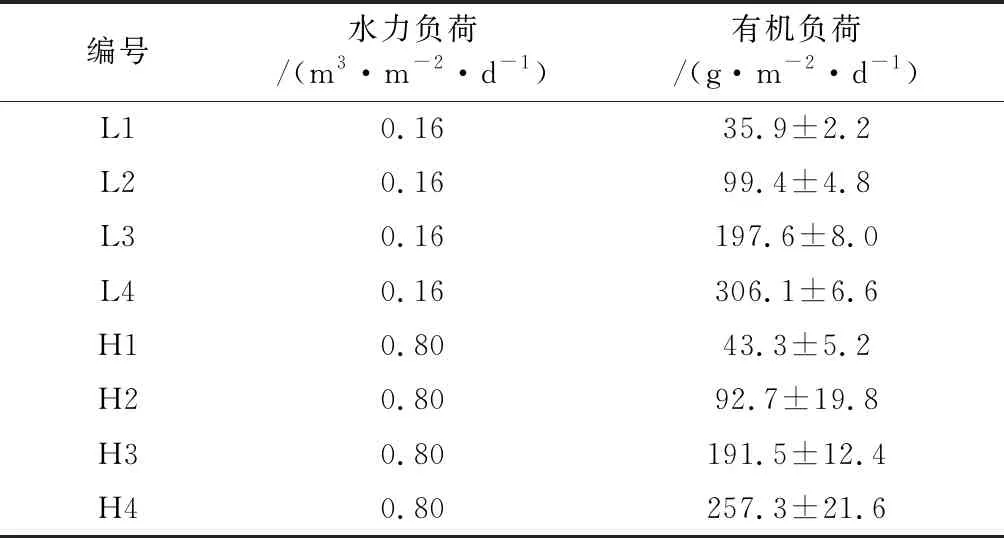
表1 实验运行参数设置
1.4 采样及测试
实验运行期间每周测定人工湿地进出水COD、TSS,于高负荷运行条件(H4)下对床体的进水端(距布水区30 cm处)和出水端(距集水区30 cm)的基质进行取样,分别采集基质表层(0.1 m)、基质中层(0.3 m)、基质底层(0.5 m)样品,进水端表层、中层、底层基质样品分别标记为A1、A2、A3,出水端表层、中层、底层基质样品分别标记为B1、B2、B3,以CW3为例,人工湿地结构图及取样点布置情况如图1所示。
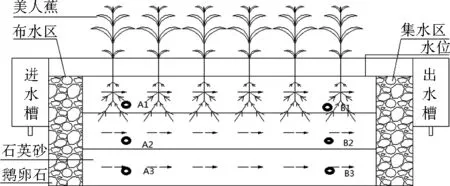
图1 CW3实验装置及采样点布置Fig.1 CW3 experimental setup and sampling point
1.5 样品预处理和高通量测序
称取0.5 g基质样品采用Mag-Bind Soil DNA Kit的试剂盒进行DNA初步提取,具体实验步骤如下:在2 mL离心管中加入0.8 mL Buffer SLX Mlus,振荡混匀5 min,加入80 μL Buffer DS并振荡混匀,接着在恒温金属浴70 ℃下裂解10 min,13 000 r/min室温离心5 min,吸取600 μL上层液体,加入200 μL Buffer SP2,振荡混匀,加入100 μL HTR Reagent,混匀10 s,冰浴5 min,13 000 r/min室温离心5 min,吸取400 μL上清液体,加入450 μL Binding Buffer和40 μL MagSi Particles振荡混匀,室温静置2 min,放置在磁力架上吸附5 min,弃上层清液;加入500 μL Binding Buffer,振荡混匀,室温放置2 min,放置在磁力架上吸附5 min,弃上层清液;加入1 000 μL Buffer PHB,振荡混匀,放置在磁力架5 min,弃上层清液;加入1 000 μL SPM Wash Buffer,混匀放置在磁力架5 min,弃上层清液;重复加入1 000 μL SPM Wash Buffer,混匀放置在磁力架5 min,弃上层清液,置于55 ℃烘箱10 min,使SPM Wash Buffer中残留的酒精完全挥发,加入60 μL Elution Buffer到离心管中,充分振荡混匀,65 ℃金属浴10 min,磁力架吸附5 min,吸取上清DNA液体到1.5 mL离心管中。
对18个基质样品进行DNA初步提取,然后用1%(质量分数)的琼脂糖凝胶检测DNA完整性。对16s RNA基因的V4高变区片段进行聚合酶链式反应(PCR)扩增,引物序列为515F引物:CCCTACACGACGCTCTTCCGATCTN (barcode) GTGCCAGCMGCCGCGGTAA和805R引物GACTGGAGTTCCTTGGCACCCGAGAATTCCAGGAC TACHVGGGTATCTAATCC。扩增条件为:94 ℃预变性3 min;接着94 ℃变性30 s,45 ℃退火20 s,65 ℃延伸30 s,进行5个循环;然后94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸30 s,进行20个循环;循环结束后72 ℃最终延伸5 min。PCR结束后,PCR产物进行琼脂糖电泳检测,利用Qubit 2.0 DNA检测试剂盒对回收的DNA精确定量,随后进行高通量测序分析,对97%相似水平的可操作分类单元(OTUs)代表序列进行分类分析,并在各个分类水平上统计每个样品的群落组成[8]。
1.6 数据处理
采用软件Excel 2010和SPSS 20.0对实验数据进行分析,并使用Origin 8.0画图。
2 结果与讨论
2.1 不同负荷条件下人工湿地的净化效果
3个人工湿地系统对COD、TSS的去除效果见图2至图5。可以看出,3个人工湿地系统对COD、TSS都有明显的去除效果,不同水力负荷条件下,随着有机负荷的提高,COD、TSS的去除率均表现出先升高后下降的趋势;总体看来,相同运行条件下,CW6对COD、TSS的去除率最高,低水力负荷条件下,CW6在较低有机负荷水平(L2)时的净化效果最好,COD、TSS去除率分别为88.8%±1.4%、85.8%±1.4%;高水力负荷条件下,CW6在较高有机负荷水平(H3)时的净化效果最好,COD、TSS去除率分别为80.4%±2.2%、82.4%±4.0%。CW6从床体表层到底层渗透系数逐渐升高,这种分层结构可强化人工湿地对COD、TSS的去除能力,这可能是由于不同渗透系数分层结构使床体流场分布趋于均匀,有利于基质及基质上附着的微生物与污染物充分接触,提高净化性能。
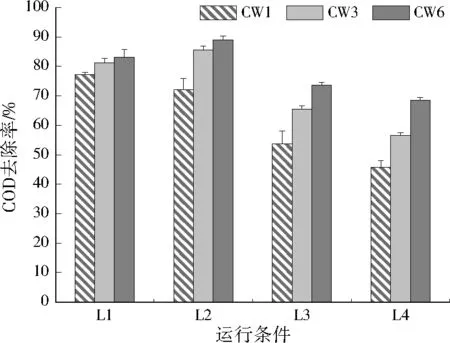
图2 低水力负荷条件下CW1、CW3和CW6的COD去除率Fig.2 COD removal rate of CW1,CW3 and CW6 under low hydraulic loading conditions

图3 高水力负荷条件下CW1、CW3和CW6的COD去除率Fig.3 COD removal rate of CW1,CW3 and CW6 under high hydraulic loading conditions
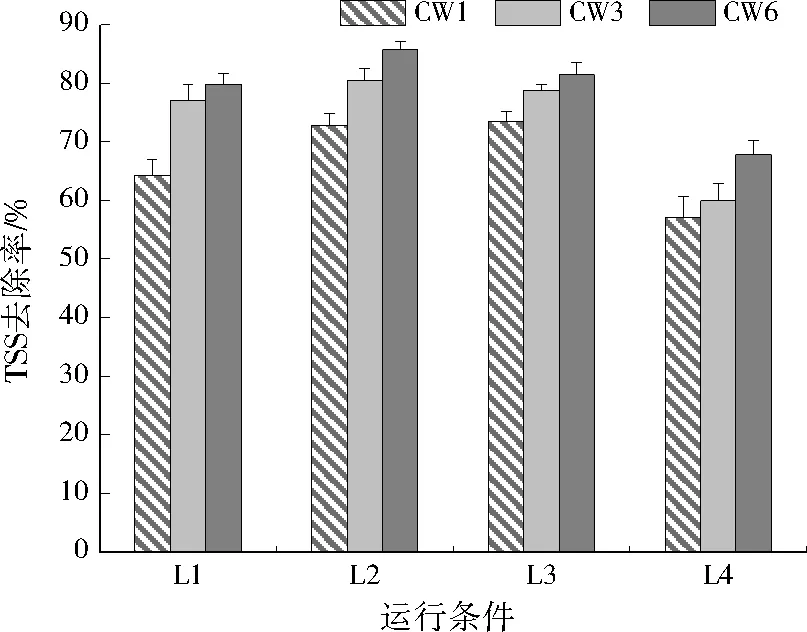
图4 低水力负荷条件下CW1、CW3和CW6的TSS去除率Fig.4 TSS removal rate of CW1,CW3 and CW6 under low hydraulic loading conditions
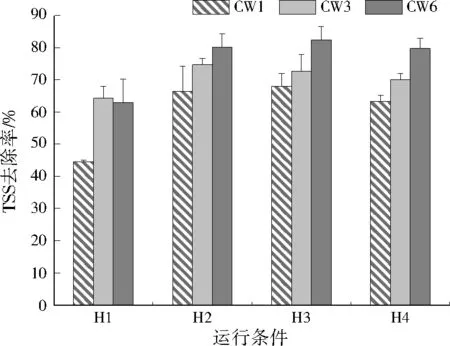
图5 高水力负荷条件下CW1、CW3和CW6的TSS去除率Fig.5 TSS removal rate of CW1,CW3 and CW6 under high hydraulic loading conditions
2.2 微生物群落结构
2.2.1 门水平群落结构组成
在H4运行条件下采集各人工湿地系统基质样品,利用高通量测序方法分析18个基质样品,得到615 845条高质量序列和12 001个OTUs,包括40门、71纲、147目、236科及763属。对样品中相似度97%以上的OTUs在门水平上进行统计分析,CW1、CW3、CW6中各基质样品的微生物在门水平上的群落结构组成如图6所示。可以看出,所有基质样品中鉴定出的优势菌主要为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)。由图7可见,3个人工湿地系统中的主要菌门均为变形菌门,其在CW1中相对丰度为55.9%,在CW3、CW6中的相对丰度分别为50.8%、57.6%,变形菌门是生活污水中的主要优势菌[9],大多数为异养菌,它们代谢途径很多,不同类型的有机物经过其消化和分解均能有所去除。已有研究表明,变形菌门中包含许多与有机物和无机物代谢(如碳循环、氮循环和硫循环)有关的菌属,其在人工湿地中广泛分布[10-11],有助于发挥出人工湿地对污染物的去除作用。拟杆菌门和厚壁菌门在CW1中的相对丰度分别为18.0%、7.6%,在CW3中的相对丰度分别为13.6%、20.6%,在CW6中的相对丰度分别为18.8%和6.9%。拟杆菌门主要优势菌为化能营养细菌,能够将淀粉、纤维素最终水解为氨基酸、有机酸等,所以对有机物的降解同样具有重要作用[12-13],促进了人工湿地对污染物的去除效果。厚壁菌门同样是以化能营养细菌为主的菌门,在其生长环境中都会有其内生孢子,也是生活污水中常有的菌群[14-15]。连续进水方式使人工湿地系统复氧能力减弱,导致系统基质处于还原状态,不利于有机物的降解,影响微生物正常生命活动,进而使运行后期各污染物的去除率降低。
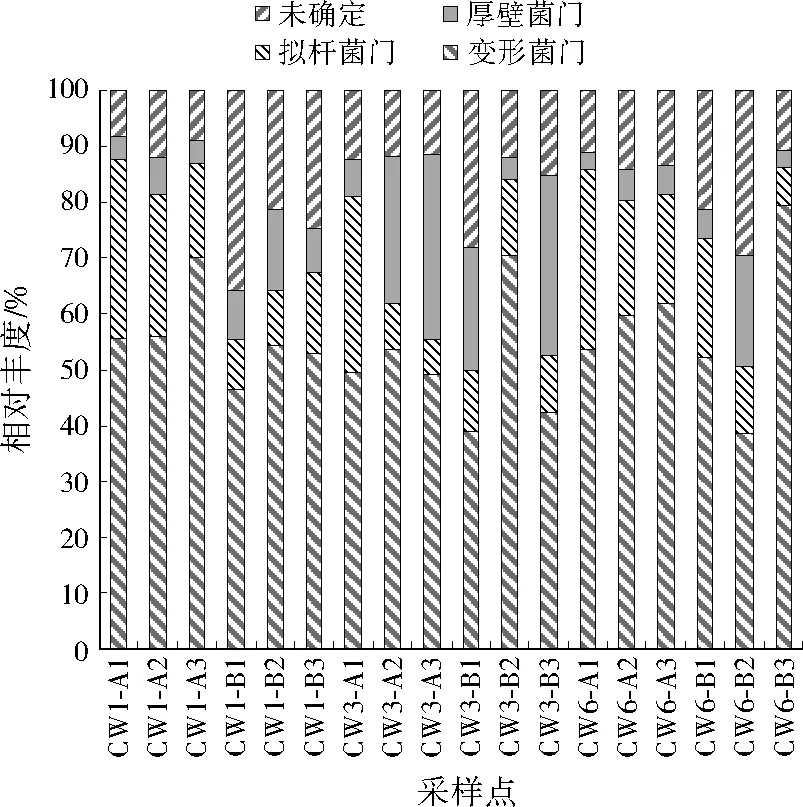
图6 3个人工湿地中微生物OTUs分布Fig.6 OTUs distribution of microorganisms in 3 constructed wetlands
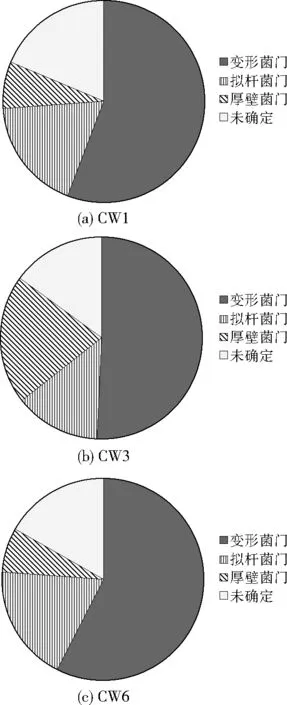
图7 3个人工湿地中各菌门相对丰度Fig.7 The proportion of each phylum in 3 constructed wetlands
2.2.2 纲水平群落结构组成
对CW1、CW3、CW6中各基质样品微生物在纲水平上的相对丰度进行分析。变形菌门中的优势菌群为γ-变形菌纲(Gammaproteobacteria)、α-变形菌纲(Alphaproteobacteria)和β-变形菌纲(Betaproteobacteria),其中,不同湿地系统的γ-变形菌纲的相对丰度具有相似性,并且在所有纲类上占比最高,而β-变形菌纲差异性最为明显,在CW1、CW3和CW6湿地床体中相对丰度分别为12.9%、15.3%和20.3%,β-变形菌纲经常利用有机物分解产生的氨气、甲烷等营养物质,β-变形菌纲的相对丰度越高,表明微生物群落结构越稳定[16-17]。WARKENTIN等[18]研究了水环境中细菌对溶解性有机污染物(DOP)的降解性,发现细菌对瓦尔诺河水体中的DOP具有生物再矿化作用,特别是原放线菌、β-变形菌、噬纤维菌和黄杆菌对DOP具有趋化性优势。拟杆菌门中相对丰度较高的菌群有鞘脂杆菌纲(Sphingobacteriia)、黄杆菌纲(Flavobacteriia)和拟杆菌纲(Bacteroidia),它们在3个湿地系统中的相对丰度均有一定的差异性,其中以鞘脂杆菌纲相对丰度最高,在CW1、CW3和CW6中相对丰度分别为9.5%、5.3%、7.1%;芽胞菌纲(Bacilli)和梭菌纲(Cytophagia)属于厚壁菌门,两者在不同湿地系统中表现出明显的差异性,其中芽胞菌纲相对丰度较高,其在CW3中的相对丰度最高,达到13.1%,而在CW1、CW6中的相对丰度仅有4.9%、4.5%。由此看出,由于污水中污染物组成相同,因此CW1、CW3和CW6中的微生物结构存在相似性,但湿地床体的分层结构不同对微生物群落结构产生影响,因此微生物结构也有不同程度的差异性,总的来说,分层填充的人工湿地系统微生物群落结构更为稳定,对污染物的去除效果较好。
3 结 论
(1) 不同水力负荷条件下,随着有机负荷的提高,CW1、CW3和CW6湿地系统COD、TSS的去除率均表现出先升高后下降的趋势;总体来看,相同运行条件下,CW6对COD、TSS的去除率最高,可见不同渗透系数分层结构使床体流场分布趋于均匀,有利于基质及基质上附着的微生物与污染物充分接触,提高净化性能。
(2) CW1、CW3、CW6湿地系统微生物在门水平上主要优势菌门有变形菌门、拟杆菌门和厚壁菌门,它们都对污水中有机物分解和利用具有重要作用,其中以变形菌门占绝对优势。
(3) 对基质样品微生物在纲水平上的相对丰度进行分析,γ-变形菌纲在变形菌门中占主导地位,在不同湿地系统中具有相似性,而β-变形菌纲差异性最为明显,在CW1、CW3和CW6湿地床体中占比分别为12.9%、15.3%和20.3%。拟杆菌门中鞘脂杆菌纲相对丰度最高,在CW1、CW3和CW6中相对丰度分别为9.5%、5.3%、7.1%,厚壁菌门中芽胞菌纲相对丰度较高,CW1、CW3、CW6中的相对丰度为4.9%、13.1%、4.5%。
(4) 湿地系统基质结构对微生物群落结构具有不同程度的影响,分层填充的湿地系统形成的均匀流场有助于微生物群落结构的稳定。
