Ag/α-Fe2O3/g-C3N4光催化降解罗丹明B
2020-01-15李宏鑫
李宏鑫,王 铮,张 亚
(1.陕西兰环环境工程集团有限公司 技术部,陕西 西安 710054;2.西安科技大学 地质与环境学院,陕西 西安 710054;3.西安中地环境科技有限公司 环境影响评价部,陕西 西安 710054)
g-C3N4作为一种新型的光催化剂,有很多优异性能,例如良好的热力学和化学稳定性,合适的谱带位置(导带-1.13 eV,价带1.57 eV)和禁带宽度(2.70 eV),简单的合成步骤,价格便宜以及环境友好[1-6],引起人们广泛的关注.然而,有限的可见光吸收率和光生载流子容易复合限制了它的应用.为了促进这种光催化剂发展,科研人员采取多种有效的方法改善它们的光催化活性,例如,合成纳米多孔结构[7],半导体复合[8-10],非金属掺杂[11-12],贵金属沉积[13-14].
g-C3N4与半导体复合形成异质结是提高催化效率的有效方式之一,异质结形成能够缩短电子传输距离,有效提高光催化性能,因此,基于g-C3N4的二元氧化复合物受到广泛关注.ɑ-Fe2O3具有良好的环境兼容性和化学稳定性[15],其禁带宽度(1.9~2.2 eV)可与g-C3N4形成能带匹配的异质结,g-C3N4的导带比α-Fe2O3的导带更负,所以能实现电子的有效传递,同时狭小宽度禁带使得它对可见光敏感.Ye等[16]合成了可磁性分离的α-Fe2O3/g-C3N4纳米催化剂,光催化性能是纯g-C3N4光催化剂的几乎两倍.Theerthagiri等[17]使用α-Fe2O3/g-C3N4来快速降解DR81纺织类污染物.但是,这种传统的异质结结构氧化还原能力较小,不利于产生羟基自由基和超氧自由基,进而影响光催化活性.Chen等[18]合成了一种新型高效三组分Ag@g-C3N4@BiVO4异质结催化剂,BiVO4与g-C3N4之间能带结构的匹配能够引起电子和空穴的分离,通过光沉积法把Ag沉积在BiVO4与g-C3N4上,Ag与BiVO4与g-C3N4协同形成三元复合物结构,显著改善催化剂性能.而且在所有贵金属中,Ag改性环境兼容性好、成本低,笔者希望通过Ag负载构成三元复合材料Ag/α-Fe2O3/g-C3N4,能够使制备出的材料有利于产生羟基自由基和超氧自由基,使得电子空穴的分离时间在二元材料基础上更加长,同时对可见光响应变得更加敏感.
因此基于以上异质结和贵金属沉积方法的优点和缺点,为了更好地提高催化性能,寻找更加简便价廉和绿色环保的合成方法,笔者结合两种改性方法,首先采用溶胶-凝胶法制备不同比例α-Fe2O3复合的α-Fe2O3/g-C3N4复合物,然后采用可见光还原法制备出Ag纳米颗粒沉积的Ag/α-Fe2O3/g-C3N4,合成在常温下进行,方法简单,操作方便,绿色环保.
1 实验部分
1.1 仪器和试剂
XD-2XRD衍射仪,北京普析通用仪器有限公司;TENSOR27型红外光谱分析仪,德国布鲁克;Quanta 600 FEG的场发射扫描电镜,美国FEI;Tecnai G2 F20的透射电镜,美国FEI;TU-1901紫外-可见漫反射吸收光谱(UV-Vis DRS),北京普析通用仪器有限公司; ESCALAB Mark II 型号 X 射线光电子能谱仪,英国 VG.
三聚氰胺和硝酸银购自成都科龙化工试剂厂,均为分析纯;九水硝酸钠和异丙醇购自广东光华科技股份有限公司,均为分析纯;对苯醌购自阿拉丁,分析纯;EDTA购自天津市科密欧化学试剂有限公司,分析纯;罗丹明B(RhB)购自天津市光复精细化工研究所,分析纯.
1.2 实验装置
反应装置所配置的光源是氙灯(500 W),在仪器上相应位置放置滤光片过滤掉紫外光影响(420 nm),然后来测定材料的可见光光催化活性.在催化实验过程中,灯管会产生大量热,通过外循环水来冷却实验装置,以保证实验反应在恒温下进行,250 mL的双层石英套杯催化反应室的反应液面距离光源大约15 cm,水浴磁力搅拌器为搅拌装置,光催化装置如图1所示.
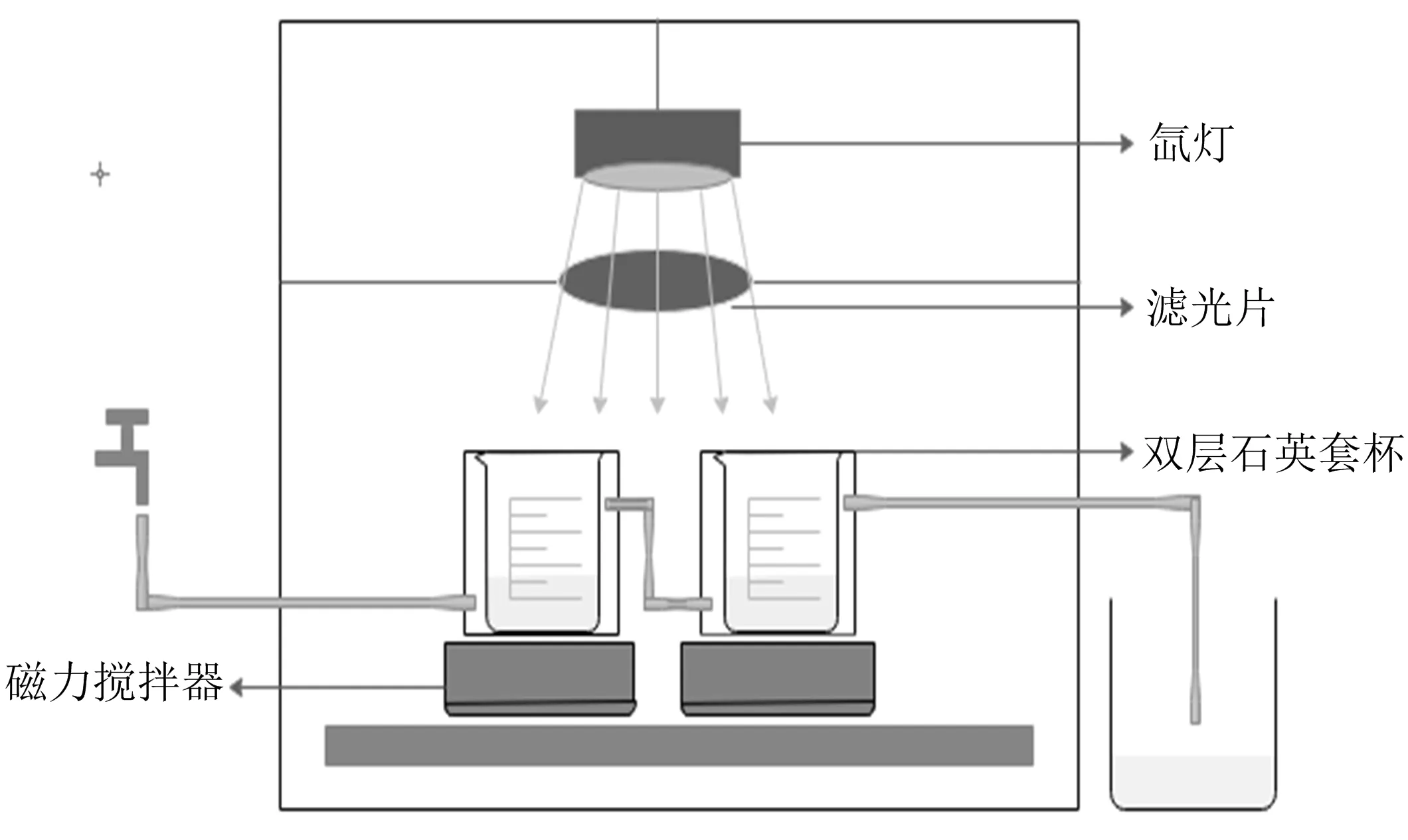
图1 光催化实验装置
1.3 g-C3N4纳米片的制备
称取4 g三聚氰胺加入20 mL的氧化铝坩埚中,包紧锡箔纸,以3 ℃·min-1速率升温至550 ℃,保温4 h,冷却至室温,用研钵充分研磨;然后,再以10 ℃·min-1速度升温到550 ℃,在该温度保温2 h,自然冷却至室温,充分研磨;然后再超声处理6 h,得到g-C3N4.
1.4 α-Fe2O3/g-C3N4的制备
首先将100 mg的g-C3N4分散在10 mL水中,然后分别加入一定量(5.1,15.9,25.6,43.9,56.1 mg)Fe(NO3)·9H2O,在剧烈的搅拌下缓慢滴加(2.7,8.7,14.8,24,31 mL)氨水溶液(滴加速率约为滴/2s),产生氢氧化铁沉淀,然后去离子水洗涤和乙醇交叉洗涤6次,将收集得到的产物放入干燥烘箱缓慢加热到100 ℃,保温4 h,得到产物(1%,3%,5%,8%,10%)α-Fe2O3复合的α-Fe2O3/g-C3N4.
1.5 Ag/α-Fe2O3/g-C3N4的制备
将适量的(0.8,2.4,4.9,8.3,11.9 mg)AgNO3和100 mgα-Fe2O3/g-C3N4分散在30 mL蒸馏水烧杯中,悬浮物在紫外灯照射下搅拌10 min,随后沉淀物用去离子水和乙醇交叉洗涤6次,然后转移到烤箱内80 ℃干燥.合成不同Ag沉积量的Ag/α-Fe2O3/g-C3N4,Ag在复合物中比例分别为0.5%,1.5%,3%,5%,7%.
1.6 光催化降解实验
将50 mg光催化剂投入100 mL 5 mg·L-1的罗丹明B溶液中,光照之前,悬浮液黑暗中磁力搅拌30 min,达到光催化剂和罗丹明B之间吸附解析平衡.光照开始,滤光片过滤掉光源中的紫外部分(λ<420 nm),每隔半小时取7 mL左右的反应溶液,离心(8 000 r·min-1)处理去除催化剂,取上清液,用紫外可见吸光光度计在554 nm处测罗丹明B的吸光度.为了探讨催化剂的稳定性,第1次使用完的催化剂,80 ℃干燥回收,然后在相同的催化条件下,继续光催化实验,经过5次循环,然后测其吸光度.
此外,通过加入1 mmol异丙醇(IPA,·OH)、1 mmol甲醇(CH3OH,h+)、1 mmol对苯醌(BQ,·O2-)探讨光催化剂自由基的捕获实验.光催化剂的浓度用紫外分光光度计测量.
2 结果与讨论
2.1 XRD表征
图2是α-Fe2O3负载量不同的α-Fe2O3/g-C3N4,g-C3N4化合物的XRD图.

图2 α-Fe2O3负载量不同的ɑ-Fe2O3,g-C3N4的XRD
从图2可以看出氮化碳在13.1°和 27.5°有特征峰,与石墨相氮化碳的标准PDF卡片(JCPDS 87-1526)相符,其中在13.1°的峰是单体类物质的特征峰,晶面指数标记为(100),对应的晶面间距为0.690 nm,该峰也代表芳环系统的层间堆垛,是结构中存在较小的倾斜角引起的.另一个峰出现在27.5°,该峰的衍射峰峰强最强,是芳香物的层间堆积特征峰,表明样品具有类石墨的层状结构,晶面指数标记为(002),对应的晶面间距为0.336 nm.同时发现α-Fe2O3的特征峰峰强都比较微弱,可以解释为α-Fe2O3复合量较少导致的.α-Fe2O3/g-C3N4的XRD谱图中,α-Fe2O3特征峰出现在33.2°,35.6°和54.6°,其中33.2°没有出现对应的峰,而35.6°和54.6°出现微弱峰值,基本与α-Fe2O3(JCPDS33-0664)标准卡片相符.以上结果表明,制备的复合材料中同时存在 g-C3N4和α-Fe2O3两种物质,也证明成功制备出了α-Fe2O3/g-C3N4复合材料.
图3是Ag负载量不同的Ag/α-Fe2O3/g-C3N4,α-Fe2O3/g-C3N4,g-C3N4化合物的XRD图.
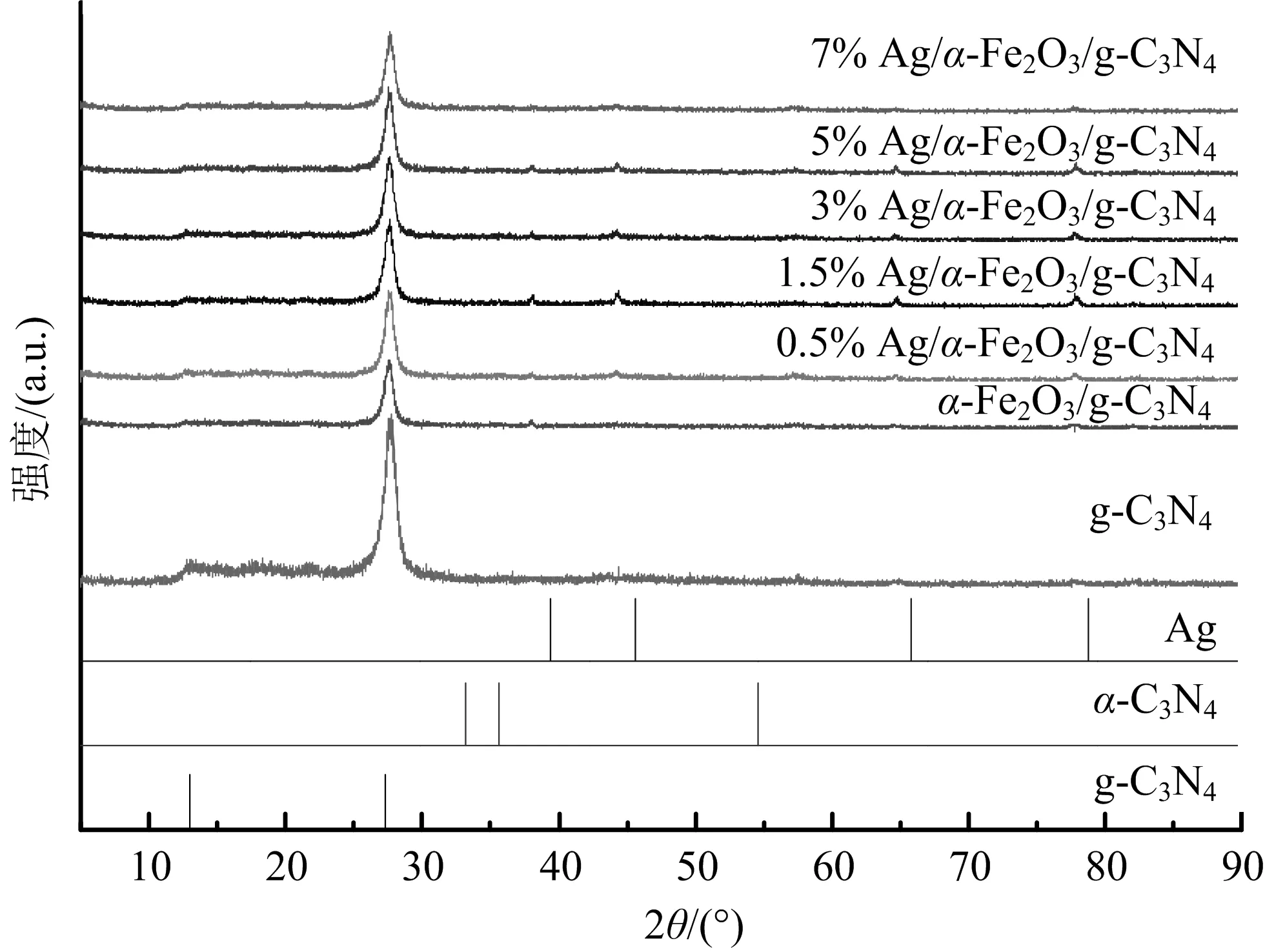
图3 Ag负载量不同的Ag/α-Fe2O3/g-C3N4,α-Fe2O3/g-C3N4,g-C3N4化合物XRD
图3显示,Ag/α-Fe2O3/g-C3N4在2θ=38.0,44.2,64.4,77.4 eV 4个新的衍射峰,分别对应于金属银的(111),(200),(220),(311)晶面(JCPDS04-0783),说明银元素以金属银的形式负载在复合物表面,同时,Ag/α-Fe2O3/g-C3N4在27.39°的特征峰与g-C3N4相比有明显的降低,原因可能是Ag纳米粒子破坏了g-C3N4的堆块结构.由谢乐公式,计算出α-Fe2O3尺寸为30.5 nm,Ag尺寸为13.8 nm.
2.2 SEM和TEM表征
图4(a),(b)分别展示了g-C3N4,Ag/α-Fe2O3/g-C3N4的SEM图,为了进一步考察Ag和α-Fe2O3颗粒在g-C3N4上的分布情况,采用TEM 对样品Ag/α-Fe2O3/g-C3N4进行了表征,结果如图4(c),(d)所示.

图4 样品Ag/α-Fe2O3/g-C3N4的SEM(a,b)和TEM(c,d)
由图4(a)可以看到g-C3N4由小薄片堆叠形成,薄片尺寸大小不一,基本都在几百纳米左右,具有典型的g-C3N4类石墨层状结构,同时在薄片中有孔洞出现.由图4(b)可以看出棒状结构的α-Fe2O3穿插在g-C3N4的结构中,很好地与氮化碳结合.而且,可以清楚地看到Ag分散在棒状结构和石墨相氮化碳上.图4(c),(d)显示,Ag颗粒均匀地分布在α-Fe2O3/g-C3N4的表面上,而且α-Fe2O3和g-C3N4很好地结合在一起,形成异质结催化剂,有利于电子的传输和催化剂活性的改善.
2.3 FT-IR表征
图5展示了g-C3N4,α-Fe2O3/g-C3N4,Ag/α-Fe2O3/g-C3N4几个主要的吸收区域.

图5 g-C3N4,α-Fe2O3/g-C3N4,Ag/α-Fe2O3/g-C3N4的FT-IR
由图5可知,g-C3N4,α-Fe2O3/g-C3N4,Ag/α-Fe2O3/g-C3N4样品的IR谱图在800 cm-1处峰值为g-C3N4单元三嗪环的CN杂环的弯曲振动特征吸收峰[19];而在1 200~1 600 cm-1处出现了g-C3N4的CN杂环的C—N和C=N键的伸缩振动特征峰;3 200 cm-1左右的吸收峰则是g-C3N4边缘的N—H和样品表面吸附的水分子的O—H键的伸缩振动特征峰[20-21].α-Fe2O3/g-C3N4复合物的峰强和纯g-C3N4基本保持一致,但在1 200~1 600 cm-1处的碳氮特征峰有所减弱,这表明α-Fe2O3与g-C3N4之间不仅是简单物理吸附,而是形成了异质结结构.这与TEM表征结果一致,这种界面关系有可能成为一种电子转移路径,促进电子空穴的有效分离,提高复合材料光催化活性,进一步证实了α-Fe2O3/g-C3N4复合材料的结构,与XRD,SEM,TEM结果相符.
2.4 UV-Vis DRS
光催化剂的光催化性能与材料光吸收能力有很大的关系,图6展示了g-C3N4,α-Fe2O3/g-C3N4,Ag/α-Fe2O3/g-C3N4的光吸收能力.
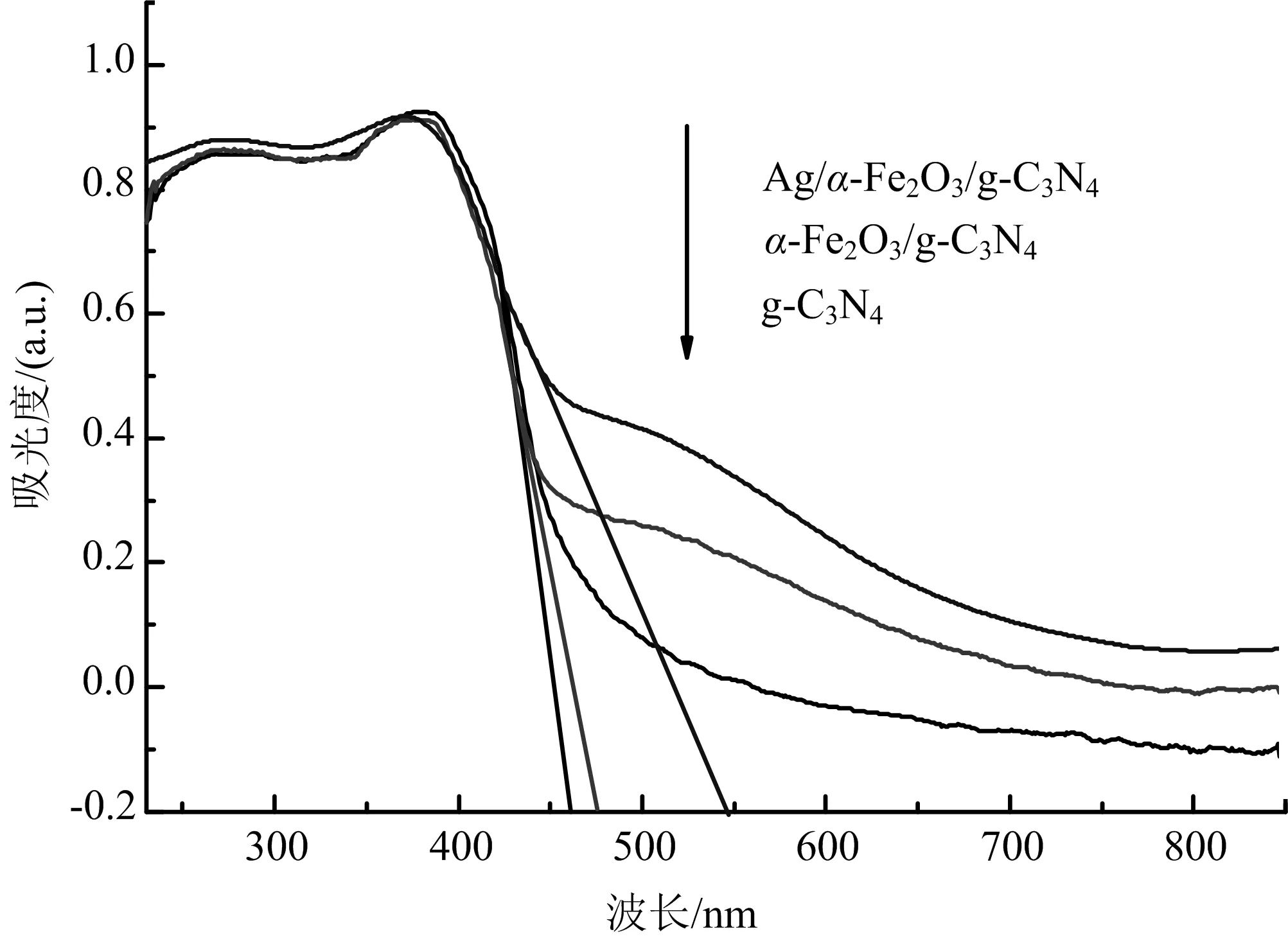
图6 g-C3N4,α-Fe2O3/g-C3N4,Ag/α-Fe2O3/g-C3N4复合催化剂的UV-Vis漫反射谱
从图6可以看出,g-C3N4的吸收峰在450 nm左右;α-Fe2O3/g-C3N4光的吸收性能高于g-C3N4,而且复合α-Fe2O3后,α-Fe2O3/g-C3N4样品的最大吸收带边由g-C3N4的450 nm“红移”至478 nm,光响应范围增大,光吸收处于可见光范围内.由公式Eg(eV)=1 240/λ,λ为样品的吸收带边波长(nm),用光还原法在α-Fe2O3/g-C3N4上沉积Ag后,Ag的局域表面等离子体共振效应显著提高了α-Fe2O3/g-C3N4对可见光的吸收能力,3%Ag/α-Fe2O3/g-C3N4的最大吸收带边在此基础上又明显红移,计算得出带隙宽度2.3 eV.既已知带隙Eg值,可根据下列公式计算催化剂材料的价带(VB)和导带(CB)值
ECB=χ-Ee-0.5Eg,
(1)
EVB=ECB+Eg,
(2)
其中:EVB和ECB分别为价带和导带带边电势值;根据计算得出 g-C3N4的电负性为4.55.Ee为氢标电极电势,约为4.5 eV,Eg为半导体带隙值.计算结果列于表1.
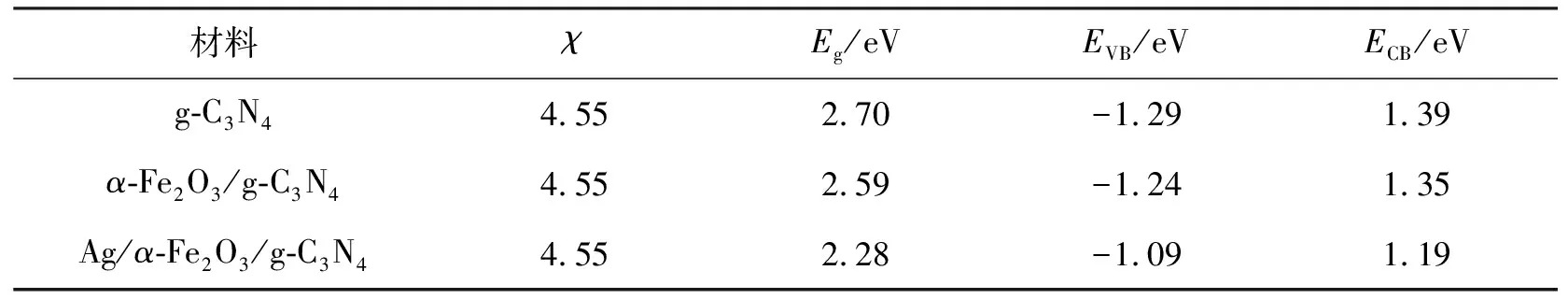
表1 g-C3N4材料导带、价带电势的计算结果
从表 1可以清晰地观察到g-C3N4,α-Fe2O3/g-C3N4,Ag/α-Fe2O3/g-C3N4半导体本征结构,复合α-Fe2O3和Ag光沉积的g-C3N4材料相对于g-C3N4价带位置均有一定上升,导带位置均有一定下降,带隙宽度明显减小,可见光响应从478 nm红移至540 nm,有助于光生载流子形成,最终提高了样品的可见光催化性能.综上所述,笔者所制备的α-Fe2O3/g-C3N4,Ag/α-Fe2O3/g-C3N4复合材料在可见光波段内几乎都有光吸收,无论是光响应范围还是强度都有很大程度提高,适当的沉积Ag会增强可见光的吸收,同时在光催化反应中会产生更多的光生电子和空穴,从而展现出更强的光催化活性.
2.5 XPS
通过XPS测试,可以获得化合物Ag/α-Fe2O3/g-C3N4化学组成和化合物中各种物质价态,图7(a)显示了化合物的XPS扫描谱,图7(b)~(f)是C1s,N1s,O1s,Fe2p,Ag3d的高分辨率谱.
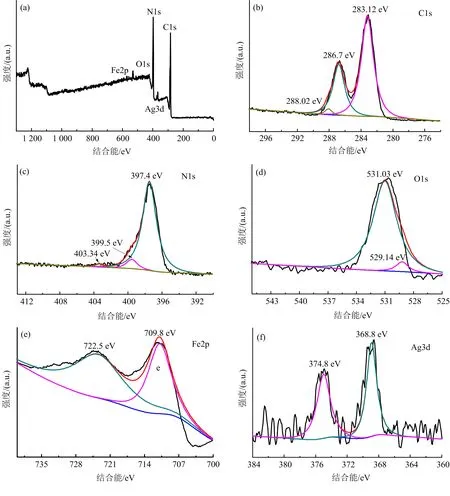
图7 Ag/ɑ-Fe2O3/g-C3N4样品XPS全谱图(a)及其C ls(b),N ls(c),Fe2p(d),Ag3d(e)高分辨XPS
由图7(a)可以看出,C,N,Fe,O,Ag元素都存在,表明Ag/α-Fe2O3/g-C3N4可能合成.图7(b)中283.13,286.88,288.02 eV处的峰分别对应于C—C,C=N,C=O sp2杂化C原子,可以归因于存在于石墨中的含有缺陷的sp2杂化碳原子和CN矩阵中的纯石墨位点.图7(c)的N1s的XPS谱图显示了N1s在397.4,399.5,403.03 eV的结合能.图7(d)显示的结合能为529.14 eV和531.03 eV,其中531.03 eV对应于C=N 中sp2杂化N原子、C-[N]3和C-NHX中sp3杂化N原子,529.14 eV对应于C=O中的sp2杂化O.图7(e)是Fe2p的峰在709.8 eV和722.5 eV,分别对应Fe2p3/2和Fe2p1/2,在纯α-Fe2O3的Fe2p结合能分别为710.3, 723.7 eV[22],Fe2p移动到更低能量可能是由于Fe—N键的形成,由于N的电负性大于氧的电负性,从而增强了Fe的电子密度,说明了两个化合物之间的化学键形成代替了物理混合[23].图7(f)是Ag3d峰在367.28 eV和373.21 eV有两个特征峰,对应于Ag5/2和Ag3/2的结合能,这俩峰都归因于金属Ag.
2.6 光催化活性及机制
图8是没有添加g-C3N4以及不同α-Fe2O3掺杂量的α-Fe2O3/g-C3N4样品降解罗丹明B效果.样品的降解效率用c/c0来定义,c和c0分别代表剩余和初始罗丹明B的浓度.
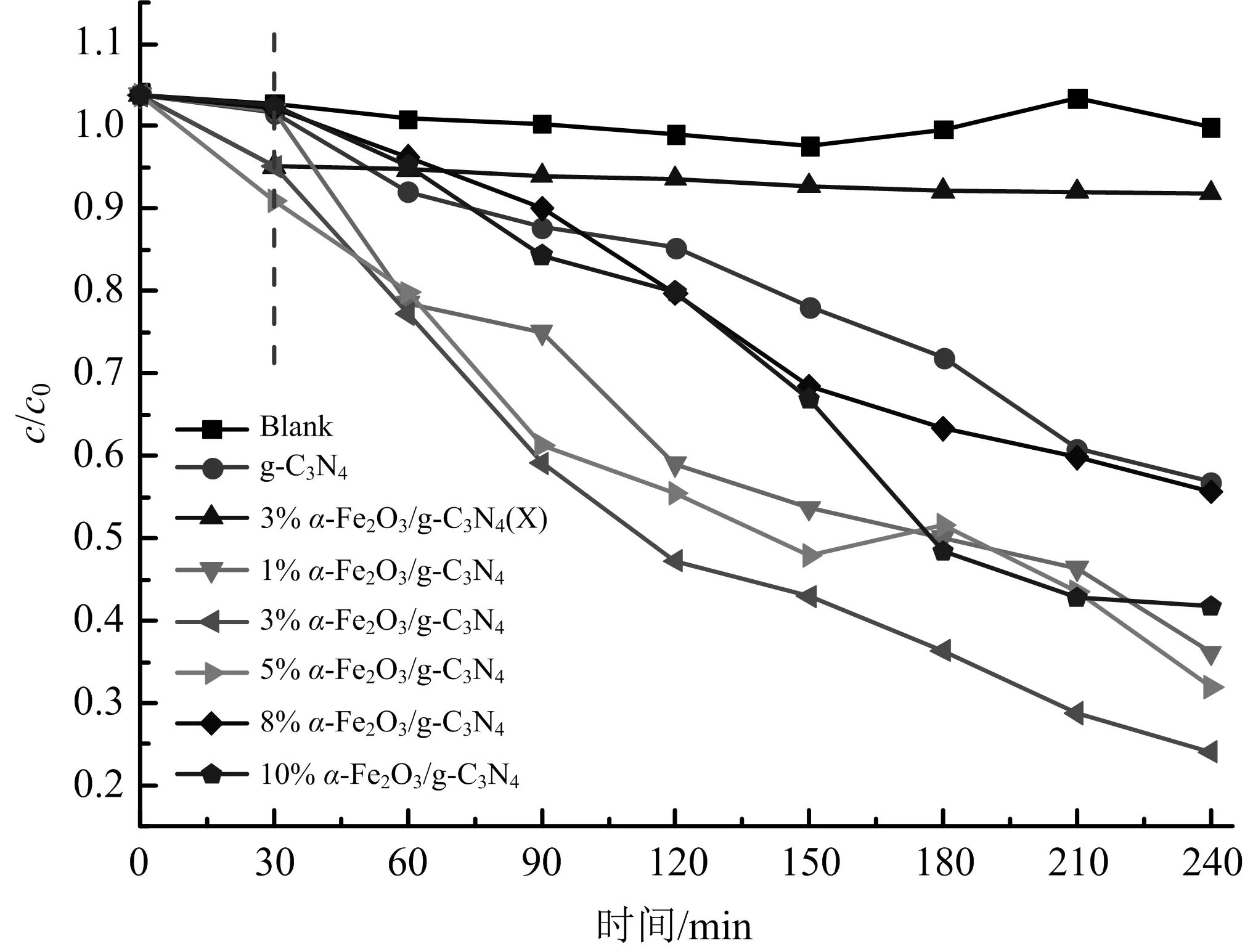
图8 复合不同量α-Fe2O3的g-C3N4光催化降解罗丹明B的效果
由图8中的对比可以看出,罗丹明B在可见光下降解很慢,g-C3N4光催化剂存在下其降解可以达到50%,而复合α-Fe2O3后光催化性能都有所提高,随着复合α-Fe2O3量的增加,催化降解率不断提高,3%ɑ-Fe2O3/g-C3N4光催化性能可以达到79.7%,但是负荷量继续增加后,催化性能明显下降.
图9为没有添加催化剂、g-C3N4、3%α-Fe2O3/g-C3N4以及不同Ag含量沉积Ag/α-Fe2O3/g-C3N4样品降解罗丹明B的效果.
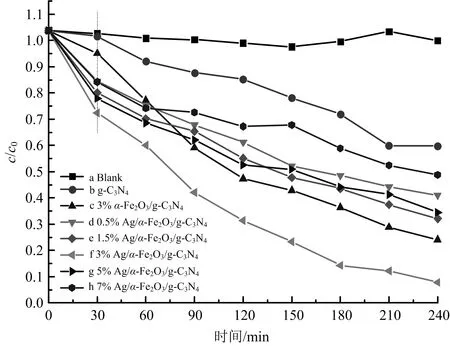
图9 没有添加催化剂以及g-C3N4、3%α-Fe2O3/g-C3N4和不同Ag含量沉积Ag/α-Fe2O3 /g-C3N4样品存在下光催化降解罗丹明B的效果
由图9中的对比可以看出,罗丹明B在可见光下降解很慢,g-C3N4光催化剂存在下其降解可以达到50%,而3%α-Fe2O3/g-C3N4存在下可以达到79.7%,即存在光催化剂时降解变快,这个结果说明罗丹明B很稳定,在自然条件下很难降解.3%Ag/α-Fe2O3/g-C3N4光催化剂催化3.5 h,降解罗丹明B达95%,当Ag的负载量达到7%时,光催化降解罗丹明B的量比g-C3N4减少了,这可能是额外负载的Ag降低催化剂的降解性能.

图10 3%Ag/α-Fe2O3/g-C3N 4降解罗丹明B溶液的紫外-可见吸光度一波长曲线
图10显示的是催化剂对污染物降解矿化能力的反应状况.由图10可以看出,经过300 min的光催化降解后,罗丹明B溶液的颜色由粉红色逐渐褪为近乎无色,其最大吸收波长从原先的554 nm移到了525 nm,而且样品的最大吸收峰的强度逐渐减小.根据研究分析,此过程是罗丹明B首先逐步脱去乙基,然后发生破环矿化的过程[24],表明Ag/α-Fe2O3/g-C3N4复合光催化剂具有较强的降解能力.
2.7 捕获实验及光催化机制
(1) 捕获实验
为了探讨光催化过程中的活性物质,IPA,EDTA,BQ被分别作为(OH),(h+),(O2-)捕获剂去研究活性物质对光催化降解罗丹明B的影响,结果如图11所示.

图11 不同捕获剂对3%Ag/α-Fe2O3/g-C3N4催化活性的影响
图11显示,BQ在降解罗丹明B时产生了明显的抑制,而IPA和EDTA在罗丹明B降解过程中产生了轻微抑制.在催化降解罗丹明B过程中影响效果由大到小的活性物质为OH>O2-> h+.
(2) 光催化机制
由以上计算数据结果可知,g-C3N4价带和导带分别为-1.13 eV和1.57 eV.若Ag/α-Fe2O3/g-C3N4为传统异质结构,g-C3N4的导带电子会通过Ag转移到α-Fe2O3导带上,而空穴从α-Fe2O3价带上转移到g-C3N4价带上,无法将吸附在光催化剂上的O2和水分别还原和氧化为O2-和·OH,而是主要依靠h+氧化罗丹明B达到降解污染物的效果.由捕获实验数据可知Ag/α-Fe2O3/g-C3N4三元光催化体系的主要活性物质依次为OH>O2-> h+,因此,Ag/α-Fe2O3/g-C3N4并不是传统的异质结构,而是形成Z型异质结构.在可见光照射下,一方面由于金属Ag表面具有较高的肖特基势垒,α-Fe2O3的导带比Ag的更负,电子从α-Fe2O3的ECB转移到Ag上,另一方面,g-C3N4的价带比Ag更正,光生空穴转移到Ag上,电子和空穴在Ag上复合.在这种情况下,由于 g-C3N4的ECB比O2/O2-电势更负(约-0.33 eV),g-C3N4的ECB中的光生电子可以还原吸附O2产生O2-(式(3)),O2-进一步与H+发生反应生成OH(式(4)),α-Fe2O3的EVB的电位比OH/OH-电位更正,α-Fe2O3的EVB中的光生空穴可以与H2O反应形成羟基自由基(OH)(式(5)).这样形成的活性基团h+,O2-,OH可以进一步有效地降解目标污染物,转化为更小的中间体或直接进入最终产物(二氧化碳和水).总之,金属银在电荷分离和转移中心起着主要作用,从而形成Z型异质结的Ag/α-Fe2O3/g-C3N4光催化剂,使得光催化性能优于α-Fe2O3/g-C3N4和g-C3N4.
O2+eCB-→O2-,
(3)
(4)
OH-+hVB+→OH.
(5)

图12 Ag/α-Fe2O3/g-C3N4复合物在可见光下光生载流子转移和降解罗丹明B
3 结束语
笔者通过简单以及价格低廉的合成方法在室温下合成高效的、可见光响应的光催化剂Ag/α-Fe2O3/g-C3N4,光催化实验表明复合催化剂Ag/α-Fe2O3/g-C3N4与g-C3N4和α-Fe2O3/g-C3N4相比,Ag/α-Fe2O3/g-C3N4对可见光的响应范围发生明显红移,光催化降解罗丹明B的效率得到了很大提高.通过结构和性能表征,Ag/α-Fe2O3/g-C3N4复合物优异的光催化性能取决于:(1)高的表面区域对染料的吸附;(2)g-C3N4纳米颗粒对电子和空穴捕获转移形成Z型机制,ɑ-Fe2O3价带空穴发生氧化反应形成OH,g-C3N4导带电子发生还原反应形成O2-,活性基团是光催化活性增强的主要原因;(3)Ag以及Ag纳米颗粒的等离子体共振效应.相比于g-C3N4和其他复合物,Ag/ɑ-Fe2O3/g-C3N4产生更强的光电流和高效的光生载流子的转移.同时磁铁吸引实验说明α-Fe2O3/g-C3N4,Ag/ɑ-Fe2O3/g-C3N4都没有磁性,不能实现磁性回收催化剂的功能.基于以上结果,Ag和α-Fe2O3和g-C3N4发生相互作用,合成的光催化性能优于传统异质结的Z型机制.因此,Ag/α-Fe2O3/g-C3N4是一个能高效利用可见光和高效降解环境中污染物的催化剂.
