青虾源维氏气单胞菌双重PCR检测方法的建立
2020-01-15刘晓丹肖自东李席席周一凡张晓君
刘晓丹,肖自东,孙 威,李席席,周一凡,张晓君
(扬州大学动物科学与技术学院,江苏扬州 225009)

维氏气单胞菌的检测以往主要采用形态分类、生理生化分析等方法,这些方法不仅较为繁琐,而且对血清型复杂、生化特征不稳定的病原菌容易误判。而分子生物学检测技术的发展为病微生物快速检测提供了新的技术方案,PCR技术具有快捷、准确等优点,已大量应用于病原菌检测。其中最为常见的是16S rRNA基因序列的常规PCR检测,虽然其最低可检测pg/μL级别的基因组DNA,但16S rRNA 序列对原核生物具有高度保守性,较难区分亲缘关系较近的细菌,存在漏检和假阳性的可能性,相比之下,双重PCR检测因其特异性更强,灵敏度更高,广泛应用于细菌检测[17-18]。
青虾,学名日本沼虾(Macrobrachiumnipponense)。在中国、日本、朝鲜半岛以及东南亚都有着广泛分布,具有生长速度快,繁殖能力强,经济价值高等特点。近年来青虾养殖面积及其产量稳步提高,但在青虾养殖产业发展过程中一直遇到病原微生物感染的难题,影响其健康养殖以及水产品的安全。其中维氏气单胞菌是引起青虾病害的主要致病菌之一[14],快速、准确地检测青虾源维氏气单胞菌对该菌引起的青虾病害对疾病的预防、治疗以及水产品安全性显得尤为重要。本试验利用分子生物学检测方法,根据NCBI已发表的维氏气单胞菌CB51菌株基因组序列、促旋酶B亚单位基因gyrB和编码细菌RNA聚合酶σ70因子基因rpoD的保守序列设计引物,设定合适的反应体系及反应条件,建立了一种青虾源维氏气单胞菌的双重PCR快速检测方法,为青虾源维氏气单胞菌感染的临床诊断、疾病治疗、调查研究等提供重要参考资料。
1 材料与方法
1.1 菌株来源
试验用维氏气单胞菌Y3-1菌株由本试验室从发病青虾中分离鉴定。嗜水气单胞菌(A.hydrophila)G3菌株、弗氏柠檬酸杆菌(C.freundii)LJ-1菌株、哈维弧菌(V.havveyi)DY-1菌株、 副溶血性弧菌(V.parahemolyticus)LNX-2菌株、需钠弧菌(V.natriegens)XA-1菌株、非O1霍乱弧菌(non-O1V.cholerae)GXFL1-4菌株、阴沟肠杆菌(E.cloacae)XL3-1菌株、产气肠杆菌(E.aerogenes)WF1-1菌株均由本试验室保存。
1.2 主要试剂
细菌DNA提取试剂盒、GelStain(全式金产品);琼脂糖(Biowest Agarose);营养肉汤培养基、营养琼脂培养基(青岛海博公司生产);Premix Taq(Takara Taq Version 2.0 plus dye)、DL2000 DNA Marker(Takara生物公司生产)。
1.3 引物设计与合成
根据NCBI已报道的维氏气单胞菌CB51菌株(NZ_CP015448.1)的gyrB和rpoD基因,通过Primer primer 5.0软件设计引物序列,利用细菌16S rRNA基因通用引物进行普通PCR检测,序列及扩增片段长度见表1。引物由南京擎科生物公司合成,-20 ℃保存备用。
1.4 模板DNA制备
将分离菌株在琼脂培养基上划线隔夜培养,挑取单菌落,接种于液体培养基中,28 ℃,180 r/min震荡培养16 h,细菌DNA的获得参照试剂盒所述方法提取,以此为检测模板,-20 ℃保存。
1.5 分离菌的鉴定
为了鉴定分离菌株Y3-1,以分离菌的DNA作为模板,16S rRNA的通用引物为扩增引物(表1)。试验使用20 μL体系,其中2×Premix Taq 10 μL,DNA模板1 μL,上下游引物各1 μL,ddH2O 7 μL。PCR反应条件:94 ℃ 5 min的预变性;94 ℃ 变性30 s,55 ℃ 退火30 s,72 ℃ 延伸90 s,循环35次;最后72 ℃延伸7 min。PCR反应完成后用1% 琼脂糖凝胶进行电泳分析,将扩增产物送南京擎科生物公司进行测序,测序后所得到的16S rRNA基因序列利用BLAST进行同源性分析。
同时,将分离菌分别接种于细菌理化特性鉴定用生化管中,测定分离菌理化特性,并对照《Bergey’s Manual of Systematic Bacteriology》[19]对分离菌进行种属判定。
1.6 双重PCR检测方法的建立
以双重PCR的两对引物对模板进行扩增,通过比较不同引物浓度、退火温度及反应体系下PCR的扩增结果,优化维氏气单胞菌双重PCR最佳反应体系。最佳反应体系为20 μL,其中DNA模板1 μL、 Premix Taq 10 μL、ddH2O 7 μL、 gyrB-F、R(10 μmol/L)各0.5 μL,rpoD-F、R(10 μmol/L )各0.5 μL;同时用ddH2O设置阴性对照。最佳反应条件:94 ℃ 5 min,94 ℃ 30 s、60 ℃ 30 s、72 ℃ 40 s、35循环;72 ℃ 7 min,4 ℃保存。配置1.0%TAE缓冲液和1.0 % 凝胶,PCR产物5 μL,DL2000 Marker 5 μL,电泳110 V,35 min。
1.7 双重PCR扩增的特异性
以菌株维氏气单胞菌Y3-1、哈维弧菌DY-1、弗氏柠檬酸杆菌LJ-1、副溶血性弧菌LNX-2、需钠弧菌XA-1、霍乱弧菌GXFL1-4、阴沟肠杆菌XL3-1、产气肠杆菌WF1-1、嗜水气单胞菌样品G3菌株的DNA为检测模板,同时设置ddH2O作为模板的阴性对照组,按照1.6中建立的反应条件进行双重PCR扩增,检测其特异性。
1.8 双重PCR扩增的灵敏性
将上述试验制备的维氏气单胞菌(A.veronii)Y3-1 DNA模板,分光光度计测定浓度后,用灭菌的去离子水进行10倍倍比(10-1,10-2,10-3,10-4,10-5,10-6,10-7)稀释,以该稀释液作为PCR模板,按上述建立的反应条件进行双重PCR扩增。扩增完成后,取5 μL扩增产物进行凝胶电泳,记录结果。
1.9 送检样品的检测
对10份疑似维氏气单胞菌(A.veronii) Y3-1感染的青虾幼虾送检样本,用无菌的生理盐水对虾体表进行多次冲洗,将幼虾体表面细菌冲洗干净,再用75%的酒精棉球对青虾幼体体表进行消毒。在无菌操作台内,将虾体制备成匀浆液,划线接种于LB固体培养基,28 ℃恒温培养24 h。挑取优势单菌落移接于普通LB培养基斜面上,28 ℃恒温培养24 h,获得纯培养的细菌。之后将其接种到LB液体培养基中28 ℃,180 r/min,16 h扩大培养。取1 mL菌液,用试剂盒提取细菌DNA,以此为双重PCR模板,用上述所建立的检测方法,对送检样品分离的细菌DNA进行检测。同时按照常规鉴定方法如生理生化及PCR检测,对所分离细菌鉴定,以检验双重PCR检测方法的可靠性。
2 试验结果
2.1 分离菌鉴定结果
在NCBI将分离菌Y3-1所扩增的16S rRNA序列进行Blast,其序列与多株维氏气单胞菌的相似性为100%,表明Y3-1与维氏气单胞菌的亲缘关系非常近。分离菌的主要理化特性(表2)与《Bergey’s Manual of Systematic Bacteriology》[19]中标准菌株维氏气单胞菌的理化特性相符。因此,综合理化特性以及分子鉴定结果,菌株Y3-1为维氏气单胞菌。

表2 分离菌理化特性Tab.2 Physiological and biochemical characteristics of the isolates
注:“+”示阳性,“-”示阴性,上标*表示数据来自文献[19]
2.2 双重 PCR 反应结果
将维氏气单胞菌(A.veronii)Y3-1分离培养后,提取DNA,以此为PCR模板,利用设计的gyrB,rpoD两对引物进行PCR扩增。成像结果表明,建立的双重PCR检测方法扩增出了两条特异性带,大小分别为815 bp、554 bp,ddH2O对照组未扩增条带,呈阴性(图1)。

图1 维氏气单胞菌双重PCR检测Fig.1 Duplex PCR detection for A.veronii
CK:对照组;M:DL2000 DNA Marker;1:rpoD;2:gyrB;3:rpoD和gyrB
2.3 双重PCR扩增的特异性结果
利用建立的维氏气单胞菌双重PCR检测方法对维氏气单胞菌Y3-1菌株DNA以及8份不同样品菌株DNA进行检测。结果显示,维氏气单胞菌Y3-1扩增出了两条目的条带,大小分别为815 bp、554 bp,呈阳性;其它菌株DNA以及ddH2O未扩增出特异性条带(图2)。

图2 维氏气单胞菌双重PCR特异性检测Fig.2 Duplex PCR specificity of detection for A.veroniiM:DL2000 DNA Marker;1:维氏气单胞菌Y3-1;2:哈维弧菌DY-1;3:嗜水气单胞菌G3;4:副溶血性弧菌LNX-2;5:需钠弧菌XA-1;6:霍乱弧菌GXFL1-4;7:阴沟肠杆菌XL3-1;8:产气肠杆菌WF1-1;9:弗氏柠檬酸杆菌LJ-1;10:ddH2O。
2.4 双重 PCR 扩增的灵敏性结果
灵敏性检测结果显示,在1.8×10-2ng/μL 时仍能检测到gyrB和rpoD的目的条带,在1.8×10-3ng/μL 时只能检测gyrB的目的条带,所以该方法的灵敏度可达1.8×10-2ng/μL,灵敏度良好(见图3)。

图3 维氏气单胞菌双重PCR灵敏度检测Fig.3 The sensitivity detection of duplex PCR for A.veroniiM:DL 2000 DNA Maker;1-8:1.8 ng/μL-1.8×10-7 ng/μL
2.5 送检样品双重PCR检测结果
应用建立的双重PCR方法检测送检样品,结果检出阳性9份,1份样本和对照组呈阴性(图4),检测结果与生理生化、分子生物学鉴定的结果相符合。表明本试验方法准确性高,适用于临床检测。
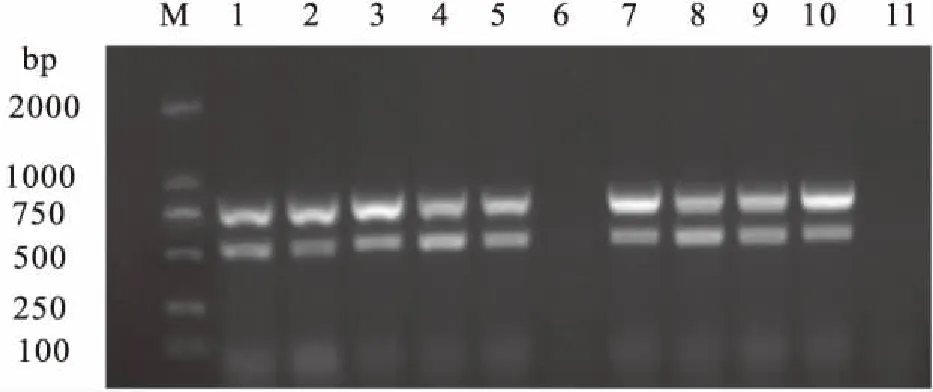
图4 送检样品及阴性对照双重PCR检测结果Fig.4 Results of detection by duplex PCR for A.veroniiM:DL 2000 DNA Maker;1-10:送检样品;11:ddH2O
3 讨论
潘晓艺等[20]、边宇等[21]选择16S rRNA和气溶素(Aer)基因运用于维氏气单胞菌的快速检测,这两种检测方法的灵敏度分别为1.35×10-3ng/μL 和1.58×10-3ng/μL,本实验建立的双重PCR检测方法最低检测的基因组DNA浓度为1.8×10-2ng/μL,从灵敏度的角度,选择维氏气单胞菌16S rRNA和气溶素(Aer)基因建立的双重PCR检测方法能够检测出更低浓度的模板。但是该检测方法的检测范围只局限于携带气溶素(Aer)基因的维氏气单胞菌菌株,对于非致病菌株以及未携Aer基因的菌株检测效果不佳。且有调查显示,不同来源的维氏气单胞菌菌株毒力基因气溶素携带率为93.8%[22],毒力基因携带情况不同,致病性也会有较大差异[23],因此选用气溶素等毒力基因作为PCR检测对象不利于维氏气单胞菌的流行病学调查。gyrB基因是编码促旋酶B亚单位基因,该基因具有较高的碱基替换率,在气单胞菌种间碱基最大差异为15.2 %,分辨率高,更适合亲缘关系近的细菌鉴定[19,24]。朱成科等[25]利用gyrB基因和黏附素基因(Aha)建立了黄颡鱼源维氏气单胞菌双重PCR检测方法,该检测方法对于维氏气单胞菌标准菌株ATCC35624及黄颡鱼源分离菌株具有很好的检测效果,细菌黏附素是细菌表面的一些大分子物质,和细菌粘附密切相关,但鉴于细菌黏附素有很多种,因此并不是细菌分类鉴定的优选基因。rpoD 是编码细菌RNA聚合酶σ70因子基因,能够对大部分气单胞菌进行准确而一致的区分[26],广泛应用于气单胞菌属的单基因分型[27]。管家基因gyrB和rpoD因其较保守,且具有一定变异的可能,通过分析其序列可以更好地区别同属不同种[28]。因此本研究将gyrB和rpoD基因结合起来分析,分别设计了一对特异性引物,采用双重PCR方法,以提高检测准确率。对青虾源维氏气单胞菌Y3-1扩增出两条大小分别为851 bp (gyrB)和554 bp(rpoD)的特异性条带(图1),而对嗜水气单胞菌等常见水产动物病原菌检测无交叉反应,表明本试验建立的双重PCR方法特异性良好(图2),且该检测方法对DNA模板的最低检测浓度为1.8×10-2ng/μL,也显示出较好的灵敏性(图3),其临床样品检测结果与生理生化鉴定结果保持一致(图4),表明本研究建立的双重PCR检测方法适用于青虾源维氏气单胞菌的检测。
试验建立的青虾致病株维氏气单胞菌双重PCR检测方法,具有灵敏性较高、特异性较强等特点,能够快速、准确地检测出青虾源维氏气单胞菌。
