可变剪切在植物发育和非生物胁迫响应中的作用
2020-01-15冯雅岚原佳乐蔡艾杉
冯雅岚 熊 瑛 张 均 原佳乐 蔡艾杉 马 超
(河南科技大学农学院/河南省旱地农业工程技术研究中心,河南洛阳 471023)
真核生物体中,单个基因的前体mRNA(premRNA)可通过不同的剪切位点加工产生多个成熟mRNA亚型,这一过程称为可变剪切(alternative splicing,AS)[1]。pre-mRNA的AS是真核生物中普遍存在的现象,这一复杂过程是由100~200个蛋白亚基组成的剪切体完成的,通过AS可以产生多种功能相似或完全不同的转录本亚型,不仅对基因表达的转录后调控十分重要,而且极大地增加了转录组和蛋白质组的复杂性[2]。研究表明,AS在植物体生长和发育过程均具有重要作用,如诱导开花[3]、响应非生物胁迫等[2,4-5],表明增强的转录组和蛋白质组的多样性是植物应对生长发育和环境适应所必需的。随着高通量测序技术的不断发展,在高等植物体内所发现的AS数量远超过预期,说明AS在植物体内的作用和意义仍有待于进一步探索。
1 AS的分子机理及作用模式
1.1 AS的分子机理
大多数真核生物基因是由外显子和内含子组成,其转录后的pre-mRNA需要经过一系列转录后修饰,才能形成成熟的mRNA,即内含子被去除,外显子连接在一起[6]。去除内含子是真核基因表达的关键步骤[7]。而AS则是通过识别pre-mRNA中不同的剪切位点,以产生结构和功能不同的mRNA以及蛋白质变体的过程,是调节基因表达的重要机制[8]。这种转录后修饰极大地增强了转录组和蛋白质组的复杂性[2]。如人体中约95%的蛋白质编码基因的pre-mRNA均经历AS并产生成熟的mRNAs[9-10],拟南芥(Arabidopsis thaliana)[11]和水稻(Oryza sativa)[12]中分别有超过60%和48%的pre-mRNA发生AS。
内含子去除是由大分子复合物,即剪切体催化完成的,剪切体的核心部分由5个小核核糖蛋白颗粒(small nuclear ribonucleoprotein particles,snRNPs)(U1、U2、U4、U5和U6)和数百种对识别剪切位点至关重要的蛋白质组成,这些蛋白质以精确的顺序聚集在内含子上[13-14]。剪切位点的选择不仅取决于核心剪切体组件,很大程度上还取决于一些RNA结合蛋白,如富含丝氨酸/精氨酸(serine/arginine-rich,SR)的蛋白质和不均一核糖核蛋白(heterogeneous nuclear ribonucleoproteins,hnRNPs),这2类蛋白分别结合于外显子和内含子的识别位点,从而激活或抑制剪切[15]。SR蛋白家族成员具有1个模式结构,即N-末端结构域,其包含 1~2个 RNA识别序列(RNA recognition motif,RRM),C-末端包含1个丝氨酸/精氨酸(serine/arginine-rich,RS)结构域[16]。这2个不同的结构域具有不同的功能,RRM结构域主要与RNA靶标结合,而RS结构域主要参与蛋白-蛋白互作,将核心剪切体组分招募到附近的剪切位点[15]。hnRNPs含有1个主要的RRM结构域和一些辅助结构域,如富含甘氨酸的序列和精氨酸-甘氨酸-甘氨酸盒。hnRNP通过识别内含子的沉默序列从而抑制内含子剪切,即内含子保留的AS模式[17]。
1.2 AS的模式
AS在真核细胞中普遍存在,几乎所有的多外显子基因都可发生AS,当剪切体识别到不同的剪切位点时,就会出现AS,且有可能产生多种蛋白质,极大地提高了基因组的编码能力[4]。目前已知4种主要的AS模式:外显子跳跃、内含子保留以及5′端 AS和3′端AS,不同的剪切模式产生不同的结果:盒式外显子、保留的内含子以及可变的5′端剪切和3′端剪切[4](图1)。这些AS模式在不同的物种中发生的频率并不相同,内含子保留是植物中最常见的AS模式,而外显子跳跃在动物中占优势[18](表1)。

表1 AS不同模式在人和拟南芥中发生的频率[2]Table 1 Frequency of different pattern of AS in humans and Arabidopsis[2] /%
这些不同频率的AS模式对AS的具体功能有明确的影响。事实上,外显子跳跃、5′端和3′端AS更容易产生功能变化的蛋白质,如改变氨基酸或C-末端,在框架内添加或去除功能单位,都可能对蛋白产物的亚细胞定位、结合性质、活性或稳定性产生影响[19-21]。大多数内含子保留模式则会在转录本内插入提前终止密码子(premature termination codon,PTC)[22],导致mRNA命运存在差异。如果这个密码子位于外显子-外显子连接区上游(超过50个核苷酸处),则该转录本将通过无义介导的衰变(nonsense-mediated decay,NMD)被降解,这是一种被认为阻止截短和潜在有害蛋白质积累的mRNA调控机制[23],AS和NMD均是真核生物中转录本数量的调控机制。具有 PTC的mRNA可被翻译成截短的蛋白质,其通常缺乏全长蛋白质所具有的一些活性结构域。此外,截短的蛋白质本身在某些生物进程中可能同样具有抵抗生物胁迫的功能[24-25]。
2 AS在植物发育中的作用
2.1 开花诱导
成花标志着植物从营养生长向生殖生长转变,这一变化过程不仅受到内部发育信号的调控,同时还受到外部环境信号的制约,如日照长短、温度、春化需求等[26]。春化是指冬季一年生植物在开花前必须经历一段时间的低温方可开花[27],拟南芥中主要的开花调控基因位点FLOWERING LOCUS C(FLC)是开花的重要抑制因子,属于MADS-box转录因子家族,其表达状态直接影响着拟南芥的春化需求,而春化后植株中的FLC表达下调[28]。MADS ASSOCIATED FLOWERING1(MAF1)/FLOWERING LOCUS M(FLM)和MAF2是FLC的同源基因,其中MAF2参与识别短期的低温,以避免植物在不适宜的温度下提早开花[29]。短期低温处理导致MAF2经历AS,且var1亚型转录本大量积累,推测其编码1个抑制开花的全长蛋白,而var2亚型的丰度则降低,推测其编码1个截短的MAF2蛋白,但包含PTC的var2亚型功能尚不清楚[5]。另1个MADS-box转录因子 SHORT VEGETATIVE PHASE(SVP),其AS亚型对植物开花具有不同影响,SVP亚型过量表达植株表现出不同的开花时间及发育进程,这可能与其能和不同蛋白发生互作有关[21];过量表达SVP1亚型的植株则表现出晚花性状,表明其为开花抑制因子;而过量表达SVP3亚型的植株则开花正常,这可能是其缺少1个蛋白质-蛋白质互作功能域所导致的[21]。Posé等[30]指出,拮抗型剪切变体在温度依赖性开花时间控制中具有不同作用:较低温度下SVP与MAF1/FLM-β型剪切变体互作进而抑制开花,该变体含有MIKC蛋白互作结构域;温度升高后,另一剪切变体MAF1/FLM-δ与SVP互作,其包含可变的第3外显子,由于DNA结合活性降低,SVP-MAF1/FLM-δ复合体作为失活的抑制子最终加速开花。成花整合因子SUPPRESSOROFCONSTANSOVEREXPRESSION1(SOC1)同样经历了 AS,且其 AS亚型被 EARLY FLOWERING9(ELF9)蛋白靶向降解,ELF9蛋白具有2个RRM结构域,该结构域与酿酒酵母CUS2的RRM极为相似,而CUS2参与组装U2 snRNP[31]。
2.2 昼夜节律(生物钟)
植物利用生物钟保证其生理过程在一天当中能有序进行[32]。昼夜节律网络由中心振荡器、信号输入元件和信号输出元件组成,而中心振荡器的核心包括circadian clock associated1(CCA1)、late elongated hypocotyl(LHY)和timing of CAB expression1(TOC1)。CCA1和LHY是DNA结合蛋白,属于MYB转录因子家族,响应光信号以参与植物的昼夜节律调控,通过结合TOC1启动子区域抑制其表达。这些组份通过反馈其自身基因的转录而产生自持振荡,而负向反馈回路由不同的机制控制,包括蛋白质磷酸化、蛋白质翻转、基因表达以及染色质重塑,进而维持24 h的周期[33]。在暴露于高光和低温下的拟南芥中,分别检测到了CCA1第4内含子保留的AS亚型,其在高光下上调,而在低温下下调[34]。这一AS在单子叶植物二穗短柄草(Brachypodium distachyon)[35]和水稻[36],以及双子叶植物杨树(PopulusL.)[37]中均较保守,表明了其功能的重要性。拟南芥大多数的生物钟基因均经历了AS,且在温度变化过程中可观察到明显的AS动态变化[38]。Seo等[39]预测拟南芥中CCA1的内含子保留AS亚型可以产生1个C-末端具有二聚化结构域的蛋白质,其N-末端没有DNA结合的MYB结构域,该蛋白被命名为CCA1β;转基因试验证明,CCA1β会干扰CCA1和 LHY二聚体的形成,从而抑制其转录;而CCA1β的过量表达则导致短周期表型,这与cca1/lhy突变体中观察到的结果一致,表明其为CCA1和LHY转录表达的抑制剂。低温下约有10%~15%的转录本在经历AS后丰度增加,大多数转录本不可编码功能性蛋白,因而对蛋白水平有潜在影响,如LHY5′UTR第1内含子保留的AS转录本,和/或可变的第5外显子AS转录本在低温处理下均通过NMD的方式发生翻转,最终导致功能性LHY蛋白水平的降低[38]。
AS是保证生物钟正常运转所必需的,拟南芥中的蛋白质精氨酸甲基转移酶5(protein arginine methyltransferase 5,PRMT5)是决定昼夜节律的关键因子,prmt5突变体表现出长期的子叶运动以及基因表达节律[40]。生物钟基因PSEUDO-RESPONSE REGULATOR9(PRR9)的AS与PRMT5有密切关系,野生型的植株中可检测到2个反向轻微振荡的PRR9 AS亚型:1个是成熟的mRNA,另1个是第2外显子末端具有8个额外核苷酸的亚型,这8个额外核苷酸是NMD的识别位点,且第2种亚型编码1个N-端截短的PRR9蛋白[40]。prmt5突变体中检测到大量第3内含子保留的AS亚型,而编码全长蛋白的mRNA则几乎没有,这表明prmt5突变体昼夜节律的紊乱是由PRR9剪切异常导致的[40]。苜蓿(Medicago truncatula)中的JMJC5(MtJMJC5)与拟南芥的生物钟基因JMJ30/JMJD5高度同源,其响应昼夜节律以及非生物胁迫。测序结果表明,MtJMJC5在低温下特异经历AS,并产生4种AS亚型,包括1个全长功能蛋白和3个具有PTC的变体,这些变体是由第1和第2内含子经历3′端AS后产生的,而低温下诱导的AS在温度恢复正常后则消失。然而,目前尚未有关于拟南芥中的JMJ30/JMJD5经 AS的研究报道,据此推断,MtJMJC5在RNA水平上的基因表达调控机制可能存在物种特异性,并可能对苜蓿的生物钟和温度波动之间的关联进行表观遗传调控[41]。
Hazen等[42]对拟南芥全基因组拼接阵列ATH1芯片综合性分析表明,大部分转录组受到生物钟的调控,并检测到编码和非编码区内含子的节律表达。大多数情况下,这些内含子与相邻的节律性外显子同步表达,产生了内含子保留的AS亚型,极有可能产生截短的蛋白变体;另一方面,一些基因的内含子表现出节律性,但外显子表达却不表现出节律性,说明AS对昼夜节律有调控作用。
3 AS在植物非生物胁迫响应中的作用
研究表明AS广泛存在于逆境胁迫下的植物中,对于增强植物的胁迫耐受性十分重要[4]。外显子跳跃、内含子保留,5′端AS和3′端AS这4种AS模式均能增加蛋白质多样性、诱导翻译,并影响胁迫环境中植物mRNA的稳定性[5](图2)。已有报道指出,植物中的AS参与了非生物胁迫响应的多个过程[5],如促分裂原激活蛋白激酶(mitogen-activated protein kinases,MAPKs)在真核生物响应环境变化中具有重要作用,水稻OsBWMK1是MAPK家族成员,在经历AS后可产生3种转录本亚型OsBWMK1L,OsBWMK1M和OsBWMK1S,其中OsBWMK1L转录本亚型在各个生长时期和逆境胁迫下表达稳定,而OsBWMK1M和OsBWMK1S在正常情况下表达水平较低,但可被各种胁迫诱导表达;对这3个亚型所编码蛋白的亚细胞进行定位分析,正常情况下,OsBWMK1L变体大部分存在于细胞质中,但经胁迫处理后则转运至细胞核,而OsBWMK1M和OsBWMK1S在胞质和核中均可检测到,表明OsBWMK1L变体可响应外部胁迫信号,并从细胞质转移至细胞核,参与调节应激响应[43]。
3.1 温度胁迫
AS通常会响应植物的低温胁迫[44],而大部分转录因子(transcription factors,TFs)都会在胁迫环境下经历AS。因此,AS被认为是感知温度变化和调节TFs活性的一种方式。
植物中低温应答基因的调控通常与AS相关[44]。低温响应期间,拟南芥中的AS出现在整个基因组范围内,许多经历低温诱导AS的基因在低温响应调控中发挥作用。如拟南芥中的STA1和SRL1剪切因子,其突变体导致AS以及低温敏感性/耐受性的变化,表明AS在调节低温响应中具有重要作用[45-46]。Egawa等[47]报道,小麦(Triticum aestivumL.)WDREB2基因与拟南芥DEHYDRATION RESPONSIVE ELEMENT BINDING PROTEIN2(DREB2)基因同源,其可在低温下通过外显子跳跃的方式产生3种不同的转录本亚型,这3种亚型具有不同的表达模式,且转录本亚型的相对比率随温度变化而变化。此外,水稻的DREB2型基因OsDREB2B,也同样通过 AS产生 2种亚型OsDREB2B1和OsDREB2B2,二者的积累受温度的差异性调节[48]。苜蓿中的JMJC5基因(MtJMJC5)参与生物钟及非生物胁迫,并在低温诱导下发生AS,这种低温诱导产生的特异AS,在温度恢复正常后消失。测序结果表明,MtJMJC5在经历AS后会产生4种亚型,包括1个全长功能蛋白和3个含有PTC的变体。推测MtJMJC5的低温诱导性AS,很可能存在RNA水平上基因表达调控的物种特异性机制,并在苜蓿响应环境温度变化中发挥作用[41]。
热激反应是植物应对高温胁迫所进化出的一种应激反应,对增强植物体耐受性和保证其正常生长具有重要作用[49]。作为热激反应的产物,热激蛋白(heat shock proteins,HSPs)和热激转录因子(heat shock transcription factors,HSFs)主要参与蛋白合成、折叠、降解,以及与其他蛋白和信号分子发生互作等方式参与应激反应[50-51]。在番茄(Solanum lycopersicum)花粉中检测到约7 500个基因发生内含子保留和外显子跳跃的AS,包括在植物热激反应中有关键作用的6个HSPs和29个HSFs[52]。为深入研究高温胁迫下的AS及其作用,Kannan等[53]比较了模式植物拟南芥和高耐热性加利福尼亚芥菜(Boechera depauperata)在高温胁迫下的AS,结果显示大量基因在高温胁迫过程中经历AS并且差异表达。此外,对经历AS的基因功能类别的进一步分析表明,2个物种中的功能基因富集模式不同。加利福尼亚芥菜中富集的基因主要包括光响应基因和许多非生物胁迫应答基因;而在拟南芥中富集的基因主要包括RNA加工和核苷酸结合,这些在加利福尼亚芥菜中并不包括。因此,这2种植物中AS对高温胁迫响应表现出显著差异,且AS对高温胁迫的响应存在物种特异性[53]。此外,对苔藓(Physcomitrella patens)进行的全基因组分析表明,高温导致近50%的表达基因发生AS,其中内含子保留的比例下降,外显子跳跃则占据主导,表明AS在响应热激时存在差异调节[54]。
3.2 渗透胁迫
渗透胁迫是植物生长过程中易遭受的环境胁迫之一,干旱、盐碱、低温等都会造成渗透胁迫[55]。葡萄(Vitis vinifera)的叶和根中约有4%~7%的AS亚型在干旱和盐胁迫下特异发生,并具有显著的组织和品种特异性,其中内含子保留发生的频率最高[56]。Thatcher等[57]发现,玉米(Zea maysL.)中干旱诱导的AS主要发生在叶和穗中,分别鉴定出1 060和932个,分别占表达基因的6.2%和5.5%,均高于雄性花序中的AS,表明AS与组织类型以及胁迫条件密切相关。Ding等[58]对盐胁迫拟南芥中AS的研究表明,不同浓度盐处理后,约有49%的具有内含子的基因均经历了AS,与未经盐胁迫处理相比,AS的数量显著增加。此外,一部分AS并不受盐胁迫的差异调节,表明在胁迫响应的基因调控中,AS可能是一个独立的途径。
拟南芥中的2个基因SRL1和RCY1,其编码的蛋白属于SR类剪切因子家族[59],并作为剪切体的组分参与组成型和/或AS的形成,以及pre-mRNA加工的其他阶段,如耦合转录与 RNA转录后修饰[60-61]。Bourgon等[46]发现SRL1和RCY1可被盐、干旱和其他胁迫激活,在拟南芥中过量表达后,可显著增强转基因植株对盐胁迫的耐受性。
DREB转录因子家族可诱导植物中多种抗逆基因的表达,其中DREB2的表达主要由干旱激活[62]。Matsukura等[48]发现在干旱和高盐胁迫的水稻中,OsDREB2受到 AS调控,产生 2种亚型的转录本OsDREB2B1和OsDREB2B2,其中OsDREB2B1是含有PTC的非功能性亚型,在正常条件下占主导,而编码具有转录激活活性蛋白功能的OsDREB2B2,在胁迫条件下被显著诱导,以促进下游靶基因的表达并增强植物在胁迫条件下的耐受性。此外,小麦WDREB2是OsDREB2B的直系同源基因,在低温、干旱和盐胁迫下均表现出类似的AS模式,这表明植物物种间AS调节具有保守性[63]。
4 TFs经历的AS在植物非生物胁迫响应中的作用
TFs是植物生长和发育调控网络的关键组成部分,并在生物和非生物胁迫响应中发挥重要作用[64]。通过在不同的信号网络中调整信号转导途径,TFs可以保证植物在既定的条件下处于最佳的生长状态[65-66]。
TF发生AS是一种重要的基因表达调控机制,通过识别不同的剪切位点可产生多个亚型的转录本和功能蛋白质,此外,AS的作用也与其他基因调控机制有关,如由小干扰肽(small interfering peptides,siPEPs)介导的肽干扰(peptide interference,PEPi)[67]。动态二聚体的形成对TFs的调控特异性和功能可靠性十分重要,大多数TFs会形成同源二聚体或异源二聚体,从而增加了DNA特异结合的多样性[68]。此外,二聚体的形成也是TFs负调控的基础,而TFs的负调控由一类siPEP介导[67]。siPEPs是一类特殊的蛋白质,具有独特的结构,部分序列与一些TFs的序列相似;其具有蛋白质-蛋白质互作所需的二聚化结构域[67],该结构域也是siPEPs与靶TF发生互作的前提,具有同源二聚化结构域的TF为其靶标;因此,由siPEPs竞争干扰TF所产生的功能性二聚体的形成,这一调控机制被命名为PEPi[69]。AS与siPEP的产生密切相关,部分TFs在经历AS后,产生无转录活性的转录本,但它们可以作为siPEP,通过与功能性TFs形成无功能的异源二聚体,建立独特的自我调节回路[70]。大部分编码TF的基因都会经历AS[4,21],AS被认为是调节TF活性的一种方式,推测其通过将基因表达调控与PEPi和/或NMD机制耦连在植物的级联信号中发挥作用[70]。
HSFs和HSPs是植物中重要的TFs,在热胁迫的响应过程中有关键作用,并对植物的耐热性有显著影响。HSFs在模式植物拟南芥和水稻中分别有21个和25个家族成员[71]。大多数HSFs具有共同的特征,即经历AS。这些蛋白具有保守的剪切位点,在不同物种的HSF基因进化过程中发挥重要作用[72]。相比其他物种,植物中包含更多的功能HSFs,原因之一是植物HSFs在经历AS后还会发生特化作用,最终形成不同的HSFs[54]。HSFs家族成员HSFA2的AS调控在苔藓、紫花苜蓿、拟南芥和水稻中已得到广泛研究[54,72-74]。这些结果表明HSFA2均经历了AS,说明这一转录后调控机制在植物中较保守。高温诱导的HSFB2a参与了拟南芥雌性器官的发育,并能抑制HSFA2活性[75]。 Lee等[76]证实,甘蓝 (Brassica oleraceaL.)的HSFB2a(BoHSFB2a)在高温胁迫下会产生2种AS亚型,这不仅增加了对BoHSFB2a转录调控的复杂性,也可能是高温耐受型甘蓝自交系具有较高耐热性的原因。
5 展望
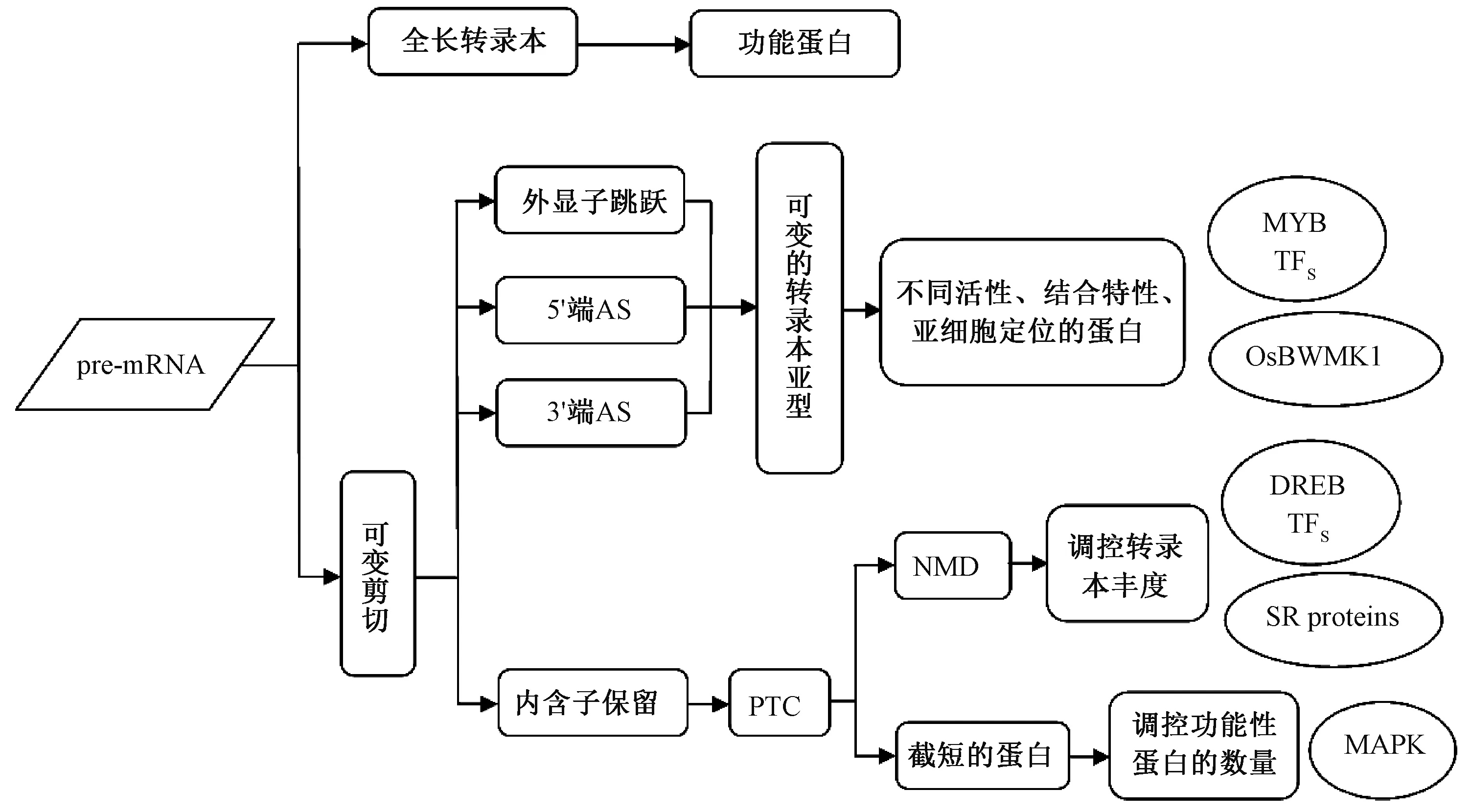
图2 不同模式AS在植物发育和胁迫响应中的主要作用[4]Fig.2 Scheme of the main effects of the different patterns of alternative splicing in the plant development and response to stress[4]
AS是植物调控基因互作网络的重要分子机制,主要在转录后水平对植物发育和逆境胁迫响应进行调控[30,77]。一些重要的胁迫响应基因在响应逆境胁迫过程中经历的AS在不同植物物种中表现出保守性,如HSFA2和DREB2B是关键的非生物胁迫调控因子,在热胁迫和干旱胁迫下的拟南芥和水稻中,二者均经历了AS,以增强植物的胁迫耐受性;此外,HSFA2和DREB2B在小麦中的同源基因同样表现出保守的AS模式[48,74]。近年来,已有研究揭示了部分AS的功能和分子机制,取得了显著进展,但仍处于研究的初级阶段。随着高通量测序技术的发展,越来越多的植物基因组序列和转录组数据,为物种、组织、发育阶段以及环境特异调控AS的鉴定提供了技术支撑,同时也有助于确定AS在不同发育阶段、环境条件和胁迫下的动态变化,以及在不同生态型和多倍体中,AS模式的差异如何影响植物物种的适应性。因此,研究植物中不同发育阶段、环境条件下AS的作用模式,明确其调控位点,将有助于理解AS作用的分子机制,同时有利于更加全面地了解AS对非生物胁迫的响应以及增强植物胁迫耐受性的机理。
关于AS研究中另一个关键问题是,由AS产生的剪切变体可能增加了蛋白质的数量,但目前尚不明确在植物和动物中,剪切变体的哪些部分对功能性蛋白质多样性有影响。除了增加蛋白质的多样性,AS还是调控基因表达的重要因素,主要通过在转录水平上调控转录本稳定性来实现,而由NMD、小非编码RNA和其他机制介导的AS亚型对基因表达调控的比例尚不清楚。尽管已有许多报道指出AS在植物发育和胁迫响应中有重要作用,但分析个体mRNA亚型的功能有助于理解AS在植物生长发育,应激反应中的重要作用[78]。一些基因在经历AS后,其产物会影响其他基因的AS,而后者可能会反作用于前者以增强并放大响应胁迫的信号流,因此,需要进一步研究以阐明发育和环境信号如何转导并激活AS进而调控基因表达[70]。AS在植物发育和逆境胁迫响应过程中有重要调控作用,研究其模式及作用机理对植物生长发育进程调节和优良抗逆性品种的选育具有重要指导意义。
