镉和模拟酸雨胁迫对苦楝幼苗镉含量及叶片抗氧化系统的影响
2020-01-15龙聪颖邓辉茗苏明洁廖源林蔡仕珍
龙聪颖 邓辉茗 苏明洁 廖源林 蔡仕珍
(四川农业大学风景园林学院,四川成都 611130)
工业化生产和人类活动引起的土壤重金属污染和酸雨问题日益严重。环保部和国土部调查公告显示,目前我国无机型污染土壤占全部超标点位的82.8%,其中镉(Cd)为首要污染物,点位超标率达到7.0%[1]。Cd具有较强的毒性,是植物非必需元素,具有致癌变、致畸变、易富集迁移到生物体等特性[2]。酸雨是pH值小于5.6的酸化雨、雪、雾和露等酸沉降的统称,是当今全球三大环境问题之一。中国是世界上继欧洲和北美之后出现的第三大酸雨覆盖区域,40%的国土面积受到了酸雨污染[3],形成了西南、华中、华南沿海三大污染区[4],且污染面积正逐年扩大,危害程度亦日益严重。城市中受到重金属Cd和酸雨双重污染的地区较多,重金属Cd和酸沉降会干扰植物的光合作用和呼吸作用,影响营养元素的吸收和转运等[5-6],使植物受到毒害,严重时甚至导致其死亡。植物修复技术是利用绿色植物固定、降解、提取和挥发等作用来治理土壤重金属污染,因其具有绿色、环保、经济等优点而受到广泛关注,因此,筛选利用具有较强抵御Cd和酸雨双重胁迫能力的植物,对重金属Cd和酸雨双重污染地区的植被选择具有重要意义。
苦楝(Melia azedarachL.)为楝科(Meliaceae)楝属(Melia)落叶乔木,分布于热带、亚热带和温带地区,是我国西南地区常见的乡土树种,生长于海拔2 100 m以下的常绿阔叶林[7],其根、皮、花、果有均可入药,具有清热解毒、去肝火、止痛、驱虫的功效[8]。研究表明,苦楝对重金属Cd胁迫具有较强的耐受能力[9],且苦楝具有生长速度快,材质优良,耐干旱、瘠薄等特性,可作农林间作和盐碱土植被恢复树种[10],其冠形美观、干形笔直,花淡紫色,病虫害少,是理想的园林绿化树种,宜作庭荫树及行道树。目前,前人对苦楝的研究主要集中在抗性研究[11-12]、种源鉴定[7,13]、遗传多样性分析[7]和化学药用成分分析[14-15]等方面,而关于其在重金属和酸雨双重胁迫下响应机制的研究尚鲜见报道。本研究采用盆栽试验,探究Cd和酸雨胁迫下苦楝Cd含量及叶片抗氧化系统运转,以期揭示苦楝抗氧化系统对酸雨和重金属胁迫的生理机制,为土壤镉污染的酸雨区域的修复植物的筛选提供科学依据。
1 材料与方法
1.1 试验材料
供试种子于2014年末在四川温江7~8年生苦楝母株上采集,净种后筛选颗粒饱满、大小一致的种子。试验园土为四川农业大学旁园林苗圃内紫色土,采样深度为土壤表层0~20 cm。草炭土、河沙由成都市温江区花木交易中心提供。
1.2 试验设计
2015年年初,选取饱满的苦楝种子播种至盛有基质(园土∶草炭∶河沙=5∶3∶2)的塑料盆(上口径15 cm,高15 cm)内,在四川农业大学科研基地温室大棚(大棚透光率80%,棚内温度25±3℃,相对湿度70%±5%)内常规管理。同时将采集于温江苗圃的园土风干、捣碎、剔除杂物、研磨,按照园土∶草炭土∶河沙=5∶1∶1(体积比)的比例混匀后过钢筛(孔径5 mm),用800倍多菌灵消毒,静置堆放3 d。将备好的土壤装入带托盘的花盆(口径25 cm,高20 cm)中,每盆7 kg,用去离子水浇灌至土壤含水量约为田间持水量的60%。根据国家土壤环境质量标准[16]和四川盆地重金属污染概况[17],本试验设 Cd浓度梯度为 0、30、60、90、120、150、180 mg·kg-1(采用分析纯 CdCl2·2.5H2O 和去离子水配置,约500 mL),将配好的溶液均匀浇灌至盆土中,反复回浇,直至不再流出,以确保Cd与土壤充分混合均匀,在室内放置稳定15 d后用于试验。
根据我国西南地区自然酸雨类型(硫酸型酸雨)及酸雨的主要离子成分[18],参照郑有飞等[19]的方法配置模拟酸雨,分别采用 0.15 mol·L-1NaCl、0.55 mol·L-1NH4Cl、 0.12 mol·L-1MgCl2、 0.15 mol·L-1CaCl2、0.21 mol·L-1KCl、0.1 mol·L-1NaF 配制各离子浓度的稀释液,然后用 0.5 mol·L-1H2SO4和 0.1 mol·L-1HNO3等体积混合液调节pH值,利用S20K型酸度计(上海瑞仪仪器有限公司)分别调节pH值至3.5、4.5和5.6,代表强酸雨、典型酸雨和临界酸雨。
本试验采用两因素完全随机试验设计,模拟酸雨3个浓度水平,Cd2+剂量7个水平,以pH值5.6的模拟酸雨和不添加Cd(0 mg·kg-1)为对照(A1B1,CK),共21个处理(表1)。
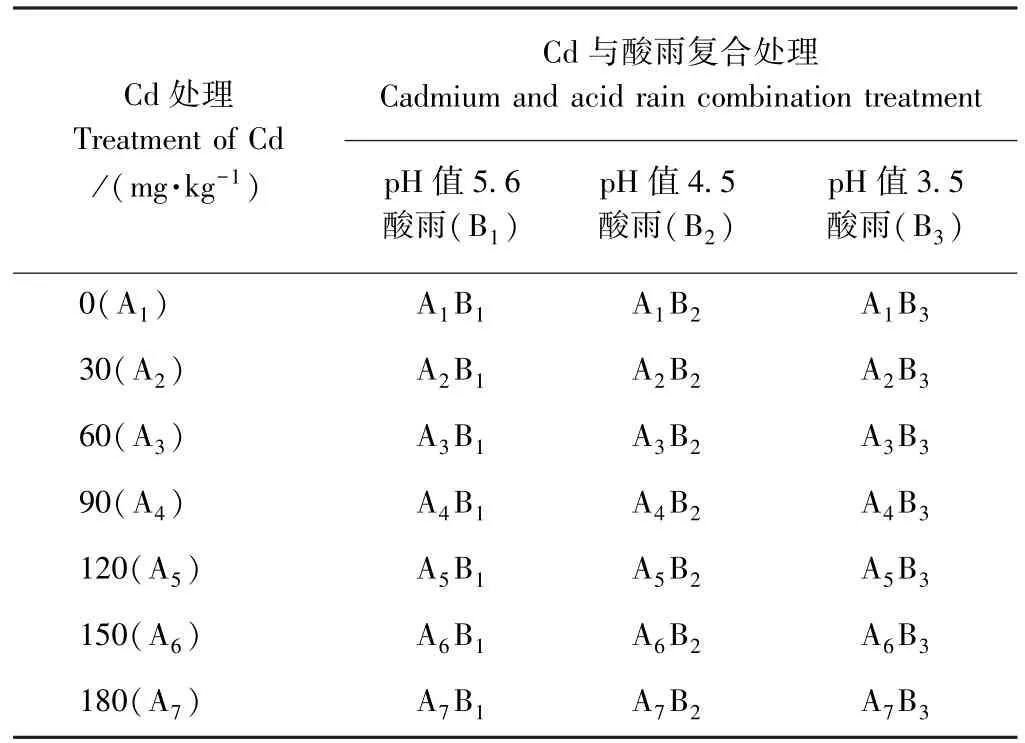
表1 Cd与酸雨复合处理因素水平表Table 1 Factor level table of cadmium and acid rain combination treatment
于2015年8月初,将长势相近的健康一年生苦楝幼苗移栽到上述经Cd处理土壤的塑料盆中(移栽时注意不要伤及根系),每盆1株,每处理5个重复,共105株。将植株置于温室大棚内管理(1周内保证叶片不失水,1周后常规管理),模拟酸雨采用喷雾法,在移栽后第3天,于早上8:00根据表1对相应植株进行叶面喷施,每次喷施量以成都市8-11月平均降雨量[20]为参照标准,确定每月喷施量后平均分配至每周,每隔2 d喷施一次。酸雨喷施期间植株不浇水,且喷施时注意用塑料薄膜将不同处理的植株隔开,以避免干扰。处理60 d后测定植株的生长及生理指标(生理指标取植株从上到下第3~第5片叶)。
1.3 测定指标与方法
1.3.1 形态指标的测定 地上部、地下部干重测定:采用破坏性收获法采集植株,用蒸馏水将收获的植株洗净,按照地上部(茎、叶)和地下部(根)分开,105℃杀青30 min,75℃烘干至恒重后称重。
1.3.2 Cd含量的测定 每个处理随机选择3株植物,用去离子水将其叶片、茎杆和根部洗净,105℃杀青30 min,80℃烘干至恒重后粉碎,称取0.5 g粉末,采用混合酸(硝酸∶高氯酸=4∶1)于电炉上消解,过滤,定容至50 mL,利用AA320N型原子吸收分光光度计(上海精密科学仪器有限公司)测定叶片、茎杆和根部样品中的Cd含量。
1.3.3 生理指标的测定 抗坏血酸(ascorbic acid,AsA)含量采用钼蓝比色法[21]测定;谷胱甘肽(glutathione,GSH)含量参照郝建军等[21]的方法测定;超氧化物歧化酶(superoxide dismutase,SOD)活性采用氮蓝四唑(nitroblue tetrazolium,NBT)法[21]测定;过氧化物酶(peroxidase,POD)活性采用愈创木酚法[22]测定;过氧化氢酶(catalase,CAT)活性采用紫外分光光度法[22]测定;抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性和谷胱甘肽还原酶(gluathione reductase,GR)活性参照Nakano等[23]的方法测定。
1.4 数据处理
采用Microsoft Office Excel 2007进行数据处理和图表分析,所有数据均为3次重复的平均值;SPSS 20.0统计软件建立一般线性模型,并进行单变量方差分析和新复极差法多重比较,显著性水平设定α=0.05。
2 结果与分析
2.1 Cd与酸雨复合胁迫对苦楝幼苗干重的影响
由表2可知,单一Cd胁迫下,苦楝幼苗地上、地下部干重均随着Cd浓度的增加呈先上升后下降的趋势,且峰值均出现在30 mg·kg-1Cd处理下,分别为CK的1.12、1.16倍,180 mg·kg-1Cd处理下,较 CK 分别下降54.76%、17.04%;单一酸雨处理时,苦楝幼苗地上、地下部干重均随着pH值降低逐渐减少,pH值3.5处理下分别较CK下降9.18%、16.87%;Cd和酸雨复合处理时,Cd浓度和酸雨pH值越大,地上、地下部干重降低越明显。其中,除30 mg·kg-1Cd、pH值4.5处理的地上干重高于CK外,其他处理均低于CK,且地上、地下部干重均在180 mg·kg-1Cd、pH值3.5处理下达到最低值,分别较CK降低了60.16%、44.23%,且降幅高于单一180 mg·kg-1Cd和单一pH值3.5处理。结果表明,单一Cd处理对苦楝幼苗生长表现为“低促高抑”,单一酸雨处理及Cd和酸雨复合处理均表现为抑制作用。
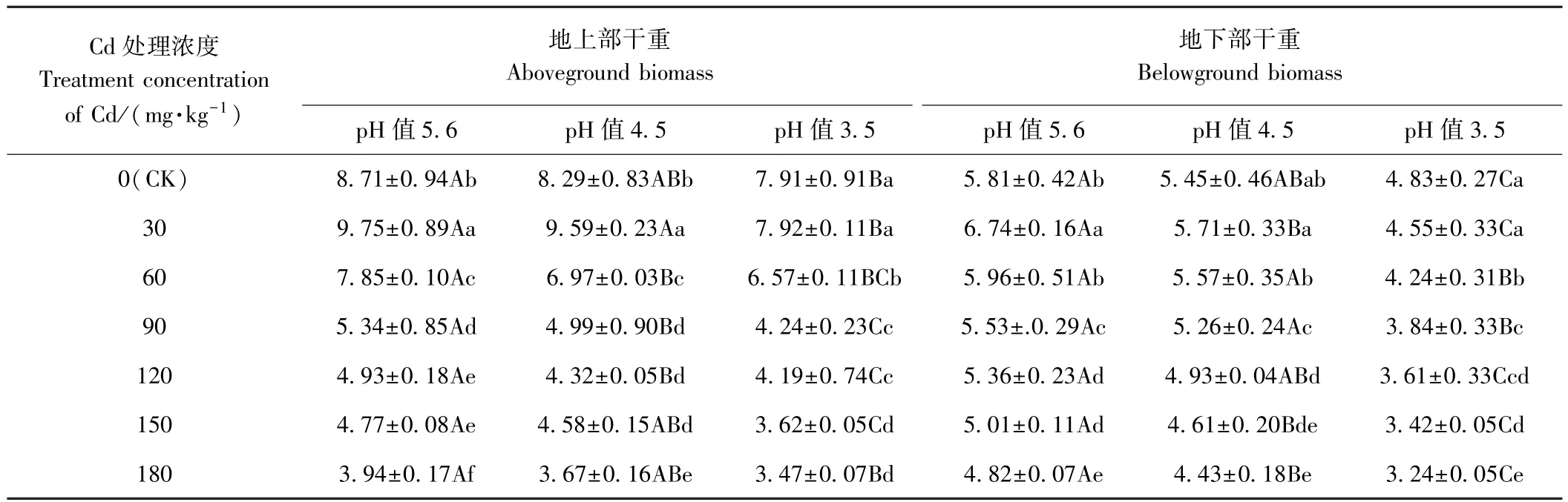
表2 Cd与酸雨复合胁迫对苦楝幼苗干重的影响Table 2 Effects of Cd and acid rain combined stresses on growth of M.azedarach seedlings /(g·pot-1)
2.2 Cd与酸雨复合胁迫对苦楝幼苗Cd含量的影响
由图1可知,单一Cd胁迫下,植物茎杆、叶片和根部的Cd含量均随着Cd浓度的增加而逐渐升高,表现为根部>茎杆>叶片。180 mg·kg-1Cd处理时,茎杆、叶片和根部的Cd含量分别为CK的4.82、6.13和16.55倍,表明苦楝吸收的Cd主要积累于地下部。Cd和酸雨复合处理下,当酸雨pH值为4.5时,植物茎杆、叶片和根部的Cd含量均随着Cd处理浓度的升高呈上升趋势,其中180 mg·kg-1Cd处理下3个部位的Cd含量分别为CK的4.09、5.13和15.09倍;酸雨pH值为3.5时,茎杆和根部的Cd含量均随着Cd处理浓度的升高呈先上升后下降的趋势,其峰值分别出现在Cd处理浓度为 120、150 mg·kg-1时,为 CK 的 4.00、14.64倍,而叶片中的Cd含量则逐渐升高,且在180 mg·kg-1Cd处理时达到最大,为CK的3.38倍。同一Cd处理浓度下,随着酸雨pH值的降低,茎杆Cd含量在Cd浓度≤120 mg·kg-1时整体呈先下降后上升趋势,Cd处理浓度≥150 mg·kg-1则呈降低趋势,叶片中的Cd含量也逐渐减少;根部 Cd含量在 Cd处理浓度为 150 mg·kg-1时呈上升趋势,Cd处理浓度为180 mg·kg-1时则显著降低。酸雨和Cd复合胁迫抑制了茎杆、叶片和根部对Cd的积累,其中对叶片的抑制效果最为明显。
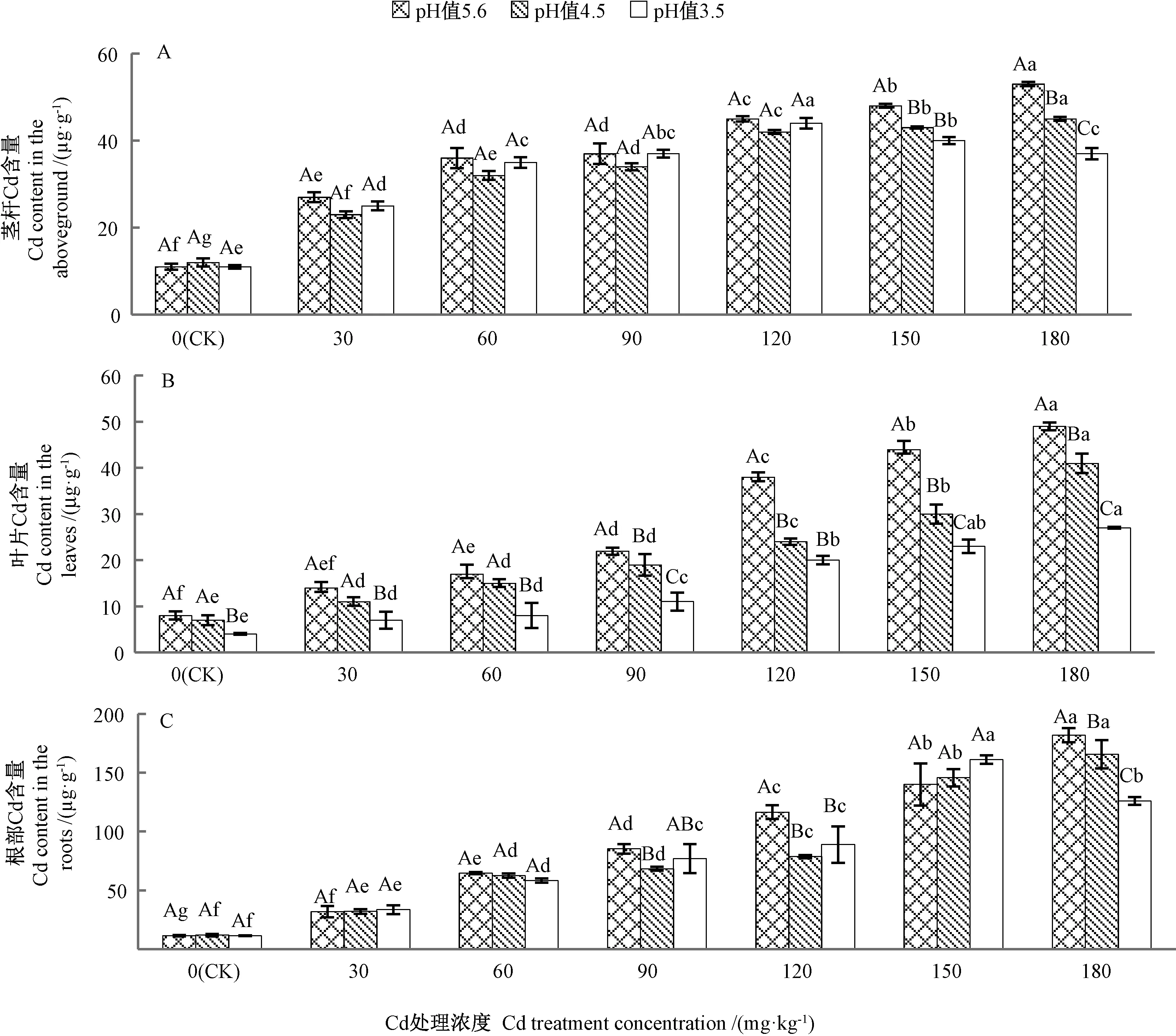
图1 Cd与酸雨复合胁迫对苦楝茎杆(A)、叶片(B)和根部(C)中Cd含量的影响Fig.1 Effects of compound stresses of Cd and acid rain on the Cd contents in the stems(A),leaves(B)and roots(C)of M.azedarach
2.3 Cd与酸雨复合胁迫对苦楝叶片抗氧化酶系统及非酶促抗氧化剂的影响
2.3.1 Cd与酸雨复合胁迫对苦楝叶片三大保护性酶的影响 SOD、POD和CAT是植物抗氧化系统中酶促清除自由基体系的主要酶。其中,SOD是清除活性氧(reactive oxygen species,ROS)系统第一道防线,能催化超氧阴离子自由基()发生歧化作用,转化为H2O2和 O2;POD、CAT 是将 H2O2变为 H2O 和 O2,三者协调作用使ROS维持在较低水平,以减轻ROS对植物体的毒害作用。由图2可知,单一Cd处理下,SOD、POD和CAT活性均随者Cd处理浓度的增加呈先上升后下降的趋势,其中SOD和CAT活性均在60 mg·kg-1Cd处理时达到峰值,分别为CK的1.16、4.11倍;POD在90 mg·kg-1Cd处理时达到峰值,为CK的2.10倍。单一酸雨处理时,SOD活性略有上升,但未达到显著水平(P>0.05),而CAT活性显著升高(P<0.05),pH值3.5处理时SOD、CAT活性分别为对照的1.03、2.37倍;POD活性呈先上升后下降的趋势,在pH值4.5时达到最高,为CK的1.27倍。
Cd和酸雨复合处理下,酸雨pH值相同时,SOD、CAT和POD活性均随着Cd处理浓度的升高呈先上升后下降的趋势,pH值4.5时,分别在Cd处理浓度为60、60和 90 mg·kg-1时达到峰值,分别较 CK增加15.28%、321.05%和133.18%,而pH值3.5下,三者均在60 mg·kg-1Cd时达到峰值,分别较 CK增加10.11%、289.47%和99.05%。同一Cd处理浓度下,随着酸雨pH值的降低,SOD活性逐渐下降,CAT活性在30 mg·kg-1Cd处理时逐渐升高,60和90 mg·kg-1Cd处理时均呈先上升后下降趋势,而在Cd浓度≥120 mg·kg-1时逐渐下降,POD活性则无明显变化趋势;SOD和CAT活性均在60 mg·kg-1Cd、pH值4.5时达到最大,分别较CK增加15.28%、321.05%,POD活性则在90 mg·kg-1Cd、pH值4.5时达到最大值,较 CK增加133.18%。结果表明,SOD、CAT和POD三者的协同作用能有效清除苦楝体内自由基,但仅在酸雨pH值4.5、Cd浓度低于 120 mg·kg-1,以及酸雨 pH值3.5、Cd浓度低于60 mg·kg-1时,三者才能有效的发挥作用。
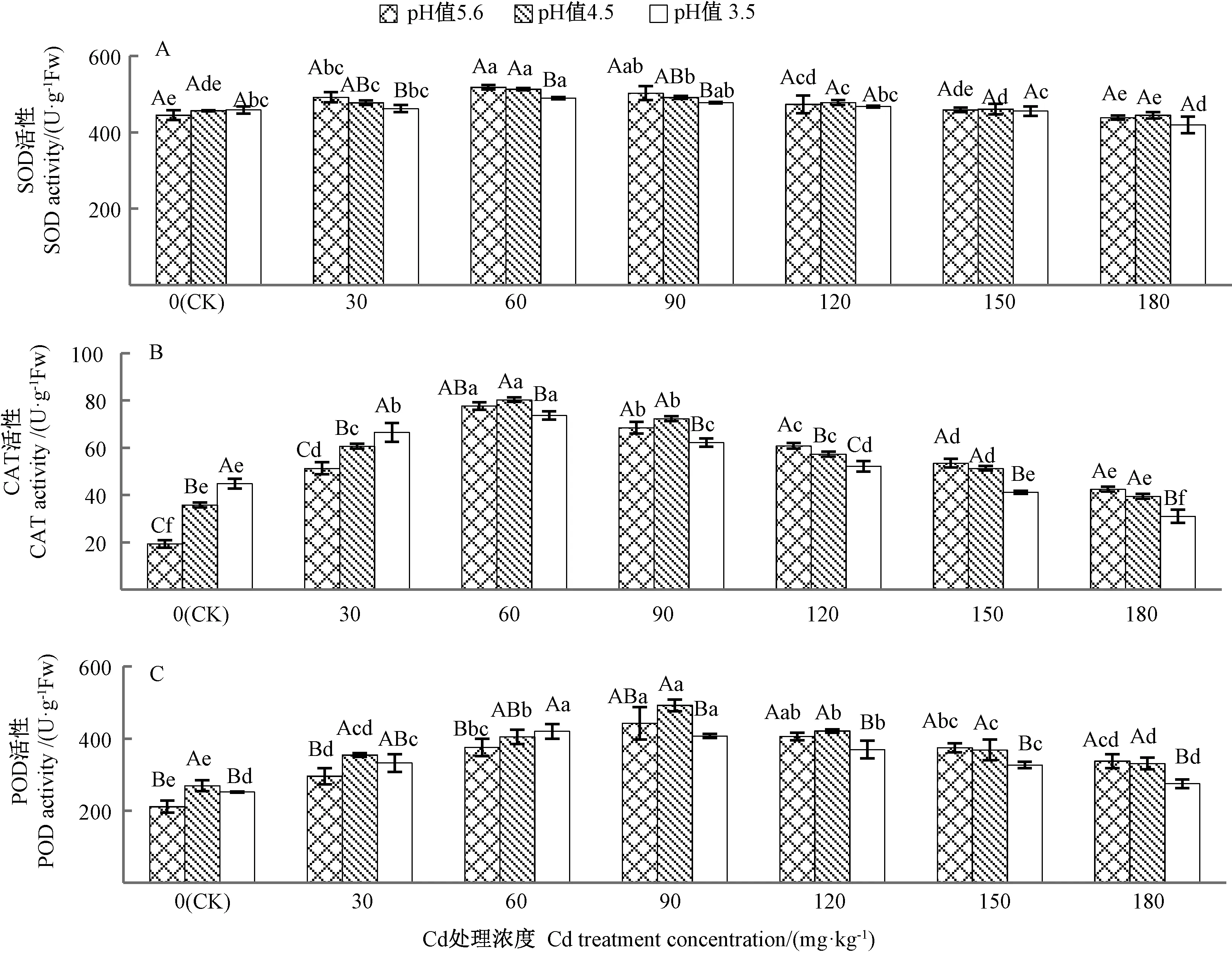
图2 Cd与酸雨复合胁迫对苦楝叶片SOD(A)、CAT(B)、POD(C)活性的影响Fig.2 Effects of compound stresses of Cd and acid rain on the SOD(A),CAT(B)and POD(C)activity in M.azedarach leaves
2.3.2 Cd与酸雨复合胁迫对苦楝叶片抗坏血酸-谷胱甘肽循环的影响 AsA、GSH是植物抗坏血酸-谷胱甘肽循环(AsA-GSH)中2个重要的非酶促抗氧化剂,APX和GR是AsA-GSH循环中2种重要的酶类。其中AsA广泛存在于植物光合组织中,可在APX的催化作用下直接与单线态氧、、H2O2等活性氧基团反应,还原ROS[24];GSH是植物细胞中含量最丰富的含巯基低分子肽,对保持细胞膜结构完整性和防御自由基积累起到保护性作用;GR可将氧化型谷胱甘肽(glutathione oxidized,GSSG)还原为还原型谷胱甘肽(GSH),从而提高GSH含量,四者协调一致,在抵抗环境胁迫、清除逆境活性氧积累等方面发挥重要的作用[25]。由图3可知,单一Cd处理下,苦楝叶片中AsA和GSH含量均随着Cd处理浓度的增加而呈先增加后减少变化,分别在Cd处理浓度为60、120 mg·kg-1时达到峰值,较 CK分别增加111.76%、27.27%。除180 mg·kg-1Cd时的AsA含量降低为CK的0.65倍外,其他处理下ASA和GSH的含量均高于CK。单一酸雨处理时,AsA含量随着pH值的降低而增加,但未达到差异水平(P>0.05),而GSH含量呈先上升后下降的趋势,二者分别在pH值3.5、4.5时达到最大,分别较CK增加23.53%、9.10%。Cd和酸雨复合处理下,除酸雨pH值3.5时,AsA含量随Cd处理浓度呈先下降后上升再下降的趋势外,其余处理pH值相同时,AsA、GSH含量均随着Cd处理浓度的升高呈先上升后下降的趋势,pH值4.5时,AsA、GSH含量分别在Cd浓度为60、90 mg·kg-1时达到峰值,较 CK分别增加135.29%、33.33%;pH值 3.5时,分别在 Cd浓度为30、90 mg·kg-1时达到峰值,较 CK 分别增加 94.12%、30.30%;同一Cd处理浓度下,随着酸雨pH值的降低,除30 mg·kg-1Cd处理外,其他各处理下AsA含量均呈先上升后下降的趋势,而GSH含量在Cd浓度≤90 mg·kg-1时呈先上升后下降的趋势,Cd浓度≥120 mg·kg-1时则逐渐降低。结果表明,在pH值4.5、Cd浓度低于90 mg·kg-1和pH 值3.5、Cd浓度低于60 mg·kg-1条件下,AsA和GSH能够协同清除苦楝幼苗内的活性氧自由基,在高浓度Cd和较低pH值酸雨胁迫下,AsA-GSH循环中主要由GSH参与活性氧的清除。
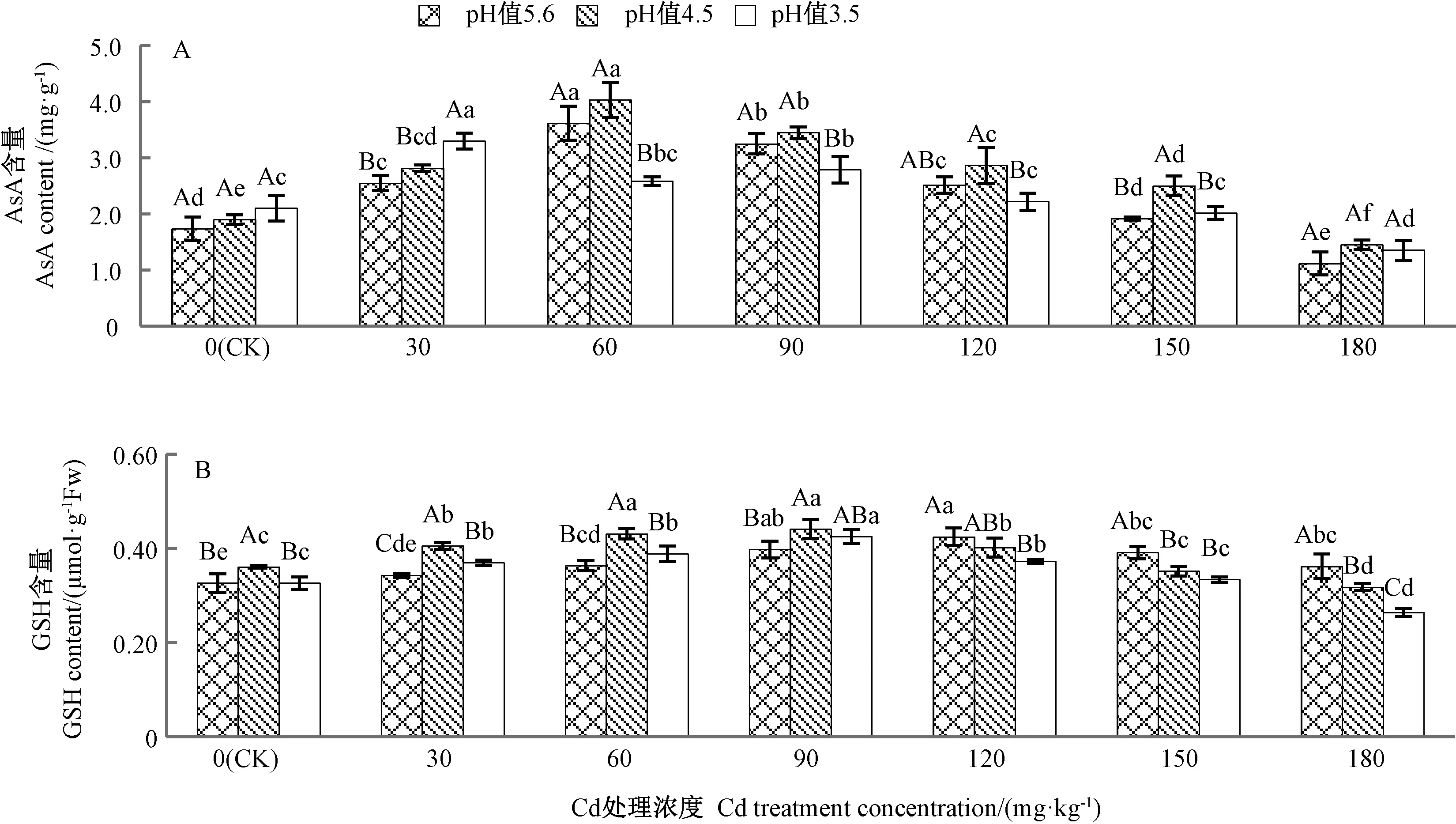
图3 Cd与酸雨复合胁迫对苦楝叶片抗坏血酸(A)、谷胱甘肽(B)含量的影响Fig.3 Effects of compound stresses of Cd and acid rain on the ASA(A)and GSH(B)content in M.azedarach leaves
由图4可知,单一Cd处理下,APX和GR活性均随着Cd处理浓度的升高呈先上升后下降的趋势,两者活性峰值分别出现在 Cd处理浓度为 120、90 mg·kg-1时,分别是 CK 的1.83、1.39 倍;单一酸雨处理下,随着pH值的降低APX活性显著升高(P<0.05),而GR活性则先上升后下降,两者最大值分别出现在酸雨pH值为3.5、4.5时,分别较CK增加25%、20%;Cd和酸雨复合处理时,同一酸雨pH值处理下,APX和GR活性均随着Cd处理浓度的升高呈先上升后下降的趋势,当Cd浓度相同时,随着酸雨pH值的降低,APX活性在Cd浓度≤90 mg·kg-1时逐渐升高,在Cd浓度≥120 mg·kg-1时则先上升后下降,而GR活性在Cd浓度≤60 mg·kg-1时先升高后降低,Cd浓度≥90 mg·kg-1时逐渐降低,复合处理中,两者活性最大值分别出现在Cd浓度90 mg·kg-1、pH值3.5和 Cd浓度60 mg·kg-1、pH 值 4.5 时,分别为 CK 的 2.00、1.44倍。结果表明,Cd浓度小于90 mg·kg-1、酸雨pH值大于3.5时,APX和GR均能保持较高活性。
3 讨论
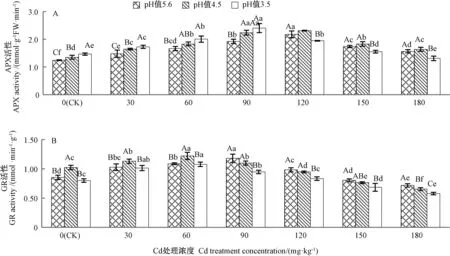
图4 Cd与酸雨复合胁迫对苦楝叶片抗坏血酸过氧化物酶(A)、谷胱甘肽还原酶(B)活性的影响Fig.4 Effects of compound stresses of Cd and acid rain on the APX(A)and GR(B)activity in M.azedarach leaves
Cd是植物的非必需元素,具有较高的活性,易被植物吸收。研究发现植物吸收过量的Cd会影响其对矿质营养的吸收、转运,抑制其生长和光合作用,改变生物量分配等[26]。酸雨中过多的H+与植物叶片表面及内部的阳离子进行交换会破坏叶组织结构和细胞结构[4],从而导致植物叶片失绿、出现坏死斑,甚至脱落。研究表明,酸雨会降低土壤pH值,加速土壤中营养元素的流失,增强重金属活性,改变微生物群落结构[27],从而加剧对植物的伤害。本研究中,单一Cd处理时,Cd对苦楝生长有低浓度(≤30 mg·kg-1)促进,高浓度(≥60 mg·kg-1)抑制的现象,这与刘柿良等[28]的研究结果一致。本研究还发现单一酸雨处理抑制了植物地上、地下部的生长,而pH值4.5的酸雨与30 mg·kg-1Cd复合处理下苦楝地上部干重仍高于 CK。这与王成聪等[29]的研究结果不一致,原因可能与酸雨中的硝酸根离子增加了土壤的含氮量,对植物产生了一定的施肥作用有关[30],而其他复合处理下的抑制作用较相应单一Cd和单一酸雨处理时更强,表明Cd和酸雨对苦楝幼苗的毒害作用具有叠加效应。本研究中,Cd处理下的苦楝幼苗根部Cd含量均显著高于茎杆和叶片。这与谭长强等[26]的研究结果一致,可能是由于植物根系截留并富集了Cd2+,缓解了Cd2+对地上部光合、呼吸作用等生理代谢的伤害。此外,酸雨和Cd复合处理下,苦楝根部、茎杆和叶片的Cd积累量均低于相应浓度的单一Cd处理,这可能是由于酸雨淋溶使土壤释放出大量的二价阳离子(如 Ca2+、Mg2+等)[2],竞争了植物根系吸收点位,从而使植物减少了Cd2+的吸收量。
三大保护性酶(SOD、CAT和POD)和抗坏血酸-谷胱甘肽循环是植物抗氧化保护系统的重要组成部分,能有效清除活性氧,保证细胞正常的生理功能。本研究中,SOD、CAT和POD活性的最大值分别出现在60 mg·kg-1Cd、pH 值 5.6,60 mg·kg-1Cd、pH 值 4.5 和90 mg·kg-1Cd、pH值4.5时,表明在胁迫程度较低情况下,SOD在活性氧清除中扮演主要角色,证实了SOD是活性氧清除的第一道防线的论证[25],可以将过量的超氧自由基歧化,形成毒性较弱的H2O2和分子态氧[31],而在强酸雨和高浓度Cd双重胁迫时则由CAT承担活性氧清除任务,证实了3种酶协同清除活性氧的机制。
在AsA-GSH循环中,APX以AsA为底物将H2O2还原为H2O,GR是生成GSH的重要酶。本研究中,单一Cd胁迫下,AsA、GSH含量和APX、GR活性均随着Cd处理浓度的升高呈先上升后下降的趋势,这与丁继军等[24]的研究结果一致。当Cd浓度≤60 mg·kg-1和pH值≥4.5时,AsA含量急剧上升至峰值,APX活性也快速升高,加速了活性氧的清除速率。AsA和GSH含量峰值分别出现在Cd处理浓度为60、90 mg·kg-1,酸雨pH值4.5时;APX和GR活性则分别在Cd浓度为 90 mg·kg-1、pH 值3.5 和 Cd 浓度为60 mg·kg-1、pH值4.5时最大,表明在Cd浓度≤90 mg·kg-1和pH值≥4.5时,AsA-GSH循环处于高效工作状态。随着胁迫程度的加深,GSH含量随着GR活性升高而逐渐增加,证实了GR活性是影响植物体内GSH含量的重要酶类;APX活性达到峰值时的胁迫浓度较AsA含量达到最大值时表现出一定的滞后性,这可能是由于APX活性的升高加速了对AsA的分解。而之后AsA含量和APX活性的降低可能与AsA-GSH循环受到抑制有关。本研究结果表明,除SOD活性在Cd浓度为180 mg·kg-1、pH值3.5时较 CK有所降低外,各处理的SOD、CAT和POD活性均高于CK;AsA-GSH循环中,除APX在高浓度Cd(180 mg·kg-1)处理下保持略高于CK的活性外,GR活性、AsA和GSH含量均显著低于CK。表明一定浓度的Cd和酸雨处理激活了苦楝抗氧化系统的活性,提高了活性氧清除物质的含量;在高浓度(180 mg·kg-1)Cd与酸雨复合胁迫下,AsA-GSH循环受到了严重的抑制,说明植物主要依靠其体内的三大保护性酶参与清除体内多余的活性氧。
4 结论
本研究结果表明,Cd胁迫下,苦楝幼苗的生物量变化表现出“低促高抑”现象,Cd处理浓度30 mg·kg-1和酸雨pH值4.5的复合处理对苦楝幼苗地上部生长具有一定的促进作用,但复合胁迫较单一Cd和单一酸雨处理对苦楝幼苗的伤害更大。酸雨和Cd复合处理下,苦楝体内的Cd含量较单一Cd处理时更低,而在高剂量Cd(≥60 mg·kg-1)和强酸雨(pH值3.5)复合处理下则表现为较单一Cd和单一酸雨处理更强的抑制现象,其机理还有待进一步研究。
