外源NO对镉胁迫下草地早熟禾种子萌发及幼苗生理特性的影响
2020-01-15鲜靖苹王海龙全永彪马晖玲
王 勇 鲜靖苹 王海龙 全永彪 刘 璐 马晖玲
(甘肃农业大学草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃兰州 730070)
一氧化氮(NO)是存在于植物体内可以调控植物基因表达的信号分子[1-2],其可以在植物细胞间和细胞内转移。植物体内NO的产生有多条途径,包括一氧化氮合成酶途径、硝酸还原酶和亚硝酸还原酶途径,以及光照下和类胡萝卜素催化亚硝酸根离子等途径[3-4]。重金属元素镉(Cd)容易被植物吸收和转运,并在植物体积累[5-6]。田丹等[7]研究发现镉离子影响生菜(Lactuca sativaL.)种子萌发,抑制其胚根和胚芽生长,进而影响幼苗根和叶的生长;何芸雨等[8]和段瑞军等[9]研究表明,镉胁迫会降低植物叶绿素含量,影响光合作用;李慧芳等[10]研究发现镉胁迫使植物体内产生大量活性氧自由基从而损伤植物组织。相对含水量和干物质量可直观反映植物在生长环境中的状态。研究表明,镉胁迫会抑制植物生长,降低干物质量和相对含水量[11-12],减少丙二醛(malondialdehyde,MDA)和脯氨酸(proline,Pro)在植物体内的累积[13-14]。大量研究发现,在重金属胁迫下,适宜浓度的外源NO可以通过提高抗氧化酶系统的活性来缓解胁迫[15],并通过促进纤维素的合成来增加植物对重金属的吸收和累积[16-17],增加叶绿素含量或者修复损伤的叶绿体从而增强植物光合作用。叶绿素中光合色素的含量直接决定其光合效率,叶绿素a/b能够反映植物类囊体的垛叠程度,垛叠程度越高越难发生光抑制,植物抵御逆境的能力也就越强[18-20]。王芳等[21]和吴旭红等[22]发现外源较低浓度NO可以增加植物干物质量和相对含水量,促进植物生长。
近年来,大量使用农药和工业发展对土壤造成了严重的镉污染[23]。草地早熟禾是被广泛应用于草坪的多年生禾本科草本植物,具有根系发达,耐踩踏等特性[24],是优良的草坪草。研究表明,草地早熟禾既可作为观赏植物[24],也可用于镉污染土壤的修复[25]。然而,关于外源NO对镉胁迫下草地早熟禾生理影响的研究尚鲜见报道。本研究外源NO处理镉胁迫的草地早熟禾,通过测定种子萌发及叶片生理变化等指标,研究可缓解草地早熟禾镉胁迫的最适硝普钠(sodium nitroprusside dihydrate,SNP)浓度,以期为重金属污染土壤的植物修复提供一定的理论依据。
1 材料与方法
1.1 试验材料
供试草地早熟禾品种为蓝月,由北京克劳沃草业技术开发公司提供。CdCl2·2.5H2O购自。以硝普钠(SNP)作为NO供体,化学式为Na2[Fe(CN)5NO]·2H2O。SNP在水中溶解产生NO和NO2-/NO3-以及Fe(CN)52-,除NO外,其他离子对植物生长均无显著影响[20]。
1.2 试验设计
1.2.1 种子萌发试验 选取颗粒饱满且大小一致的健康草地早熟禾种子若干,常温下用蒸馏水浸泡6~8 h使种子吸水,帮助破除种子休眠。70%乙醇浸泡1 min,20%次氯酸钠浸泡15 min,最后用灭菌水冲洗5~6次,晾干种子表面水分后,采用纸上发芽法[26],将用不同浓度的处理液润湿滤纸。试验分成对照组(control,CK)和处理组,其中处理组包括6个小组,各小组处理液分别为 200 μmol·L-1CdCl2·2.5H2O 和不同浓度(0、50、100、200、400、600 μmol·L-1)SNP 的混合液;CK处理液为蒸馏水。将上述用不同处理液浸润的滤纸平铺分别在90 mm的玻璃培养皿中,在每个玻璃培养皿中播种50粒种子,每个处理4次重复。每个培养皿称重记录后置于25℃培养箱中,在光照2 000 Lux、光照/黑暗16 h/8 h、相对湿度65%条件下进行培养。此后每天称重并补齐蒸发的溶液。培养15 d后测定草地早熟禾胚芽长、胚根长等指标。
1.2.2 幼苗培养试验 选取颗粒饱满,大小一致的草地早熟禾种子若干,进行种子消毒,常温下用蒸馏水浸泡6~8 h使种子吸水,帮助破除种子休眠。70%乙醇浸泡1 min,20%次氯酸钠浸泡15 min,最后用灭菌水冲洗5~6次,晾干种子表面水分后进行播种。将种子均匀撒播在填装蛭石的育苗钵(直径8 cm,高10 cm)中,每天用蒸馏水喷洒浇灌,以保持水分充足,室温培养,发芽后间苗至每钵20株,且幼苗大致分布均匀,不集中。用1/2 Hoagland营养液培养至幼苗3~4片叶时,将CdCl2·2.5H2O加入营养液中,配制成镉离子浓度为200 μmol·L-1营养液培养幼苗,对照组(control,CK)全过程用1/2 Hoagland营养液培养。同时配制0、50、100、200、400、600 μmol·L-1SNP 溶液,采用叶面喷施的方法将不同浓度SNP均匀喷洒在早熟禾幼苗叶片上,CK叶片表面喷洒蒸馏水。处理15 d后进行采样,采样时剪掉叶尖和茎,采用去除叶尖和茎秆的叶片作为试验材料。
1.3 测定指标及方法
1.3.1 种子萌发指标的测定

式中,Gt:第t天的发芽种子数;Dt:对应的种子发芽天数。
1.3.2 幼苗生理指标的测定 叶绿素含量的测定:采用95%乙醇在避光条件下浸泡草地早熟禾幼苗叶片48 h,然后分别在470、649和665 nm波长下测定吸光度值。
干物质量的测定:采用烘干法,将10株新鲜草地早熟禾叶片55℃烘4 h,再于105℃烘至恒重,称重。按照公式计算干物质量:
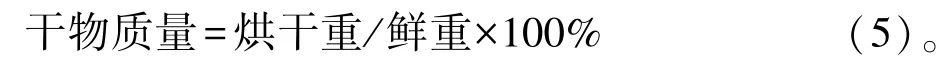
相对含水量的测定:100℃杀青15 min后,70℃烘至恒重;SOD活性采用NBT光还原法测定[27];POD活性采用愈创木酚法测定[27];CAT活性采用过氧化氢还原法测定[28];MDA含量采用TBA显色法测定[27];抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性参照陈建勋[29]的方法测定;游离脯氨酸含量采用酸性茚三酮显色法测定[27]。
1.4 数据处理
采用Microsoft Office Excel 2016整理数据和作图;SPSS 19.0分析数据,Duncan法进行多重比较。本研究数据均以平均值±标准误表示。
2 结果与分析
2.1 外源NO对镉胁迫下草地早熟禾种子萌发特性的影响
2.1.1 外源NO对镉胁迫下草地早熟禾种子发芽率、胚根胚芽长度的影响 由表1可知,50和100 μmol·L-1SNP处理下,草地早熟禾种子发芽率较CK分别显著提高 36.60%和 50.89%,而 0、200 μmol·L-1SNP 处理时其发芽率较CK降低了9.82%,但这两处理间无显著差异(P>0.05);SNP 浓度为 400 和 600 μmol·L-1时,发芽率分别较CK显著降低了83.92%和95.53%。与CK相比,不同SNP处理对草地早熟禾种子胚芽长度具有显著抑制作用。50和100 μmol·L-1SNP处理的胚芽长度较 0 μmol·L-1SNP分别显著增加了40.70%和64.60%(P<0.05)。CK的胚根长显著高于其他处理(P<0.05),但 50 和 100 μmol·L-1SNP 处理能够明显促进镉胁迫下种子胚根的生长,分别较0 μmol·L-1SNP处理增加了4.58倍和6.76倍。
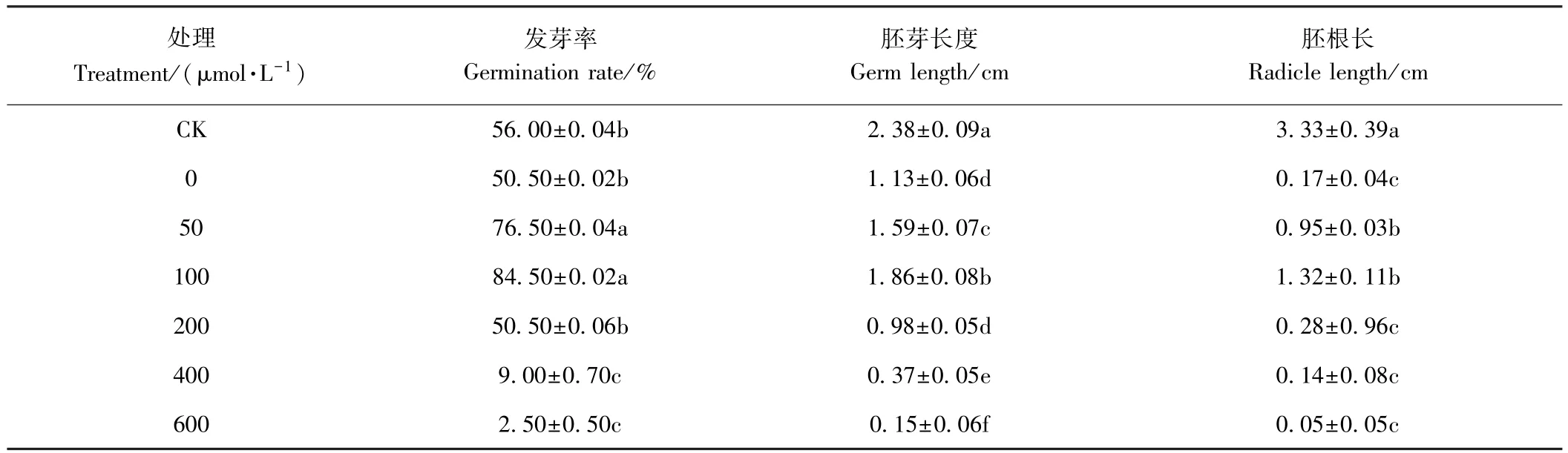
表1 外源NO对镉胁迫下草地早熟禾种子萌发及胚根和胚芽长度的影响Table 1 Effects of exogenous NO on seed germination,radicle length and germ length ofPoa pratensis under Cd stress
2.1.2 外源NO对镉胁迫下草地早熟禾种子发芽势、活力指数、发芽指数的影响 由表2可知,50和100 μmol·L-1SNP处理显著提高了早地早熟禾种子发芽势,分别较CK显著增加68.52%和79.63%,而其他处理显著降低了种子发芽势。50和100 μmol·L-1SNP处理的活力指数分别较CK增加3.98%和25.43%(P>0.05),较 0 μmol·L-1SNP 处理分别显著增加了 1.25倍和 1.71 倍(P<0.05);200 μmol·L-1SNP 处理的种子活力指数较0 μmol·L-1SNP处理增长34.39%,但差异不显著(P>0.05)。 400 和600 μmol·L-1SNP 处理的草地早熟禾种子萌发受到抑制。50和100 μmol·L-1SNP处理对发芽指数缓解效果最明显,分别较CK显著增加 52.93%和 59.35%(P<0.05),CK、0和 200 μmol·L-1SNP处理间发芽指数、差异不显著(P>0.05),400和600 μmol·L-1SNP 处理显著降低了草地早熟禾种子发芽指数,抑制了种子萌发。
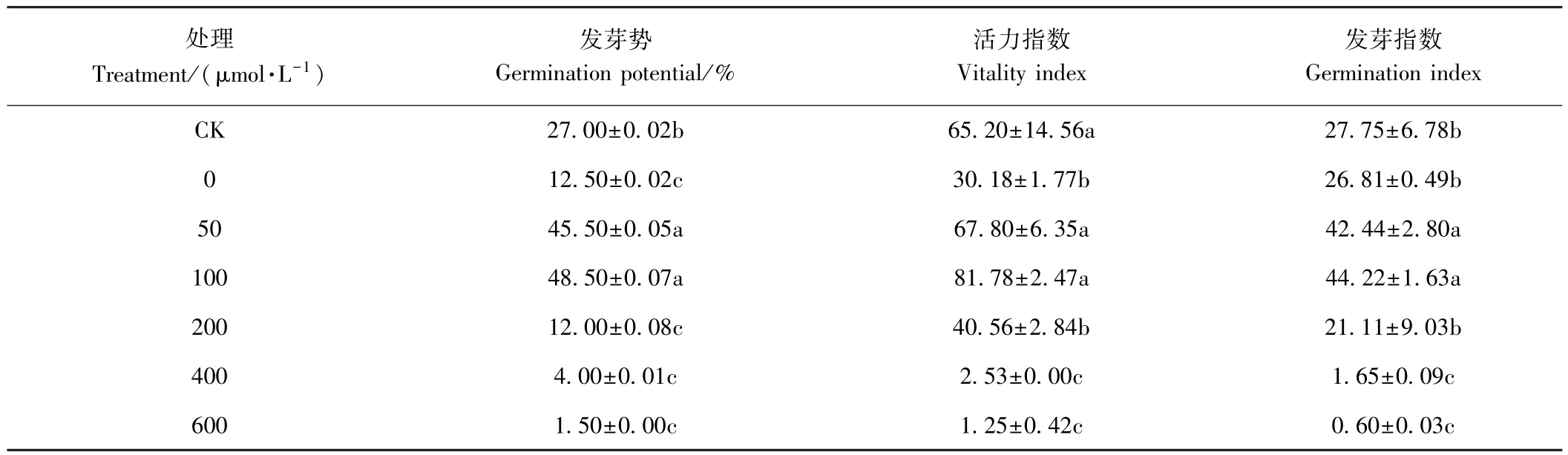
表2 外源NO对镉胁迫下草地早熟禾种子发芽势及活力指数和发芽指数的影响Table 2 Effects of exogenous NO on germination potential,vigour index and germination index of Poa pratensis seedlings under Cd stress
2.2 外源NO对镉胁迫下草地早熟禾幼苗叶片生长的影响
由图1可知,除CK的草地早熟禾幼苗干物质量和相对含水量显著高于其他处理外,随着SNP浓度的增大,草地早熟禾幼苗干物质量和相对含水量均呈先增加后减少的趋势。50和100 μmol·L-1SNP处理的干物质量较0 μmol·L-1处理分别显著增加20.11%和37.90%(P<0.05);50 和 100 μmol·L-1SNP 处理的相对含水量较0 μmol·L-1处理分别显著增加18.17%和31.70%(P<0.05)。 而200、400 和 600 μmol·L-1SNP 处理显著抑制了干物质的积累和相对含水量(P<0.05)。
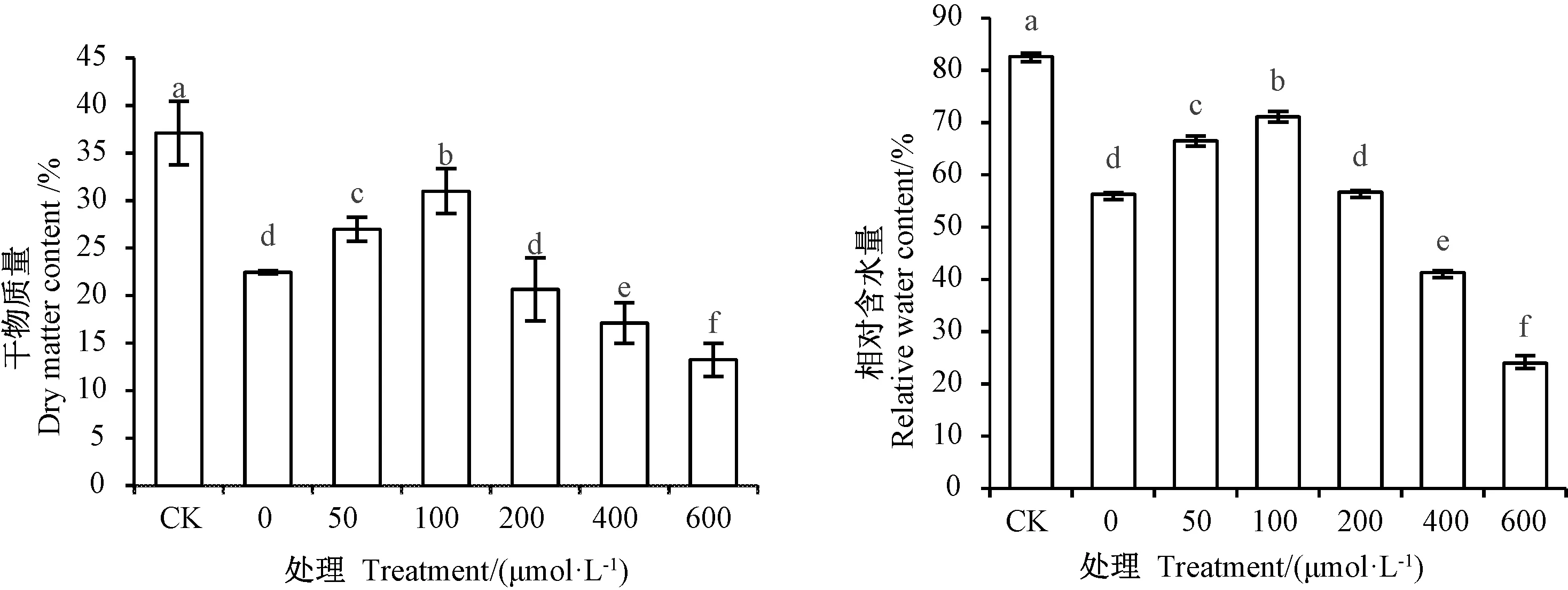
图1 外源NO对镉胁迫下草地早熟禾叶片干物质量和相对含水量的影响Fig.1 Effect of exogenous NO on dry matter content and relative water content of Poa pratensis leaves under Cd stress
2.3 外源NO对镉胁迫下草地早熟禾幼苗叶片光合色素含量的影响
由表 3 可知,200 μmol·L-1镉胁迫下施加 50、100 μmol·L-1SNP能够显著提高草地早熟禾幼苗叶片的叶绿素a、b和类胡萝卜素含量,其中叶绿素a含量较0 μmol·L-1SNP处理分别显著增加22.51%和50.21%(P<0.05),叶绿素 b含量分别显著增加5.30%和23.11%(P<0.05),类胡萝卜素含量分别显著增加28.92%和 58.86%(P<0.05)。200、400和 600 μmol·L-1SNP处理对草地早熟禾幼苗叶片各色素含量影响显著,能够抑制植物光合作用。50和 100 μmol·L-1SNP处理叶绿素a/b值与CK间均无显著差异(P>0.05),而较0 μmol·L-1SNP 处理分别显著增加16.30%和 21.85%(P<0.05);200 μmol·L-1SNP 处理叶绿素a/b值较0 μmol·L-1SNP略有降低,但差异不显著(P>0.05);400 和 600 μmol·L-1处理叶绿素 a/b值则显著低于其他SNP处理。
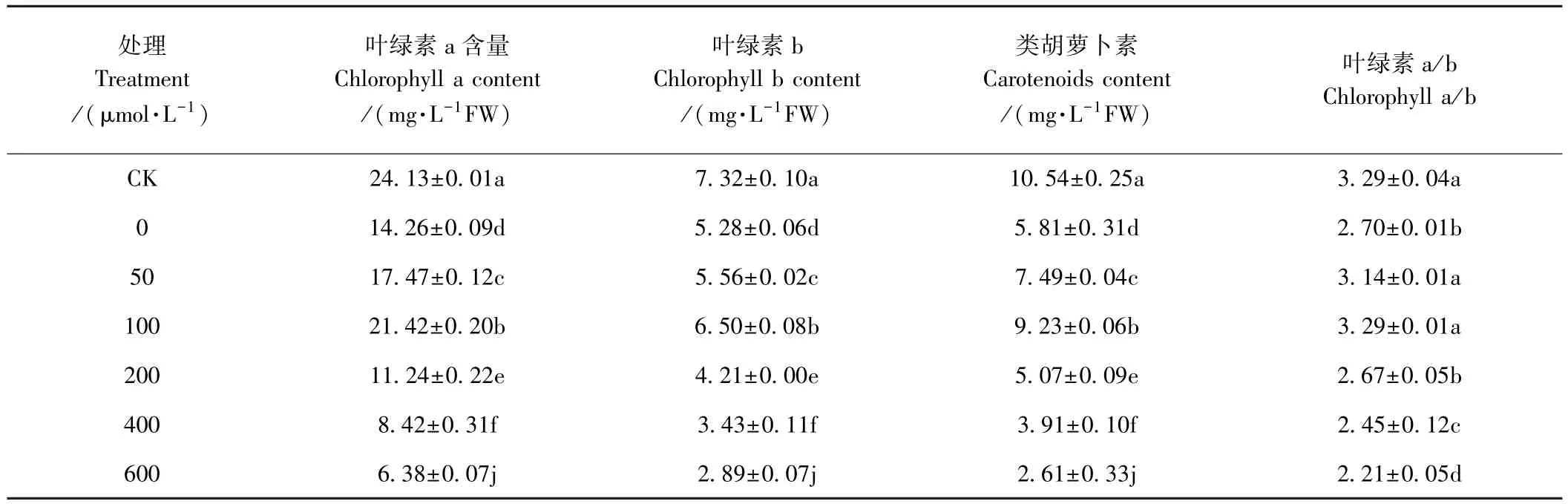
表3 外源NO对镉胁迫下草地早熟禾叶片光合色素含量的影响Table 3 Effect of exogenous NO on photosynthetic pigment contents of Poa pratensis leaves under Cd stress
2.4 外源NO对镉胁迫下草地早熟禾幼苗叶片抗氧化酶活性的影响
2.4.1 外源NO镉胁迫下草地早熟禾幼苗叶片SOD活性的影响 由图2可知,施加不同浓度SNP显著影响了SOD活性,CK的SOD活性显著高于其他处理(P<0.05)。 50和100 μmol·L-1SNP 处理的SOD 活性较0 μmol·L-1SNP处理分别显著增加 27.70%和58.61%,200、400 和 600 μmol·L-1SNP 处理则显著降低了SOD活性(P<0.05)。
2.4.2 外源NO对镉胁迫下草地早熟禾幼苗叶片CAT活性的影响 由图3可知,CK的POD活性显著高于不同浓度SNP处理,施加50和100 μmol·L-1SNP处理的CAT活性较0 μmol·L-1SNP处理分别显著增加57.38%和 83.51%(P<0.05)。 200、400和 600 μmol·L-1SNP处理均不同程度地降低了CAT活性,对草地早熟禾幼苗造成了一定伤害。
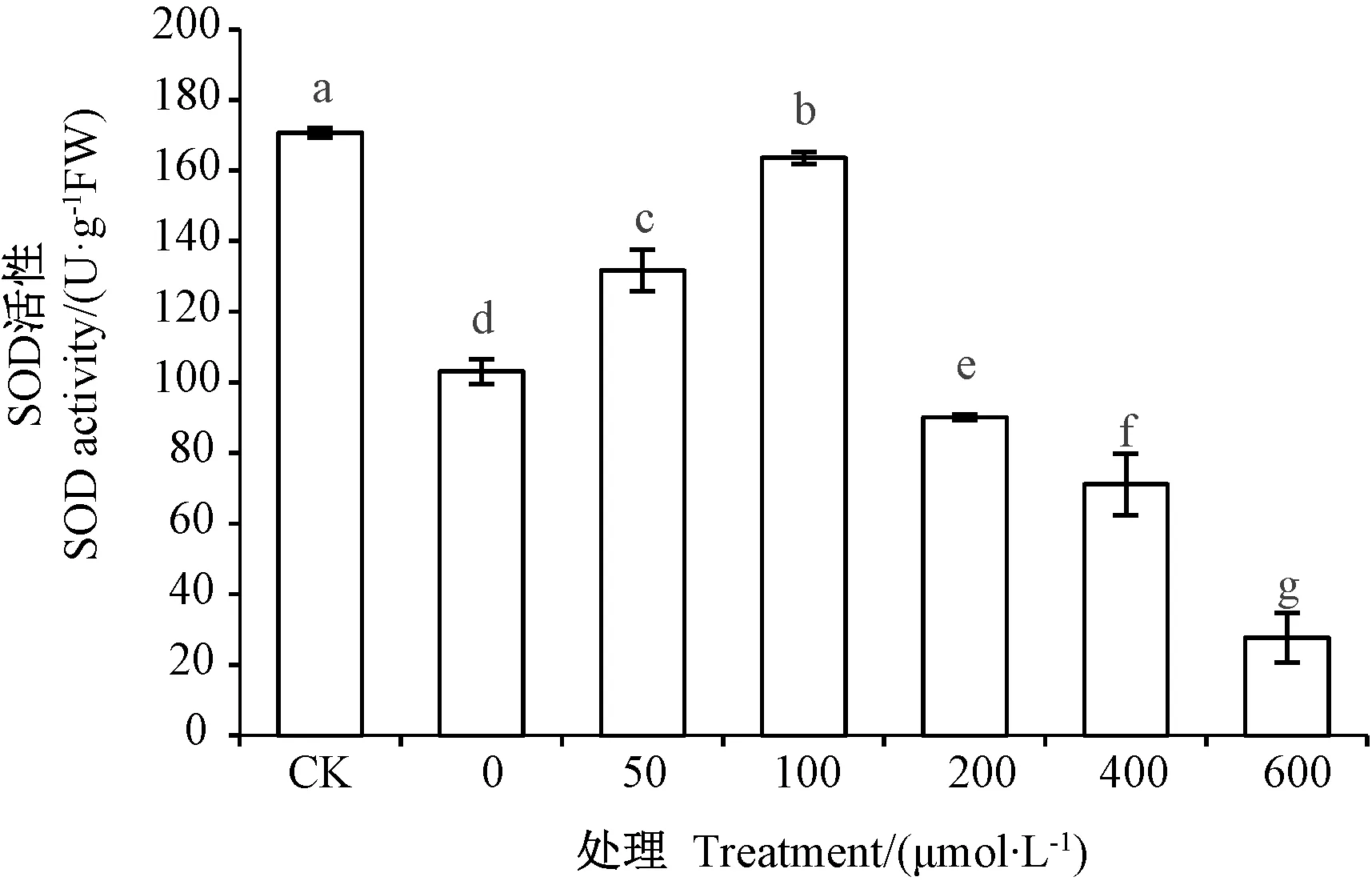
图2 外源NO对镉胁迫下草地早熟禾叶片SOD活性的影响Fig.2 Effect of exogenous NO on SOD activity ofPoa pratensis leaves under Cd stress
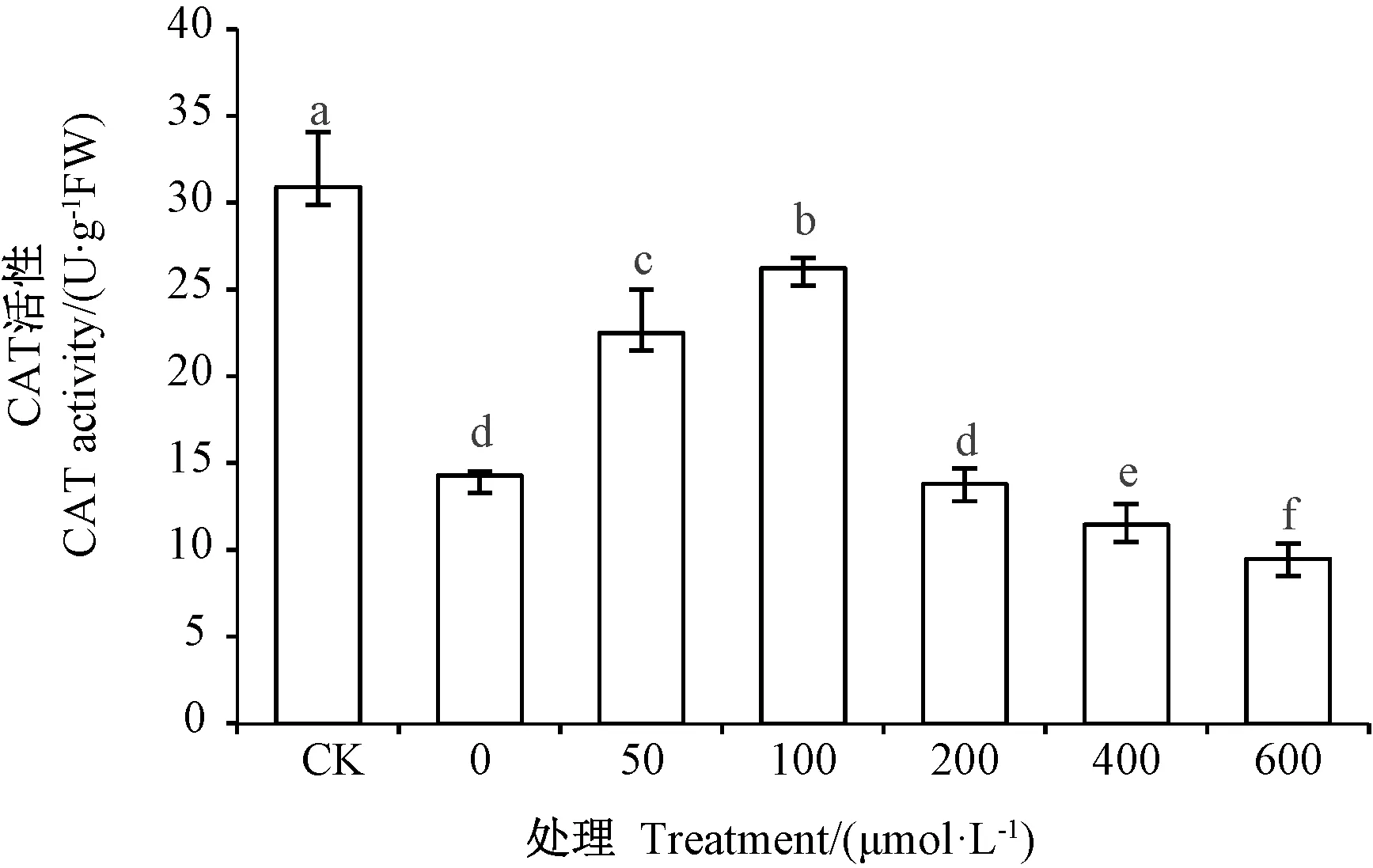
图3 外源NO对镉胁迫下草地早熟禾叶片CAT活性的影响Fig.3 Effect of exogenous NO on CAT activity of Poa pratensis leaves under Cd stress
2.4.3 外源NO对镉胁迫下草地早熟禾幼苗叶片POD活性的影响 由图4可知,50和100 μmol·L-1SNP处理的POD活性比0 μmol·L-1SNP处理分别显著增加14.76%和46.28%(P<0.05)。200、400和600 μmol·L-1SNP处理显著低于其他处理,其中 CK的POD活性最高,100 μmol·L-1SNP处理的缓解镉胁迫影响效果最显著。结果表明,低浓度SNP处理通过增强草地早熟禾过氧化物酶活性来缓解镉胁迫,但过量SNP会降低POD活性,对植物造成伤害。
2.4.4 外源对镉胁迫下草地早熟禾幼苗叶片APX活性的影响 由图5可知,镉胁迫下,随着SNP浓度的增加,APX活性呈先上升后下降的趋势。SNP浓度为100 μmol·L-1时,APX 活性显著高于其他处理(P<0.05);50 μmol·L-1SNP 处理的 APX 活性较 CK 增加6.75%,但两者差异不显著(P>0.05);100 μmol·L-1SNP处理的APX活性较CK显著增加36.71%(P<0.05),较 50 μmol·L-1SNP 处理显著增加 28.06%(P<图4 外源NO对镉胁迫下草地早熟禾叶片POD活性的影响Fig.4 Effect of exogenous NO on POD activity ofPoa pratensisleaves under Cd stress 0.05);200 μmol·L-1SNP 处理的 APX 活性较 CK 降低5.58%,但两者差异不显著(P>0.05)。而400和600 μmol·L-1SNP处理显著降低了草地早熟禾幼苗叶片的APX活性(P<0.05)。
2.5 外源NO对镉胁迫下草地早熟禾幼苗MDA、Pro含量的影响
由图6可知,镉胁迫下,随着SNP浓度的增加,MDA和Pro含量呈先减少后增加的趋势。50 μmol·L-1SNP处理的MDA和Pro含量较0 μmol·L-1SNP处理分别减少了0.63倍和0.27倍;100 μmol·L-1SNP处理的MDA和Pro含量分别较0 μmol·L-1SNP处理减少了1.51倍和0.46倍,且差异显著(P<0.05)。 200、400和600 μmol·L-1SNP处理的MDA和Pro含量显著高于其他SNP处理浓度,表现出明显的抑制作用。
3 讨论
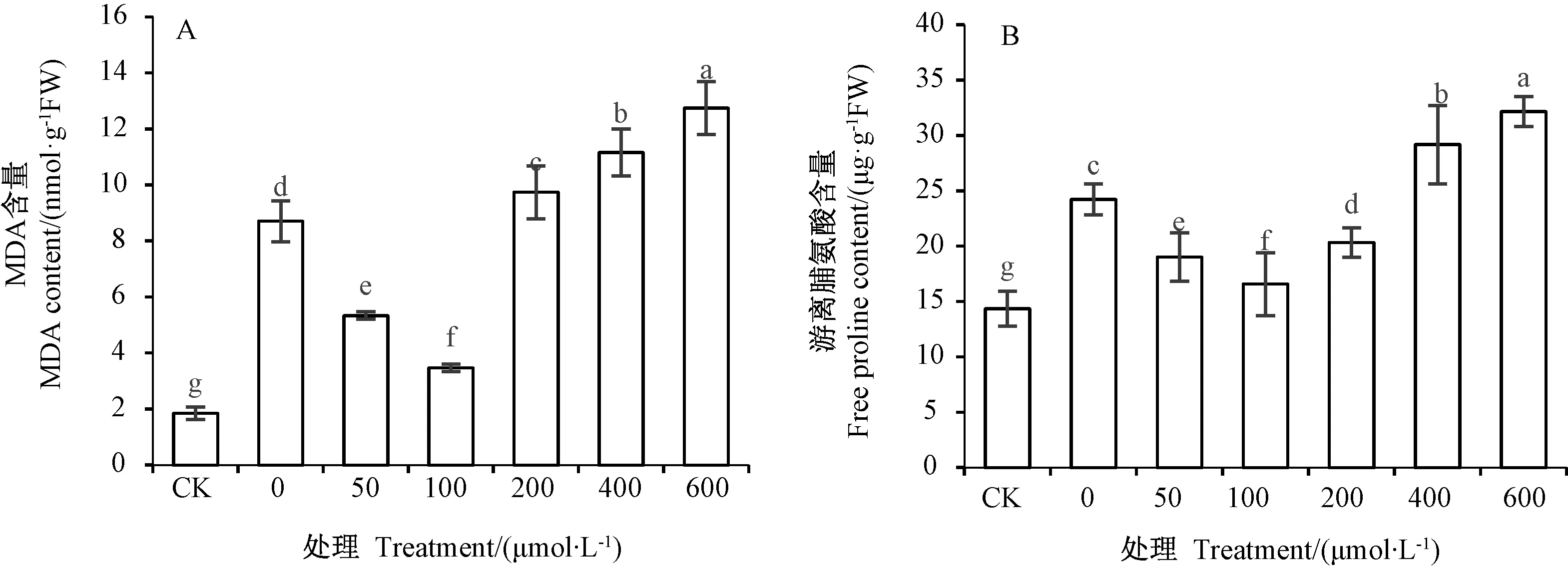
图6 外源NO对镉胁迫下草地早熟禾叶片MDA(A)和游离脯氨酸(B)含量的影响Fig.6 Effect of exogenous NO on MDA(A)and free proline(B)content in Poa pratensis leaves under Cd stress
本研究结果表明,较高浓度的镉胁迫对草地早熟禾种子的发芽率影响相对较弱,但镉胁迫对胚根和胚芽的生长有明显的抑制作用。这可能是因为种皮阻挡了镉离子进入种子,随着种子开始萌发,胚根开始生长,镉离子会在生长点附近累积,伤害根部。此外,外源NO在很大程度上促进了种子萌发,提高了种子活力。其中以100 μmol·L-1SNP处理的效果最为明显。这可能是由于NO能够提高胚根、胚芽中的抗氧化酶活性或者增加纤维素含量,从而降低了重金属镉对细胞膜脂的损伤。这与研究外源NO对黄瓜(Cucumis sativusL.)[30]、紫花苜蓿(Medicago sativa)[31]、玉竹(Polygonatumodoratum(Mill.)Druce)[32]、辣椒(Capsicum annuumL.)[33]等影响的结果一致。本研究发现,施加100 μmol·L-1SNP 可以有效缓解镉胁迫,增加早地早熟禾幼苗叶片相对含水量和干物质量,改善其生长状态。
本研究中,添加200 μmol·L-1镉离子会严重影响植物光合色素的含量,可能是镉胁迫降低了合成叶绿素所需酶的活性[34],也可能是PSⅡ反应中心的钙离子被镉离子取代从而降低了光能转化效率[35]。添加100 μmol·L-1SNP可有效缓解镉胁迫对光合作用的影响,增加叶绿素a、叶绿素b和类胡萝卜素含量,增强植物抗性,这可能是因为外源NO促进了类囊体膜蛋白的组装并提高了其稳定性[36]。
逆境胁迫使植物体内抗氧化系统平衡被破坏而产生过量的活性氧,从而造成膜脂过氧化[37]。膜脂过氧化产生的MDA越多表示胁迫越严重。Pro作为理想的渗透调节物质和自由基清除剂用来调节植物细胞的渗透平衡和清除自由基,在一定逆境条件下其含量越多表示受到的逆境胁迫越强。POD、SOD、CAT、APX可维持活性氧(reactive oxygen species,ROS)清除和产生的平衡[38],较高浓度的镉胁迫会使 POD、SOD、CAT、APX活性降低,可能是因为这些酶活性中心被镉离子占据,使得酶失去了原有的功能[39],导致ROS累积,造成氧化胁迫。镉胁迫下早熟禾体内产生大量脯氨酸,主要原因可能是脯氨酸可作为抗氧化剂清除自由基或者与重金属形成重金属螯合物减轻重金属活性[40]。 本研究中,施加 100 μmol·L-1SNP 可显著提高镉胁迫下草地早熟禾幼苗叶片中的POD、SOD、CAT和APX活性,降低脯氨酸的累积。这可能是由于外源NO一方面会提高POD、SOD、CAT和APX活性[41],另一方面外源NO可直接参与清除ROS[42]。
4 结论
适宜浓度的外源NO可以有效缓解镉胁迫对草地早熟禾造成的伤害,促进种子萌发,增加叶绿素光合色素含量,减少MDA和游离脯氨酸的累积,提高POD、SOD、CAT和APX活性,减轻细胞膜脂损伤,增加干物质含量和相对含水量,进而促进草地早熟禾生长。
