离子液体[C3mim]BF4对小白菜幼苗抗氧化特性的影响
2020-01-15阮亚男邢晓琳崔智昕
阮亚男 韩 阳 邢晓琳 崔智昕 孟 靖
(辽宁大学生命科学院,辽宁沈阳 110036)
离子液体是由有机阳离子与有机或无机阴离子构成,在室温或者使用温度下呈液态的一种新型的有机溶剂[1],因其环境友好的特性而被称为绿色溶剂,在化学工程、生物技术、材料、液态晶体等多个领域都有广阔的应用前景[2]。离子液体不易挥发,在空气中稳定性高,不易造成大气污染,但其在水体中溶解度高,极易造成水体污染。离子液体的深入研究及广泛应用发现[2],离子液体在意外泄露、工业污水排放等情况下易通过水循环进入生态系统,对水生生物及土壤生态系统造成影响,最终威胁人类健康。因此,离子液体环境友好型及其对环境和生物安全性受到了广泛关注[3]。
咪唑类离子液体具有电导率高、粘度高的特点,是目前广泛应用的绿色溶剂之一。该离子液体在水体及土壤中的生物降解性较差,具有生物毒性[4],其毒性与取代基烷基链长度成正比,对植物、土壤微生物、土壤动物等都具有一定的毒害作用。研究发现离子液体对植物的生长发育有抑制作用,进入植物体可与生物大分子蛋白和DNA直接或间接发生反应,影响DNA及蛋白质结构的稳定性,损坏细胞壁、增大细胞膜透性,引发毒性反应。但离子液体亦可影响植物叶绿素a的产生,诱发氧化应激,以应对非生物胁迫的影响[4-5]。在植物启动抗氧化系统的同时,抗氧化系统主要酶及相关的抗逆基因表达必然受到影响。目前,关于离子液体对植物影响的研究已有大量报道[4-5],但多集中在个体水平,而在分子转录水平的相关研究尚鲜见报道。本试验以我国各地普遍栽培的蔬菜作物小白菜为试验材料,研究离子液体1-丙基-3-甲基咪唑四氟硼酸([C3mim]BF4)对其种子萌发、幼苗生长、抗氧化系统的影响及其分子机制,以期为揭示咪唑类离子液体毒性机理提供理论依据。
1 材料与方法
1.1 试验材料与试剂
供试小白菜(Brassica campestrisL.ssp.chinensisMakino)品种为青梗1号,购自辽宁省沈阳农业大学农资站。
离子液体[C3mim]BF4,结构如下:
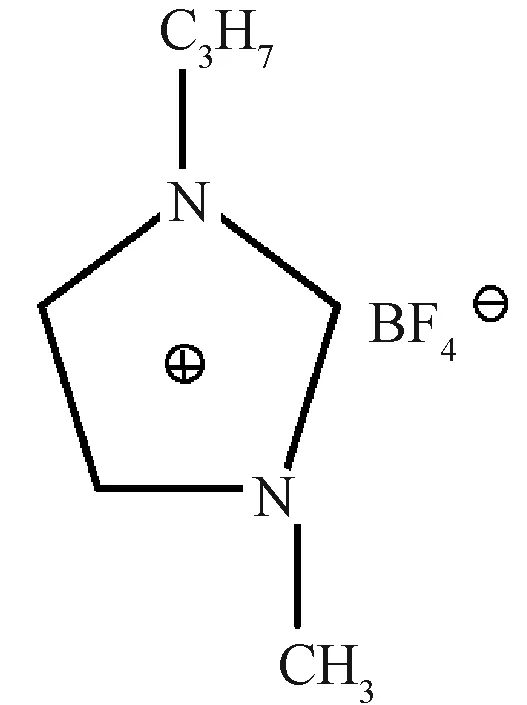
由辽宁大学关伟教授提供,其核磁共振氢谱和文献[6]相符,样品纯度99%。其他试剂均为分析纯,购自上海生物工程有限公司。
1.2 测定指标与方法
1.2.1 试验材料的培养 选取颗粒饱满的小白菜种子,用0.1%HgCl2浸泡10 min,无菌水反复冲洗3次。分别用 0(CK)、100、200、300、400、500 mg·L-1[C3mim]BF4水溶液浸泡种子12 h,将浸泡处理过的种子平铺在滤纸上,每皿铺入100粒。在培养皿中加入20 mL含对应浓度[C3mim]BF4的Hoagland营养液,以后每天向培养皿中添加相应的营养液1次,每次5 mL。将培养皿放在人工气候箱中,24±1℃恒温培养,每天光照时间12 h。每个处理3次重复。
1.2.2 发芽率和株高的测定
于培养第7天按照公式计算发芽率:

于培养第20天,从每个浓度的3个平行中,各随机取10株小白菜幼苗,用于测定株高。株高为从茎基部到最长叶片的长度。
1.2.3 生理生化指标的测定 于培养第20天,在每个浓度的3个平行中随机取样进行生理指标测定。超氧阴离子自由基()产生速率采用羟胺法[7]进行测定;过氧化氢(H2O2)含量测定采用硫酸钛法[8];丙二醛(malondialdehyde,MDA)含量测定采用硫代巴比妥酸法[9];脯氨酸(proline,Pro)含量测定采用酸性茚三酮法[10];超氧化物歧化酶(superoxide dismutase,SOD)活性测定采用氮蓝四唑蓝(nitroblue tetrazolium,NBT)光还原法[11];过氧化氢酶(catalase,CAT)活性测定采用紫外吸收法[12];抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性测定采用紫外分光光度法[13];谷胱甘肽还原酶(glutathione reductase,GR)活性测定采用紫外分光光度法[14]。
1.2.4 RNA提取和RT-PCR分析 选取颗粒饱满的小白菜种子,用0.1%HgCl2消毒后用无菌水浸泡12 h,然后铺在培养皿中,每皿100颗。在培养皿中加入Hoagland营养液20 mL,直至发芽。在培养第7天,用含400 mg·L-1[C3mim]BF4的Hoagland营养液培养幼苗,随后每天向培养皿中添加相应的营养液1次,每次5 mL。培养条件:24±1℃,光照时间为每天12 h。分别于[C3mim]BF4处理 0、1、3、6、12、24 h 和 13 d 时取小白菜幼苗叶片,立即置于液氮中冷冻,并保存于-80℃冰箱。采用植物总 RNA提取试剂盒(华越洋生物公司生产)提取材料的总RNA,并反转录成cDNA。
参考钟友明[15]的引物序列(表1),扩增小白菜Cu/Zn-SOD(AF071112)、APX(GQ500125)和CAT(U68219.2)。以β-actin(GQ339782)作为内参,调整每个处理的cDNA模板量一致。PCR扩增体系为25 μL,包括 0.5 μL Taq,10 mmol·L-1dNTP Mixture 0.5 μL,5 μmol·L-1正向引物和 5 μmol·L-1反向引物各 0.5 μL,40 ng·μL-1cDNA 模板 2.5 μL,18 μL ddH2O。PCR扩增程序:94℃预变性 5 min;94℃变性 30 s,54℃退火30 s,72℃延伸1 min,35循环;72℃延伸10 min。所有PCR产物进行1%琼脂糖凝胶电泳检测。
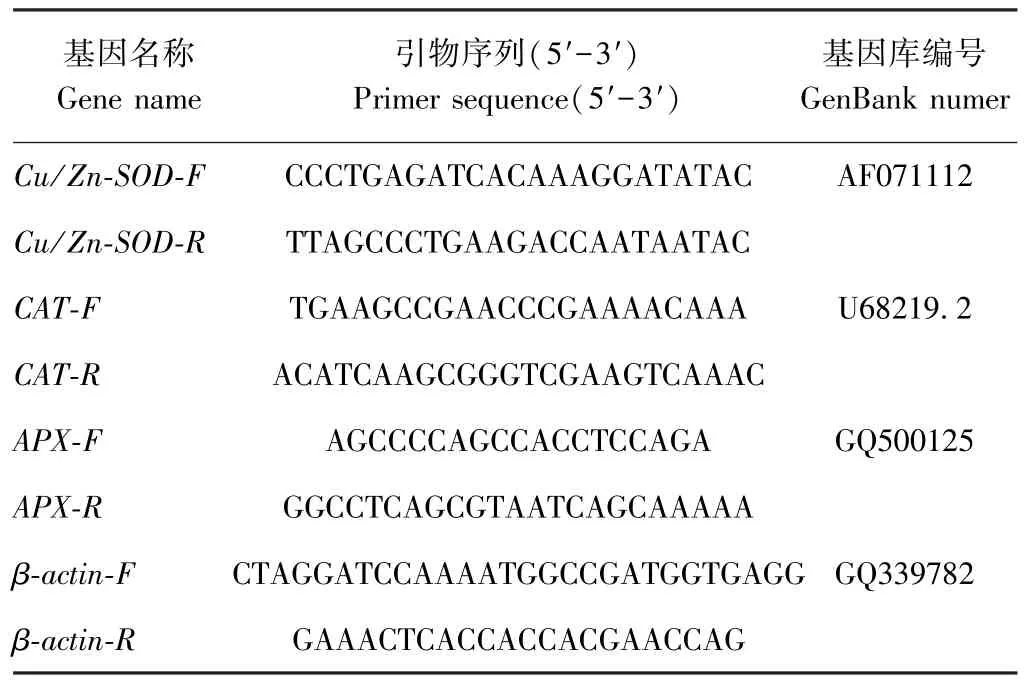
表1 RT-PCR引物序列Table 1 RT-PCR primers information
1.3 数据处理
采用SPSS 17.0软件进行单因素方差分析;LSD进行多重比较,显著性以P值表示,P<0.05表示差异显著。RT-PCR电泳图条带采用Image J软件进行灰度值分析。
2 结果与分析
2.1 [C3mim]BF4浓度对小白菜发芽率和株高的影响
由表2可知,100~300 mg·L-1[C3mim]BF4对小白菜种子萌发无显著影响,发芽率与CK相比无显著差异;而400~500 mg·L-1[C3mim]BF4处理组种子发芽率显著低于CK,且500 mg·L-1[C3mim]BF4处理的发芽率显著低于400 mg·L-1[C3mim]BF4处理组。表明较低浓度[C3mim]BF4对小白菜种子萌发无影响,而300~500 mg·L-1[C3mim]BF4则抑制种子萌发。
株高变化是植物遭受胁迫时从外观上表现的症状之一。100~400 mg·L-1[C3mim]BF4处理组小白菜株高与CK间无显著差异,而500 mg·L-1[C3mim]BF4处理组小白菜株高较CK显著降低36.74%(P<0.05)。说明100~400 mg·L-1[C3mim]BF4对小白菜幼苗生长无显著影响,而高浓度[C3mim]BF4则抑制幼苗生长。不同浓度[C3mim]BF4对小白菜种子萌发和幼苗生长的影响存在差异,其中400 mg·L-1[C3mim]BF4抑制小白菜种子萌发,500 mg·L-1[C3mim]BF4抑制了小白菜种子萌发和幼苗生长,且其对幼苗生长的抑制作用大于对种子萌发的影响,此结果符合植物发育的不同阶段抗性不同的特点。
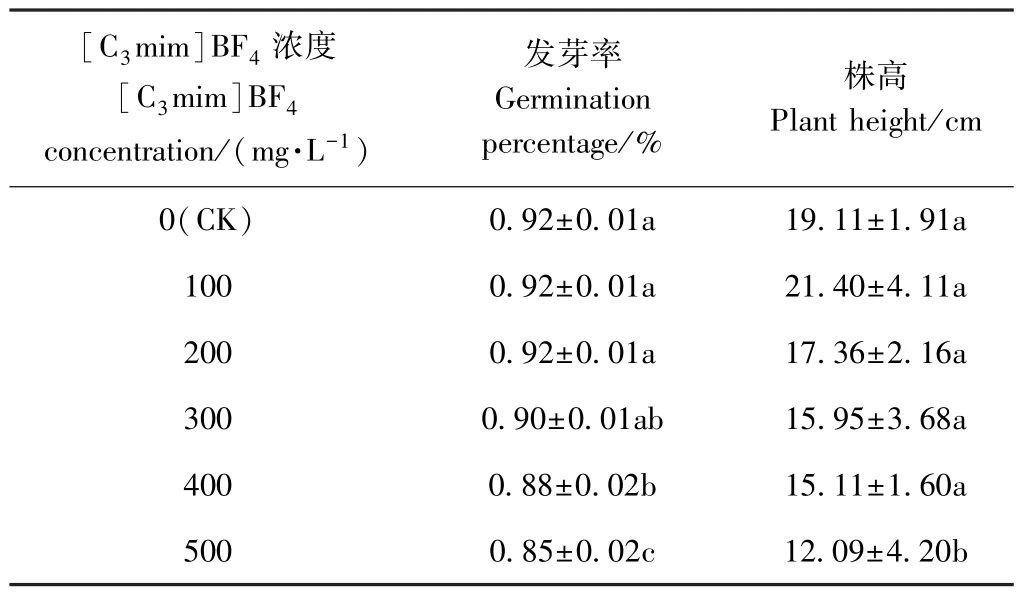
表2 [C3mim]BF4浓度对小白菜发芽率和株高的影响Table 2 Effect of[C3mim]BF4concenation on germination percentage and plant height of pakchoi
2.2 [C3mim]BF4浓度对小白菜幼苗活性氧生成的影响
由图1可知,随着[C3mim]BF4浓度的增加,小白菜叶片超氧阴离子自由基()产生速率逐渐升高,500 mg·L-1[C3mim]BF4处理组产生速率最高,较CK 高17.59%。 除200、300 mg·L-1[C3mim]BF4处理组间产生速率无显著差异外,其他各处理间均差异显著。
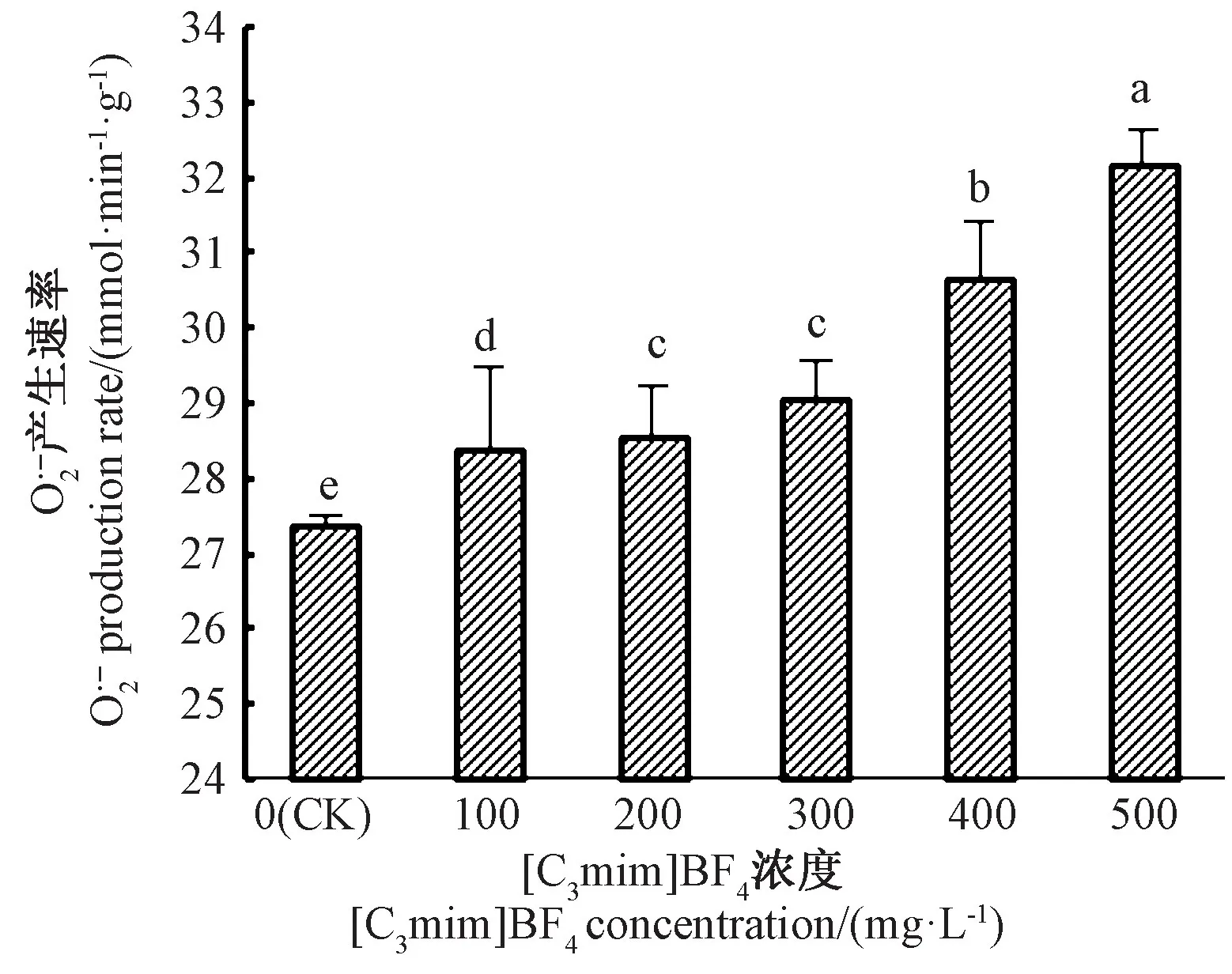
图1 [C3mim]BF4浓度对小白菜幼苗O2-产生速率的影响Fig.1 Effects of the concentration of[C3mim]BF4on the rate of O2-production in pakchoi seedlings
由图2可知,随着[C3mim]BF4浓度的增加,小白菜幼苗H2O2含量也逐渐升高,500 mg·L-1[C3mim]BF4处理组H2O2含量最高。100 mg·L-1[C3mim]BF4处理组 H2O2含量显著低于 CK;200、300 mg·L-1[C3mim]BF4处理组H2O2含量与CK间无显著差异;而 400、500 mg·L-1[C3mim]BF4处理组 H2O2含量显著高于CK,其中500 mg·L-1[C3mim]BF4处理组H2O2含量为CK的128%。结果表明,[C3mim]BF4能诱发小白菜幼苗细胞内活性氧的生成,而活性氧代谢失调最终将造成细胞结构的损伤。
2.3 [C3mim]BF4浓度对小白菜幼苗MDA含量的影响
MDA是脂质过氧化的最终产物。由图3可知,100~300 mg·L-1[C3mim]BF4处理对小白菜叶片MDA含量无显著影响,继续增加[C3mim]BF4浓度,MDA含量显著升高,400和500 mg·L-1[C3mim]BF4处理组幼苗MDA含量分别是CK的233%和255%。结果表明,[C3mim]BF4浓度高于400 mg·L-1时能加速小白菜幼苗脂质过氧化进程。
2.4 [C3mim]BF4浓度对小白菜幼苗脯氨酸含量的影响
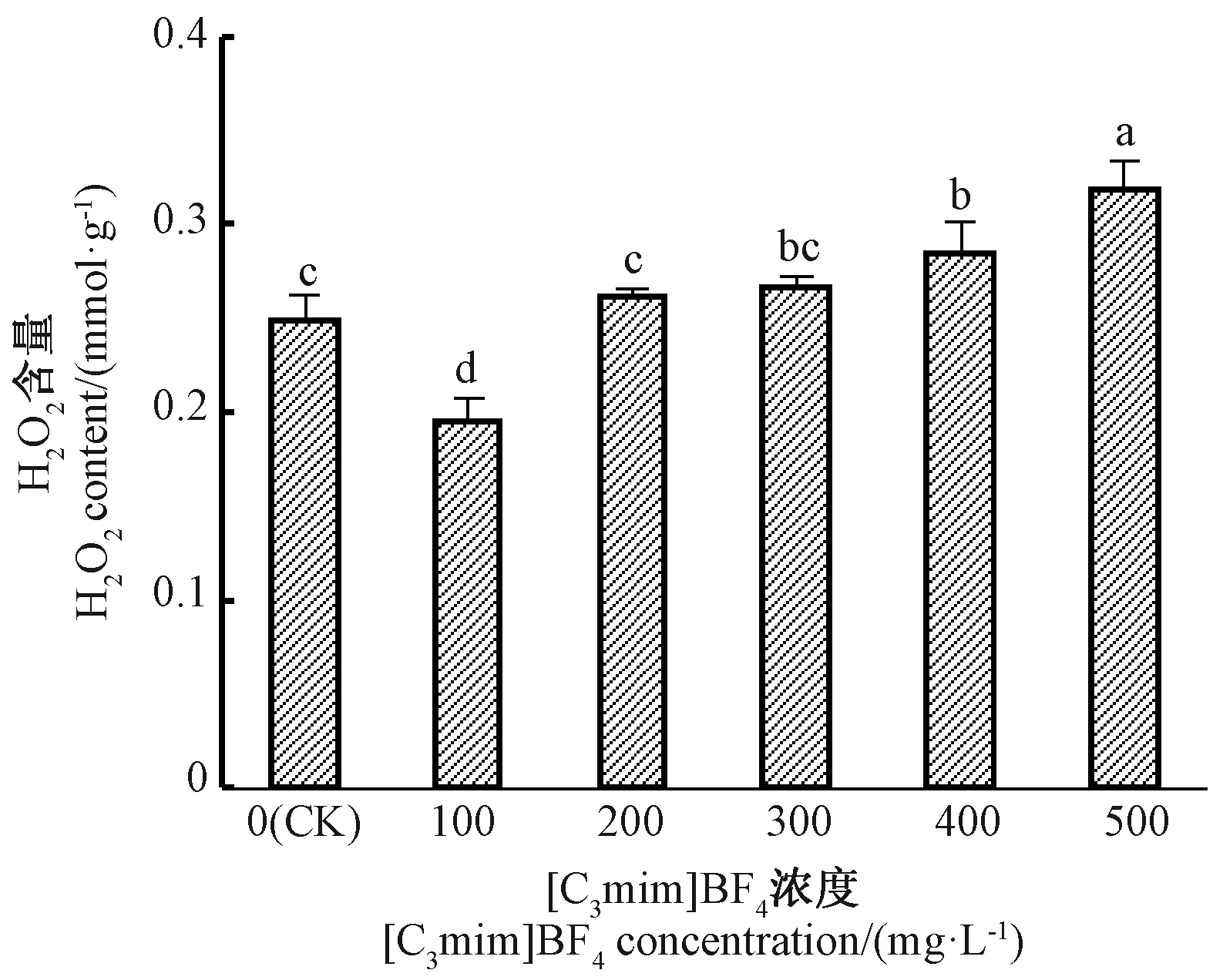
图2 [C3mim]BF4浓度对小白菜幼苗H2O2含量的影响Fig.2 Effect of the concentration of[C3mim]BF4on H2O2content in pakchoi seedlings
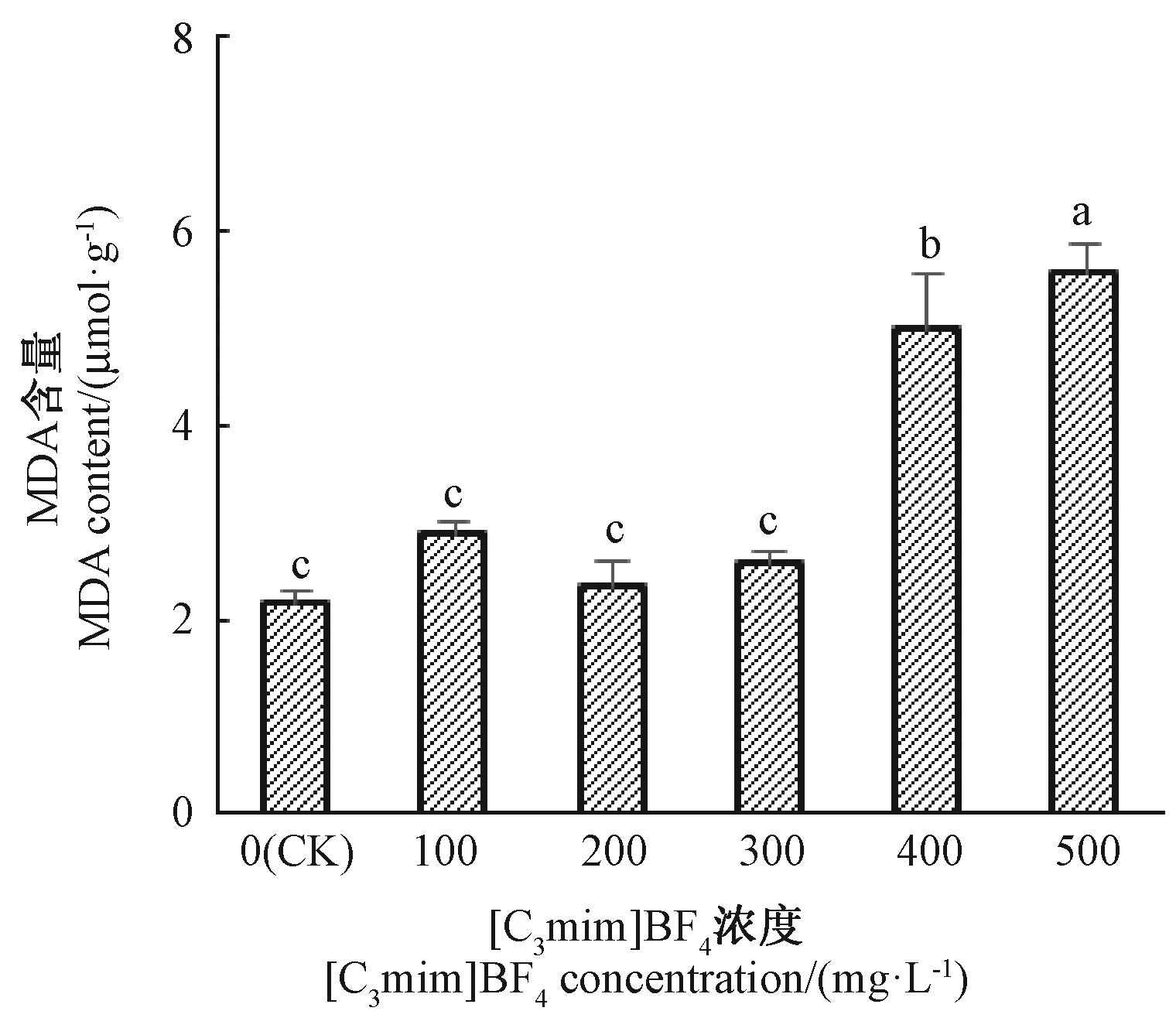
图3 [C3mim]BF4浓度对小白菜幼苗MDA含量的影响Fig.3 Effect of the concentration of[C3mim]BF4on MDAcontent in pakchoi seedlings
脯氨酸是最有效的渗透调节物质之一,以游离态广泛分布在植物细胞中;在多种逆境下,植物体内积累脯氨酸。由图4可知,100~500 mg·L-1[C3mim]BF4处理组小白菜叶片的脯氨酸含量较CK显著升高,其中,500 mg·L-1[C3mim]BF4处理组脯氨酸含量最高,是 CK 的 1.67倍。 除200、300 mg·L-1[C3mim]BF4处理组间脯氨酸含量无显著差异外,其他各处理间均存在显著差异,且随着[C3mim]BF4浓度的增加,脯氨酸含量呈逐渐升高的趋势。综上表明,离子液体[C3mim]BF4对小白菜细胞构成了胁迫。
2.5 [C3mim]BF4浓度对小白菜幼苗抗氧化酶活性的影响
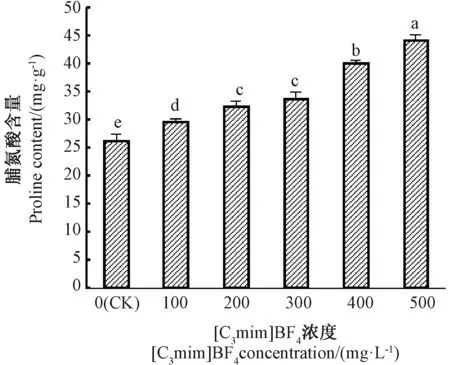
图4 [C3mim]BF4浓度对小白菜幼苗脯氨酸含量的影响Fig.4 Effects of the concentration of[C3mim]BF4 on proline content in pakchoi seedlings
由表3可知,100~500 mg·L-1[C3mim]BF4处理下,小白菜叶片的SOD、CAT、APX和GR活性均呈先上升后下降的趋势。300 mg·L-1[C3mim]BF4处理组小白菜叶片的SOD活性最高,较500和100 mg·L-1[C3mim]BF4处理组分别高21.13%、11.09%。各处理组的 SOD活性均显著低于 CK,其中 500 mg·L-1[C3mim]BF4处理组仅为 CK的77.03%,说明[C3mim]BF4处理抑制了小白菜叶片的SOD活性。300 mg·L-1[C3mim]BF4处理组CAT活性最高,是CK的2.45倍;当[C3mim]BF4浓度为 400 mg·L-1时,小白菜叶片组织中CAT活性下降;当[C3mim]BF4浓度为500 mg·L-1时,CAT活性受到抑制,为 CK的36.69%。300 mg·L-1[C3mim]BF4处理组APX活性最高,是CK的1.98倍,是500 mg·L-1[C3mim]BF4处理组的8.32倍。100 mg·L-1[C3mim]BF4处理组小白菜叶片中APX活性与CK无显著差异;200、300 mg·L-1[C3mim]BF4处理组APX活性较CK显著增加,表明此时APX被激活,然而[C3mim]BF4浓度为400~500 mg·L-1时,APX 活性又显著低于 CK。 400 mg·L-1[C3mim]BF4处理组小白菜叶的GR活性最高,为CK的7.48倍。各处理组的GR活性均显著高于CK,且各处理间差异显著。
2.6 [C3mim]BF4对抗氧化酶基因表达的影响
由图5、表 4可知,400 mg·L-1[C3mim]BF4处理小白菜 1、3、6、12、24 h 和 13 d 后,随着处理时间的延长,Cu/Zn-SOD表达量呈先升高再下降趋势,表达量最高点出现在处理1 h时,其表达量是对照(以0 h为对照)的107.37%,随后表达量逐渐下调,但是在处理3 h时仍然高于对照,是对照的102.79%。处理6 h时,Cu/Zn-SOD表达量已经低于对照;处理13 d时,基因表达量仅为对照的64.54%。表明离子液体的长时间处理会导致Cu/Zn-SOD表达量降低,且处理时间越长对Cu/Zn-SOD表达量的抑制作用越强。

表3 [C3mim]BF4浓度对小白菜幼苗抗氧化酶系的影响Table 3 Effect of the concentration of[C3mim]BF4on antioxidant enzyme series in pakchoi seedlings
400 mg·L-1[C3mim]BF4对CAT和APX表达的影响与Cu/Zn-SOD相似,随着处理时间的延长,CAT和APX基因表达量均呈先升高再下降的趋势,且处理时间越长对抗氧化酶基因表达的抑制作用越强。不同在于,CAT和APX表达最高点出现在处理3 h,此时CAT和APX表达量分别是对照的125.74%和105.39%。处理6 h时,APX表达量已经低于对照;而处理6、12 h时CAT表达量仍高于对照。处理13 d时,其CAT和APX表达量均显著低于对照,分别为对照的75.00%和16.16%。比较[C3mim]BF4对3种抗氧化酶基因表达的影响可知,[C3mim]BF4对APX基因表达的抑制作用更强。
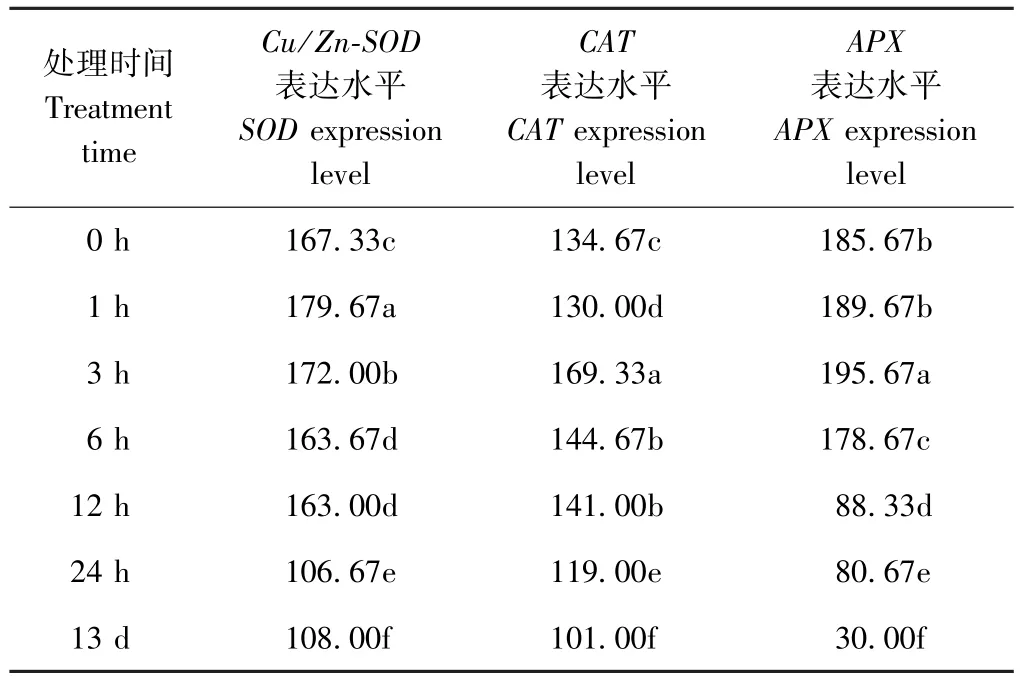
表4 离子液体[C3mim]BF4处理时间对小白菜叶片抗氧化酶基因表达的影响(灰度值)Table 4 Effect of[C3mim]BF4treatment time on gene expression of antioxidant enzymes in leaves of pakchoi seedlings(grayscale value)
3 讨论
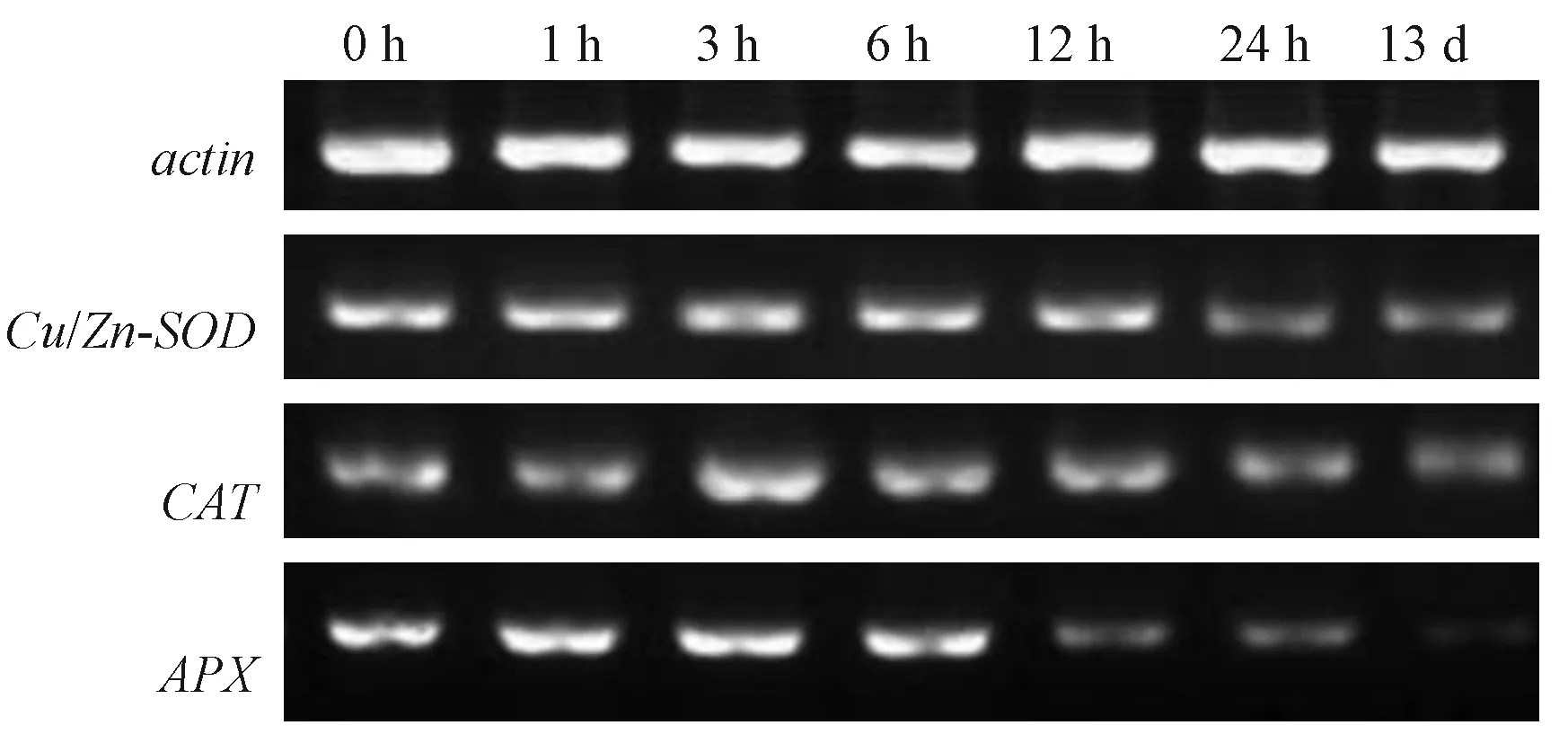
图5 [C3mim]BF4处理时间对小白菜叶片抗氧化酶基因表达的影响Fig.5 Effect of[C3mim]BF4treatment time on gene expression of antioxidant enzymes in leaves of pakchoi seedlings
幼苗期是植物对外界环境因素最敏感的时期,离子液体对幼苗生长有抑制作用。由于离子液体的不同及植物材料的不同,抑制作用的起始浓度及各浓度下的抑制率存在较大差异[16-18]。本研究中,100~400 mg·L-1[C3mim]BF4对小白菜幼苗生长无显著影响,而500 mg·L-1[C3mim]BF4抑制幼苗生长。杨芬芬等[19]研究发现100~1 000 mg·L-1浓度范围内离子液体丁基甲基咪唑氯([BMIM]C1)、丁基甲基咪唑溴[EMIM]Br、1,3二甲基咪唑磷酸二甲酯盐([MMIM][DMP])和乙基甲基咪唑硫酸单乙酯盐([EMIM][Es])对小白菜的发芽率和发芽势均未产生明显影响,这与本研究结果不同。本研究中,浓度高于400 mg·L-1的[C3mim]BF4对小白菜种子发芽率产生了抑制。这可能与不同类型的离子液体毒性不同有关。
植物在正常生长状态下,体内可以产生适量的活性氧(reactive oxygen species,ROS),且ROS的产生和消除处于一种动态平衡,即植物体内自身可以清除ROS。但当植物遭遇干旱、冷冻、盐碱等不良环境时,体内ROS产生和消除的动态平衡会被破坏,进而导致生物体内ROS的过量积累[20],对植物的生长发育产生影响[21-23],如对生物大分子的破坏及生物膜的过氧化等,甚至造成细胞功能发生障碍而死亡[24]。抗氧化酶系统在植物ROS清除过程中发挥着重要作用,其中SOD 催化转化为 H2O2和O2;CAT催化H2O2分解为H2O和O2;APX是植物AsA-GSH氧化还原途径的重要组分,也是清除H2O2(特别是叶绿体中的 H2O2)的关键酶,还是抗坏血酸代谢的主要酶类。本试验中,不同浓度的[C3mim]BF4处理使小白菜叶片产生速率和H2O2含量显著升高,且与离子浓度呈正相关,表明[C3mim]BF4作为一种刺激物引发了活性氧的生成。小白菜叶片CAT和APX活性均呈先升高后降低的趋势,说明较低浓度的[C3mim]BF4对抗氧化酶生成有一定的促进作用。高浓度(500 mg·L-1)[C3mim]BF4处理显著抑制了小白菜叶片SOD、CAT和APX活性,这与500 mg·L-1[C3mim]BF4抑制小白菜生长,促进和H2O2的产生相对应,但与前人在小麦[25]、大麦[26]、蚕豆[27]、玉米[5]上的研究结果不完全相同。这不仅与植物材料对离子液体的敏感程度有关,还与离子液体的毒性相关。GR作为调节谷胱甘肽代谢的关键酶,其抗氧化胁迫作用体现在通过抗坏血酸-谷胱甘肽循环使植物体内2种重要的非酶抗氧化剂-谷胱甘肽和抗坏血酸得以再生[28]。离子液体[C3mim]BF4使小白菜叶片GR活性显著升高,均高于CK。本研究中几种抗氧化酶对[C3mim]BF4的响应幅度及趋势不同,表明不同抗氧化酶对[C3mim]BF4的敏感性不同,SOD对[C3mim]BF4的应激敏感性高于CAT、APX和GR。此外,SOD、APX和CAT活性与其基因表达量之间存在不同步的现象,特别是CAT活性与其基因,这可能是因为本研究仅检测了Cu/Zn-SOD、CAT1、APX1的表达情况,而它们的表达产物只是 SOD、APX和CAT同工酶中的一种,不能代表全酶系。本研究还发现400 mg·L-1[C3mim]BF4处理超过3 h会降低Cu/Zn-SOD和APX基因表达量,且随着处理时间的延长,[C3mim]BF4对抗氧化酶的抑制作用越明显,这与400 mg·L-1[C3mim]BF4对SOD和APX活性的抑制效果一致。
MDA是膜质过氧化的产物,细胞中MDA含量可反映细胞内脂质过氧化的程度,进而反映细胞受损的程度,其产生量已成为鉴别细胞伤害的指标之一。本研究中,100~300 mg·L-1[C3mim]BF4对叶片MDA含量无显著影响;当[C3mim]BF4浓度高于400 mg·L-1时小白菜叶片MDA含量显著升高。综合考虑[C3mim]BF4对叶片活性氧和抗氧化酶的影响,发现在100~300 mg·L-1[C3mim]BF4处理下,小白菜细胞内ROS浓度和抗氧化酶含量同时增加,抗氧化酶及时淬灭了离子液体诱发的ROS,保护了脂质和细胞结构的完整性;而较高浓度的[C3mim]BF4破坏了植物体内的ROS代谢平衡,抗氧酶及非酶抗氧化物无法清除细胞内的ROS,导致膜质过氧化程度加重,细胞受到严重损伤。
4 结论
本研究结果表明,[C3mim]BF4浓度越大,其对小白菜生长的影响越强。总体来看,[C3mim]BF4浓度高于400 mg·L-1会显著抑制小白菜种子萌发、抗氧化酶活性。较高浓度离子液体对活性氧生成的促进和对抗氧化酶基因表达的抑制造成了植物体内活性氧代谢平衡的失调。
