低温法检测菜籽油黄曲霉毒素B1的研究
2020-01-14姜学涯高荣航梁景文苑婷婷
姜学涯,高荣航,梁景文,苑婷婷
(深圳凯吉星农产品检测认证有限公司,广东 深圳 518000)
黄曲霉毒素B1作为世界公认的三大强致癌物质之一[1-2],一般以热带和亚热带等南方高温、高湿地区受污染最为严重[3],在食品中的检出率较高[4-6]。因为黄曲霉毒素B1耐高温,280℃才发生裂解,因此一般烹调加工温度下难以破坏其结构,降低其危害。黄曲霉毒素B1毒性作用主要是对肝脏的损害[7-9],大量摄入时,可发生急性中毒,出现急性肝炎、出血性坏死、肝细胞脂肪变性和胆管增生。
为保障食品供应安全,按照《国家食品安全监督抽检实施细则(2019版)》的要求,黄曲霉毒素B1是食用植物油常规检验项目,结合GB 2761—2017《食品安全国家标准 食品中真菌毒素限量》中4.1.1的要求,植物油脂(花生油、玉米油除外)中限量值为10 μg/kg,其推荐检测方法为GB 5009.22—2016。按照GB 5009.22—2016第二法检测植物油中黄曲霉毒素B1时,花生油、大豆油等多种植物油均能达到良好的去杂效果,但是检测菜籽油中黄曲霉毒素B1时出现了除杂不干净,从而导致色谱图中杂峰较多干扰目标峰定性及定量的情况[10-16]。考虑到菜籽油中杂质主要为大分子有机物,本方法采取优化萃取溶剂并降低萃取溶剂温度的方式对前处理过程进行优化,从而降低杂质在菜籽油中的溶解度,达到良好的去杂效果。
1 材料与方法
1.1 实验材料
菜籽油、玉米油,购于大型超市。黄曲霉毒素B1标准储备液(2 μg/mL),北京坛墨质检科技有限公司,用甲醇稀释为0.1 μg/mL储备溶液。甲醇、乙腈、正己烷,色谱纯,美国J.T.Baker公司;三氟乙酸,分析纯。
LC-30A高效液相色谱仪、SIL-20AC自动进样器、CTO-20A柱温箱,日本岛津公司;Milli-Q纯水仪,美国Millipore公司;Multi Reax振荡器,德国Heidolph公司;Supelco固相萃取仪;N-EVAP-45氮吹仪,美国Organomation;HWS-26水浴锅;MS3旋涡混匀器,德国IKA。
1.2 实验方法
1.2.1 样品前处理
取5 g试样(精确至0.01 g)于50 mL离心管中,加入20 mL甲醇-乙腈萃取溶剂(体积比70∶30,此萃取溶剂用之前在4℃的冰箱中放置30 min),置于涡旋振荡器中振荡20 min,在8 000 r/min下离心2 min,取上清液。用移液管准确吸取4.0 mL上清液于10 mL离心管后,在45℃下用氮气吹至近干,分别加入200 μL正己烷和100 μL三氟乙酸,涡旋30 s,在(40±1)℃的恒温水浴中衍生15 min,衍生结束后,在45℃下用氮气将衍生液吹至近干,用初始流动相定容至1.0 mL,涡旋30 s溶解残留物,过0.22 μm滤膜,收集滤液于进样瓶中以备进样。
1.2.2 标准工作溶液的配制
用甲醇作为溶剂,将黄曲霉毒素B1配制成质量浓度分别为0.1、0.4、1.0、2.0、4.0 ng/mL的标准工作溶液。
1.2.3 高效液相色谱(HPLC)条件
Waters XBridge BEH C18色谱柱(4.6 mm×100 mm,2.5 μm);流速0.8 mL/min;柱温40℃;进样量10 μL;激发波长360 nm,发射波长440 nm;流动相A为蒸馏水,B为乙腈,梯度洗脱,洗脱条件见表1。
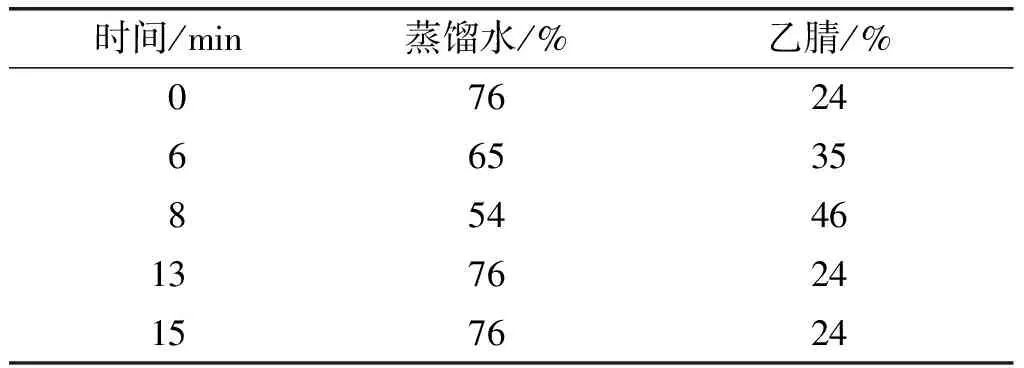
表1 流动相梯度洗脱条件
2 结果与分析
2.1 加标菜籽油的HPLC谱图
取同一份空白基质菜籽油样品,加入黄曲霉毒素B1标准溶液,使菜籽油中黄曲霉毒素B1含量为1.0 ng/mL,分别按照本方法(按1.2.1对样品进行前处理,检测条件按照1.2.3)及GB 5009.22—2016第二法检测菜籽油中黄曲霉毒素B1,结果分别见图1、图2。
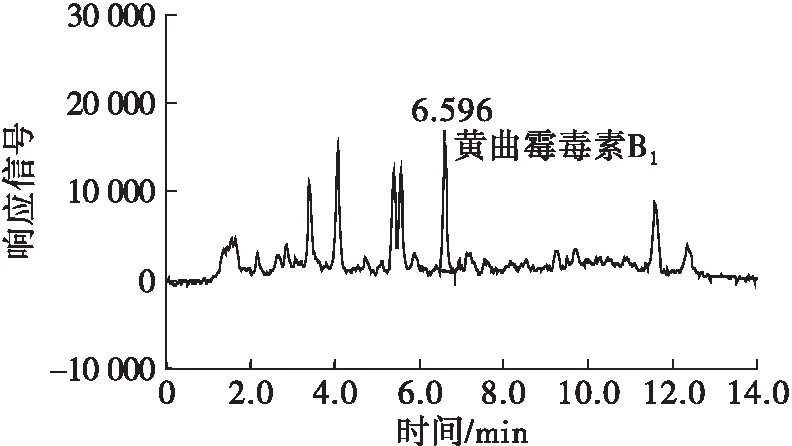
图1 本方法检测的加标菜籽油的HPLC谱图
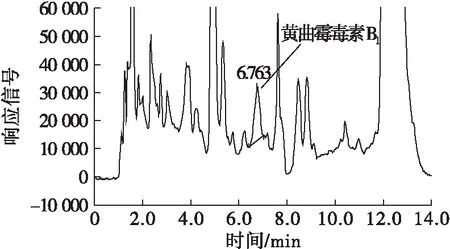
图2 国标方法检测的加标菜籽油的HPLC谱图
从图1可以看出,按照本方法检测菜籽油中黄曲霉毒素B1时,HPLC谱图峰形尖锐,峰型对称,黄曲霉毒素B1在6.596 min出峰,且有较好的分离效果,能准确定性及定量。从图2可以看出,国标方法检测菜籽油中黄曲霉毒素B1时,HPLC谱图峰形较宽,由于杂峰掩盖了黄曲霉毒素B1的目标峰,导致假峰的出峰时间为6.763 min,无法准确定性,且基线较高,导致无法准确定量。因此,按照1.2.1对菜籽油进行前处理,采用HPLC检测黄曲霉毒素B1时,能很好地检测菜籽油中的黄曲霉毒素B1。
2.2 样品前处理条件优化
2.2.1 萃取溶剂对回收率的影响
在空白菜籽油样品中分别添加0.1、0.2、0.3 ng/mL 3个水平的黄曲霉毒素B1,分别采用乙腈-水(体积比84∶16)、甲醇-水(体积比70∶30)、甲醇-乙腈(体积比70∶30)作为萃取溶剂,按照1.2.1前处理方法提取加标样品中的黄曲霉毒素B1,然后用HPLC测定,每个添加水平做两个平行。计算黄曲霉毒素B1的平均回收率,结果见表2。
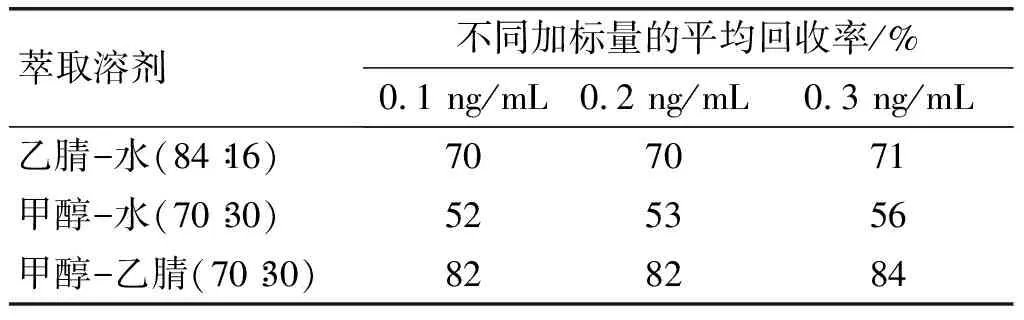
表2 萃取溶剂对回收率的影响
由表2可知,采用甲醇-乙腈(体积比70∶30)提取菜籽油加标样品时,黄曲霉毒素B1回收率最高,提取效果最好。因此,选择甲醇-乙腈(体积比70∶30)作为萃取溶剂。
2.2.2 萃取溶剂温度对回收率的影响
在空白菜籽油样品中分别添加0.1、0.2、0.3 ng/mL 3个水平的黄曲霉毒素B1,萃取溶剂分别在常温、4℃、-18℃放置30 min,按照1.2.1前处理方法提取加标样品中的黄曲霉毒素B1,然后采用HPLC测定,每个添加水平做2个平行。计算黄曲霉毒素B1的平均回收率,结果见表3。
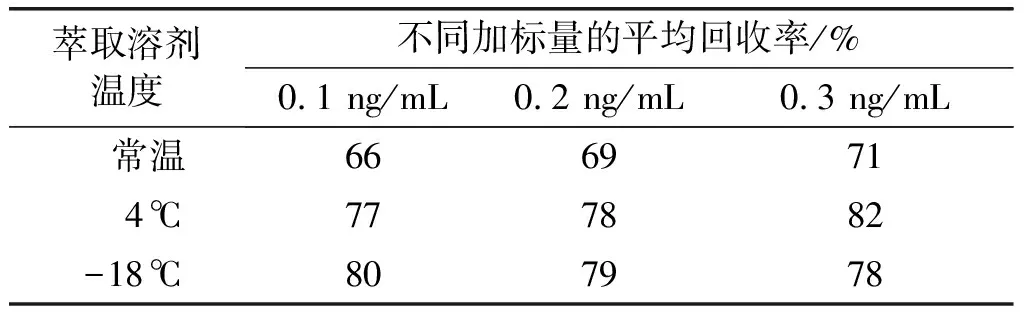
表3 萃取溶剂温度对回收率的影响
由表3可知,萃取溶剂温度为4℃和-18℃时,提取效果较好,且二者的回收率差别不大。考虑到检测成本,萃取溶剂温度建议为4℃。
2.2.3 冷藏样品及冷藏萃取溶剂对回收率的影响
在空白菜籽油样品中分别添加0.1、0.2、0.3 ng/mL 3个水平的黄曲霉毒素B1,分别采用4℃冷藏样品30 min、4℃冷藏萃取溶剂30 min的方式,按1.2.1前处理方法提取加标样品中的黄曲霉毒素B1,采用HPLC测定,每个添加水平做两个平行。计算黄曲霉毒素B1的平均回收率,结果见表4。

表4 冷藏样品及冷藏萃取溶剂对回收率的影响
由表4可知,冷藏萃取溶剂较冷藏样品平均回收率更高,因此选择冷藏萃取溶剂。
2.2.4 萃取溶剂冷藏时间对回收率的影响
在空白菜籽油样品中分别添加0.1、0.2、0.3 ng/mL 3个水平的黄曲霉毒素B1,萃取溶剂分别4℃冷藏10、30、60、120 min,按照1.2.1前处理方法提取加标样品中的黄曲霉毒素B1,采用HPLC测定,每个添加水平做2个平行。计算黄曲霉毒素B1的平均回收率,结果见表5。

表5 萃取溶剂冷藏时间对回收率的影响
由表5可知,萃取溶剂冷藏30 min时,回收率最高,提取效果最好。因此,选择4℃冷藏萃取溶剂30 min。
2.3 方法的定量限和线性范围
利用空白基质中加入黄曲霉毒素B1标准溶液,按照1.2.1进行前处理,然后进行HPLC测试并绘制标准曲线,依据信噪比(S/N)大于10得出定量限为0.1 μg/kg,符合GB 5009.22—2016中规定的定量限(方法定量限为0.1 μg/kg)。本方法的线性方程为y=731.01-18.112x(r=0.999 6),线性范围为0.1~4.0 ng/mL。
2.4 方法的回收率与精密度
空白菜籽油样品中分别添加0.1、0.2、0.5ng/mL 3个水平的黄曲霉毒素B1,按照1.2.1前处理方法提取加标样品中的黄曲霉毒素B1,然后用HPLC测定。计算黄曲霉毒素B1的回收率和相对标准偏差(RSD),结果见表6。

表6 方法的回收率和精密度
由表6可知:空白菜籽油中加入黄曲霉毒素B1标准溶液,回收率在78.0%~90.4%之间,说明该方法回收率良好;RSD在1.61%~4.15%之间,说明该方法精密度良好。
2.5 GB 5009.22—2016第二法与本方法对比
选取一个空白菜籽油样品,加入黄曲霉毒素B1标准溶液,按GB 5009.22—2016第二法与本方法(1.2.1方法进行前处理后进行HPLC测定)测定并绘制标准曲线,依据信噪比大于10得出两个方法的定量限。称取14个空白菜籽油样品并分成两批,分别添加0.15 ng/mL黄曲霉毒素B1于两批样品中,按照GB 5009.22—2016第二法及本方法测定,计算两个方法的精密度。称取4个空白菜籽油样品并分成两批,添加0.1 ng/mL黄曲霉毒素B1于2个样品中,添加0.2 ng/mL黄曲霉毒素B1于另外2个样品中,按照GB 5009.22—2016第二法及本方法测定,计算两个方法的回收率,结果见表7。

表7 两个方法的定量限、回收率及RSD对比
由表7可知,国标方法与本方法均可达到定量限0.1 μg/kg的要求,精密度分别为3.28%和1.95%,回收率分别为83.1%~84.5%和85.4%~88.6%。本方法精密度与回收率稍优于国标方法,因此本方法稍优于GB 5009.22—2016第二法。
3 结 论
菜籽油中黄曲霉毒素B1按照GB 5009.22—2016第二法检测时杂质较难去除,影响黄曲霉毒素B1定性及定量的准确性。本文研究确定以甲醇-乙腈(体积比70∶30)作为萃取溶剂,萃取溶剂在4℃预先放置30 min,对菜籽油中黄曲霉毒素B1的净化效果最好。本方法定量限为0.1 μg/kg,线性范围0.1~4.0 ng/mL,回收率为78.0%~90.4%,相对标准偏差为1.61%~4.15%。本方法简单、快速,能准确地定性和定量菜籽油中黄曲霉毒素B1。
