两种测定食用植物油中叔丁基对羟基苯二酚的方法比较
2020-01-14刘超景赞黄志勇
刘超,景赞,黄志勇
(乐山食品药品检验检测中心,四川乐山 614000)
食用植物油在家庭厨房里不可缺少,同时它也是人体所需营养的重要来源。随着近代工业的发展,为了增加食用植物油的保质期,允许往食用植物油中添加丁基羟基茴香醚(BHA)、2,6-二叔丁基对甲酚(BHT)、二丁基羟基甲苯(TBHQ)、特丁基对苯二酚等抗氧化剂。与BHA、BHT相比,TBHQ更安全,对人体健康影响更小[1],因此,更受广大生产厂家的喜爱。有报道研究TBHQ对实验动物的胃具有一定的副作用[2],在不同国家的使用规则不同,在欧盟和日本禁止在食品中使用[3],我国食品添加剂使用标准规定,在食用植物油中TBHQ最大使用限量为0.2 g/kg[4]。
目前,TBHQ常用检测方法有高效液相色谱法[5]、气相色谱法[6]、液质联用法[7]等。高效液相色谱法具有操作简单、稳定性高等特点;液质联用法具有定性能力高、选择性高、灵敏度高等特点。本文在GB 5009.32-2016[8]基础上,对两种方法进行了比较,以期探索TBHQ检测的最适宜方法。
1 材料与方法
1.1 材料与试剂
甲醇,99.9%,色谱纯,天津康科德科技有限公司;乙腈,99.9%,色谱纯,天津康科德科技有限公司;甲酸,色谱纯,天津市大茂化学试剂厂;叔丁基对羟基苯二酚(TBHQ)(0.25 g、99.2%,Lot:G162174 Dr.Ehrenstorfer GmbH,12/2021);水,实验室用超纯水。
1.2 仪器与设备
高效液相色谱仪,配有紫外检测器,岛津公司DGU-20A;高效液相色谱-串联质谱仪,DGU-20A-API3200,AB公司;电子天平(精确度0.01 mg),XSE205,梅特勒-托利多集团;旋转蒸发仪,EVA50A,北京普立泰科仪器有限公司;凝胶渗透色谱仪,P270II,大连依利特分析仪器有限公司;微孔滤膜,有机相、0.22 μm。
1.3 高效液相色谱法测定食用植物油中TBHQ
1.3.1 色谱条件的确定
液相色谱柱:Kromasil 100-5-C18(3.9 mm×150 mm,5μm);流动相:A-甲醇,B-0.5%甲酸;流速为1.0 mL/min;进样体积为10 μL,采用梯度洗脱,洗脱条件见表1。
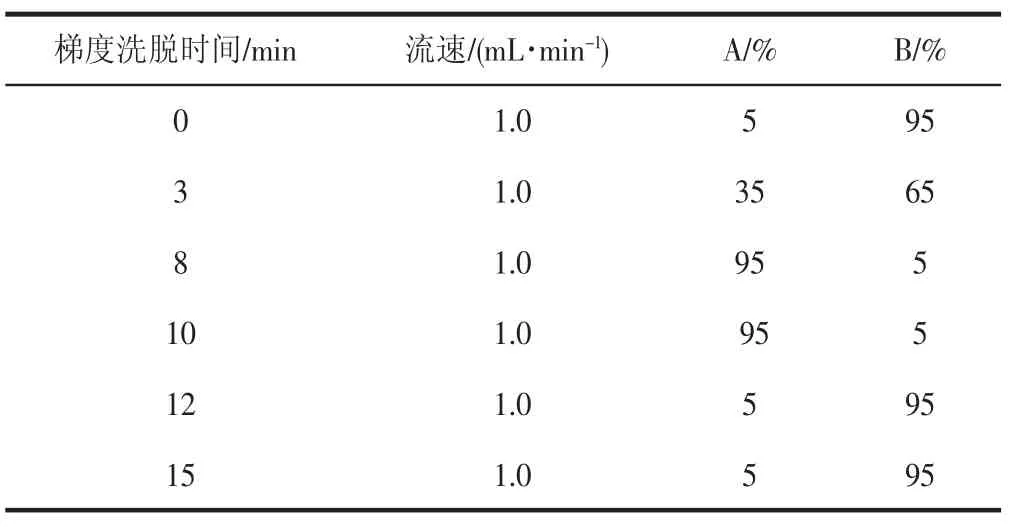
表1 梯度洗脱条件Table 1 Gradient elution condition
1.3.2 对照品溶液的配制
准确称取12.5 mg TBHQ至25 mL棕色容量瓶中,用乙腈定容至刻度,即制得对照品储备液(500 μg/mL),避光,0~4 ℃储存。分别准确移取0.1、0.2、0.5、1.0、1.5、2.0 mL对照品储溶液至5 mL棕色容量瓶中,乙腈定容,配成10、20、50、100、150、200 μg/mL的对照品使用液。
1.3.3 样品的制备
(1)提取
精密称取混匀的食用油10 g于100 mL容量瓶中,以乙酸乙酯-环己烷(1+1)定容至刻度,摇匀,备用。从中取5 mL溶液至10 mL容量瓶中,以乙酸乙酯-环己烷(1+1)定容至刻度,待净化。
(2)净化
取10 mL待净化液加入凝胶色谱进样管中,使用凝胶色谱净化,收集流出液,40 ℃下旋转蒸发至干,加2 mL乙腈溶解,用甲醇定容至5 mL,过0.22 μm的有机相微孔滤膜,备用。
凝胶色谱条件如下:凝胶色谱柱为300 mm×20 mm玻璃柱,Bio Beads(S-X3),40~70 μm;流动相为乙酸乙酯:环己烷(1:1);流速为5 mL/min;流出液收集时间为7~17.5 min;紫外检测波长为280 nm。
1.3.4 方法的检出限
精密称取混匀的食用油10 g于100 mL容量瓶中,加入0.5 mL、5.0 μg/mL的TBHQ对照品使用液,以乙酸乙酯-环己烷(1+1)定容至刻度,摇匀,备用。从中取5 mL溶液至10 mL容量瓶中,以乙酸乙酯-环己烷(1+1)定容至刻度。取10 mL待净化液加入凝胶色谱进样管中,使用凝胶色谱净化,收集流出液,40 ℃下旋转蒸发至干,加2 mL乙腈溶解,过0.22 μm的有机相微孔滤膜,进样,信噪比S/N≥3即可。
1.3.5 方法的回收率和重复性
为验证方法的稳定性和准确性,对食用油分别进行10、20、30 μg/mL这3个水平加标回收试验,测得TBHQ的峰面积代入随行的基质标准曲线,计算浓度及其RSD,获得准确性及重复性结果。
1.4 LC-MS/MS测定食用植物油中TBHQ
1.4.1 液相色谱条件
液相色谱柱:Kromasil 100-5-C18(3.9 mm×150 mm,5 μm);流动相:A-乙腈,B-水;流速:0.4 mL/min;进样体积:10 μL。梯度洗脱,条件见表2。

表2 梯度洗脱条件Table 2 Gradient elution condition
1.4.2 质谱条件
质谱模式为ESI负离子模式,离子源参数见表3,多反应检测参数见表4。

表3 离子源参数Table 3 Ion source parameters

表4 多反应检测参数Table 4 Detection parameters of multiple reaction
1.4.3 对照品溶液的配制
准确称取10 mg TBHQ至100 mL容量瓶中,乙腈定容至刻度,制得对照品储备液(100 μg/mL),避光,-20 ℃储存。移取一定体积的对照品储备液至50 mL容量瓶中,空白基质溶液定容,配成浓度为1、2、5、10、20、50 ng/mL的标准曲线。
1.4.4 样品的制备
同1.3.3高效液相色谱样品制备方法。
1.4.5 方法的检出限
同1.3.4高效液相色谱检出限的制备方法。
1.4.6 方法的回收率和重复性
为验证方法的稳定性和准确性,对食用油分别进行2、4、16 ng/mL这三水平的加标回收试验,测得TBHQ的峰面积代入随行的基质标准曲线,计算浓度及其RSD,获得准确性及重复性结果。
2 结果与分析
2.1 高效液相色谱方法
2.1.1 标准曲线

图1 液相色谱检测TBHQ的标准曲线Fig.1 Standard curve of TBHQ by HPLC
从图1可以看出,TBHQ在10~200 μg/mL的浓度范围内R值为0.999 9>0.99,线性范围良好[9]。选取10~200 μg/mL为本试验的线性范围。
2.1.2 检出限
信噪比S/N=42.5,达到GB 5009.32-2016确定的检出限为10 mg/kg。
2.1.3 方法回收率和重复性
TBHQ在10、20、30 μg/mL这3个水平的回收率依次为71.7%、82.4%、87.5%,重复性依次为2.4%、1.9%、1.0%。数据显示该方法的回收率整体偏低,可能存在的原因是样品经过GPC净化,损失较大;重复性RSD<5%,表明该方法的重复性良好[10]。
2.2 高效液相色谱串联质谱法
2.1.1 标准曲线
从图2可以看出,TBHQ在浓度1~50 ng/mL范围内R值为0.999 7>0.99,可见TBHQ在上述线性范围良好。因此,选取1~50 ng/mL为本试验的线性范围。

图2 液质联用检测TBHQ的标准曲线Fig.2 Standard curve of TBHQ by LC-MS/MS
2.1.2 检出限
采用空白加标方法测定检出限[11-12],按1.3.4制备,进样,信噪比S/N=42.5,检出限结果为1.08 μg/kg。
2.1.3 方法的准确性及重复性
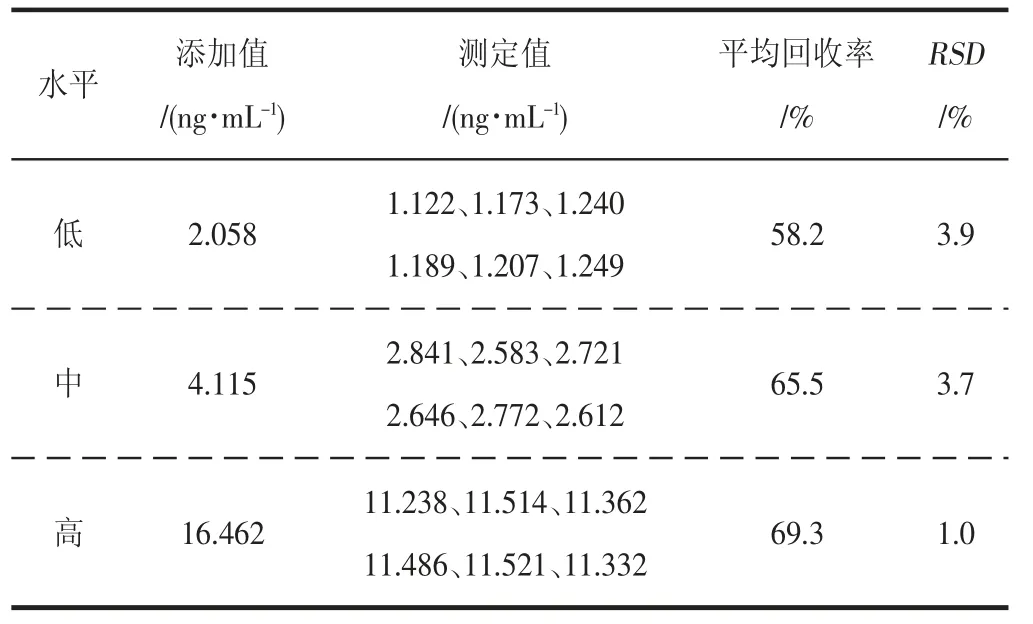
表5 不同水平浓度下的TBHQ回收率和稳定性(n=6)Table 5 Recoveries and stability of TBHQ at diffterent levels concentration(n=6)
TBHQ在2.0、4.0、16.0 ng/mL这3个水平的回收率分别为58.2%、65.5%、69.3%,重复性分别为3.9%、3.7%、1.0%。回收率较液相色谱法略低,这可能是液质联用存在基质效应的原因,虽然采取基质溶液配标,但是不能彻底消除基质效应。重复性RSD<5%,表明该方法重复性良好。
3 结论
本试验用高效液相色谱法检测食用油中TBHQ,对液相色谱法检测食用油中TBHQ方法学进行了考察。结果显示,GB 5009.32-2016中液相色谱法采用凝胶色谱的净化方法,有效避免了假阳性的现象;但是回收率略低,原因在于凝胶色谱净化回收率太低。本试验还采用液质联用法检测了食用油中TBHQ,并对该法检测食用油中TBHQ方法学进行了考察。结果显示,GB5009.32-2016中液质联用法回收率太低,原因可能是由于基质效应的存在及凝胶色谱的应用。总的来说,液相色谱法测定TBHQ回收率较高,建议用液相色谱法检测食品中TBHQ。
