伤科黄水经口给药的长期毒性研究*
2020-01-14蒋春飞刘东文郑芳昊
蒋春飞,刘东文,郑芳昊
广东省佛山市中医院(佛山 528000)
伤科黄水由黄连、黄柏等共六味中药组成,是佛山市中医院自发研制的院内制剂,主要用于治疗跌打损伤、软组织及骨骼损伤等[1-5]。根据临床观察,伤科黄水的药物疗效确切,安全性较高,具备新药开发的价值。目前,按照中药新药申报的要求已经完成了临床前制剂工艺、质量标准和药效学的研究工作,但是有关该制剂的毒副作用却并不明确[6-13]。考虑到伤科黄水为外用制剂,如果采用外敷的方式进行试验,不容易充分暴露潜在的毒性。因此,本研究采用口服给药的方式考察了伤科黄水重复给药的毒副作用。
材料与方法
1 实验材料
1.1 试验药物:伤科黄水制剂(批号:17002,佛山市中医院自制),500 ml/瓶,医疗机构制剂注册标准:粤ZB20111358。制备方法:按伤科黄水复方比例称取黄连、黄柏、栀子药材,加水煎煮1.5 h,过滤,收集滤液;药渣加入白矾、紫草药材,再煎煮45 min,加薄荷煮沸15 min,过滤,收集滤液;合并两次滤液,浓缩至规定浓度,加入防腐剂,即得。给药剂量参考小鼠急性毒性试验的结果设计。经计算伤科黄水的LD50为51.66 g/kg,28.33 g/kg及以下剂量均未见动物死亡。结合LD50设置1/2的LD50,即25.83 g/kg为本次试验的最高剂量,按体表面积折算为大鼠的等效剂量为18.33 g/kg,低、中剂量分别设置为高剂量的1/4、1/2。据此,试验用药配制方法为:将伤科黄水原药液浓缩10倍,分别配置成含原药材0.46 g/ml、0.92 g/ml、1.83 g/ml的药液,供动物试验用。
1.2 动物:SPF级SD大鼠32只,体质量180~300 g,雌雄各半,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0011。
1.3 试剂:0.9%氯化钠注射液(批号:B17061502,湖南科伦制药有限公司);乌来糖(批号:20170105654,上海抚生实业有限公司);尿质控液(批号:55170031,桂林优利特集团有限公司);尿液试纸条(批号:56170949,桂林优利特集团有限公司)。
1.4 仪器:净化工作台(SW-CJ-2FD,苏州净化设备有限公司);尿液分析仪(Uritest-200B,桂林优利特集团有限公司)。
2 实验方法 将SD大鼠按体重和性别随机均衡分为4组,分别为空白对照组,伤科黄水4.58 g/kg剂量组、9.16 g/kg剂量组、18.33 g/kg剂量组,每组8只,雌雄各半。试验各组均以10 ml/kg灌胃给药,每天给药1次,连续给药14 d。试验期间,每天观察大鼠的外观体征、行为活动、腺体分泌、呼吸、粪便性状等,在给药第1、4、7、11、14天测定大鼠体重。在剖检前一天(给药第14天)进行尿液、眼科检查。剖检当天处死全部大鼠,进行脏器检查。
2.1 一般状况观察:给药每天观察动物外观体征、行为活动、分泌物、呼吸、排泄物、中毒反应和死亡情况等。每天至少观察1次,及时做好记录,发现死亡或濒死动物,及时解剖检查并尽量采血检查。每周测定两次体重。
2.2 眼科检查:采用左右眼相互对比方法,进行动物双眼的外观检查。用棉签轻触眼旁皮肤观察双睑闭合、眼球转动等活动情况;用光束照射眼睛观察瞳孔对光反应是否正常;观察角膜的透明度是否清晰;观察结膜的颜色、血管、分泌物有否异常;观察虹膜的形状与平整度是否正常。
2.3 尿液检查:通过挤压法采集大鼠尿液,应不少于0.5 ml。进行尿液外观检查后,用尿液分析仪进行检测。样本应该及时检测,如未能在样本采集后马上检测,应将样本放在2℃~8℃环境,并在8 h内进行检测。检测时环境温度应控制在15℃~30℃。
2.4 脏器检查:剖检当天用20%乌来糖以0.75 ml/100g进行皮下注射麻醉,在大鼠麻醉状态达外科麻醉期后,采用腹主动脉采血处死。系统剖检后,肉眼观察各器官和组织的变化,测定脏器重量,并采用10%中性福尔马林固定。脏体系数、脏脑系数按如下公式计算:


结 果
1 一般状况观察 给药第6、7天,伤科黄水18.33 g/kg剂量组雄性动物分别有3例、2例动物于给药前排软便;给药第11天,雄性动物有1例动物出现稀便,1例动物出现水样便,其余各组无明显变化。与空白对照组相比,伤科黄水18.33 g/kg剂量组给药第14天雌性动物的体重(P<0.05)和14 d内的增重(P<0.01)均明显下降,其余各组无明显变化。具体实验结果参见表1。
2 眼科检查 各组动物眼科检查均未见异常。
3 尿液检查
3.1 雌性动物:伤科黄水9.16 g/kg剂量组、18.33 g/kg剂量组分别有2例、4例动物尿液外观呈暗绿色。空白对照组有2例动物尿液隐血(+),4例动物出现蛋白质(+)。伤科黄水4.58 g/kg剂量组有3例动物尿液出现蛋白质(+)。伤科黄水9.16 g/kg剂量组有2例动物尿液出现蛋白质(+),1例动物蛋白质(),1例动物出现胆红素(+),1例动物出现尿胆原(+),1例动物尿胆原(+)。伤科黄水18.33 g/kg剂量组有4例动物尿液出现蛋白质(+),3例动物出现胆红素(+),4例动物出现尿胆原(+),1例动物出现白细胞(+)。
3.2 雄性动物:伤科黄水4.58 g/kg剂量组、9.16 g/kg剂量组、18.33 g/kg剂量组分别有1例、1例、4例动物尿液外观呈暗绿色。给药各剂量组尿比重高于空白对照组(P<0.05或P<0.01),尿液pH低于阴性对照组(P<0.01)。空白对照组有1例动物尿液出现蛋白质(+),3例动物蛋白质(+),4例动物出现酮体(+)。伤科黄水4.58 g/kg剂量组有1例动物尿液出现隐血(+),1例动物隐血(),1例动物隐血(),1例动物尿液出现蛋白质(+),2例动物蛋白质(+),1例动物蛋白质()。伤科黄水9.16 g/kg剂量组有1例动物尿液出现蛋白质(+),3例动物蛋白质(),1例动物出现酮体(+),1例动物酮体(+)。伤科黄水18.33 g/kg剂量组有1例动物尿液出现隐血(+),2例动物蛋白质(+),2例动物蛋白质(),1例动物出现尿胆原(+)。

表1 伤科黄水连续给药对SD大鼠体重的影响
注:与空白对照组比较,*P<0.05,△P<0.01
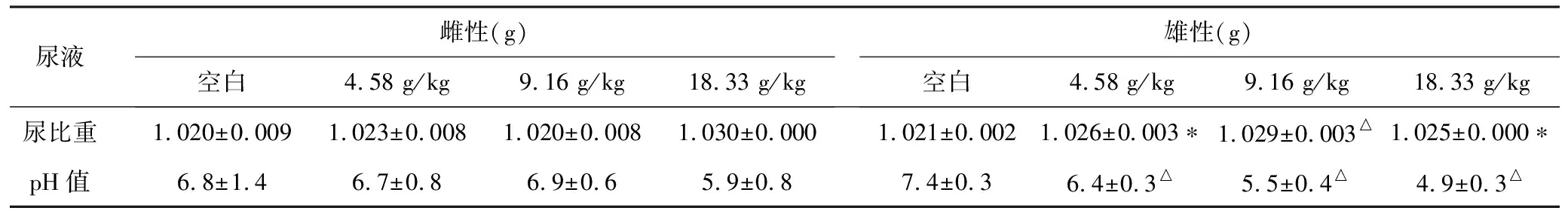
表2 伤科黄水连续给药对SD大鼠尿常规的影响(n=4)
注:与空白对照组比较,*P<0.05,△P<0.01
4 脏器检查
4.1 雌性动物:受试各组动物未见明显脏器损伤。伤科黄水18.33 g/kg剂量组胸腺脏器重量、脏体系数、脏脑系数低于空白对照组(P<0.05或P<0.01),心脏脏器重量低于空白对照组(P<0.05),其余各组无明显差异。
4.2 雄性动物:受试各组动物未见明显脏器损伤。伤科黄水9.16 g/kg剂量组睾丸脏脑系数低于空白对照组,其余各组未见统计学差异(P<0.05)。

表3 伤科黄水连续给药对SD大鼠脏器重量的影响
注:与空白对照组比较,*P<0.05,△P<0.01

表4 伤科黄水连续给药14 d对SD大鼠脏体系数的影响
注:与空白对照组比较,*P<0.05,△P<0.01

表5 伤科黄水连续给药14 d对SD大鼠脏脑系数的影响
注:与空白对照组比较,*P<0.05,△P<0.01
讨 论
伤科黄水作为院内制剂在佛山市中医院已有60多年的使用历史,临床疗效确切,未发现明显的毒副作用。该制剂于2015年获得广东省中医药局中医药强省专项资金-医院中药制剂开发项目的资助,计划通过3年的组织实施,深度改良制剂处方和制备工艺,提高质量标准,明确药理药效,使之成为安全性高、临床疗效确切、质量稳定可控、使用方便的中药制剂,并争取培育成拥有自主知识产权的中药新药。本研究正是在处方固定、生产工艺稳定、质量可控的前提下,根据国家食品药品监督管理局对中药新药注册申报的要求,进行了长期毒性的初步研究。
有研究表明,黄连单味水煎液灌胃给小鼠后,会出现活动减少、呼吸急促、被毛粗乱的现象,部分小鼠甚至出现痉挛、死亡的情况,剖检结果表明主要毒性靶器官为脑、肝、脾、肺、肾[4]。黄连、黄柏作为苦寒类中药的代表,容易引起引起稀便甚至腹泻[14-15]。本研究表明,伤科黄水经口给药后,部分大鼠虽出现了软便或稀便现象,与黄连、黄柏诱导的胃肠道刺激反应一致,但是对主要功能器官并未产生毒性作用。而伤科黄水作为外用制剂,通常透皮吸收后进入胃肠道的可能较小,不会引起胃肠道反应。另外,不同剂量的伤科黄水对大鼠尿液产生了一定影响,但经研究发现主要与药物浓度有关,并未产生病理性代谢产物。因此,可以认为伤科黄水未有明显的毒副作用。
本研究观察了连续灌胃给予伤科黄水后大鼠产生的毒性反应及其严重程度,主要的毒性靶器官或靶组织及其损害的可逆性,为临床主要监测指标提供一定参考。
