pH值和比生长速率协同调控Streptomyces albulus合成ε-聚赖氨酸
2020-01-13王开方潘龙刁文娇陈旭升毛忠贵
王开方,潘龙,刁文娇,陈旭升,毛忠贵
(工业生物技术教育部重点实验室(江南大学),生物工程学院,江苏 无锡,214122)
ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)是由25~35个L-赖氨酸单体通过ε-氨基和α-羧基脱水缩合形成的一种同型氨基酸聚合物[1-2]。ε-PL具有抑菌范围广[3-4]、安全无毒[5]和热稳定性高等特点,故广泛用作食品防腐剂,目前已被多个国家使用[6-7]。
ε-PL的发酵工艺主要为pH控制策略。KAHAR等[8]开创了两阶段pH控制策略,即发酵前期(2 d)将pH控制在5.0以上,获得更高的菌体量;后期将pH控制在4.0左右,快速合成ε-PL。经过连续8 d补料分批发酵,ε-PL产量达到48.3 g/L,成为当时的领先水平。任喜东等[9]建立了一种pH冲击策略发酵生产ε-PL模式。前期控制pH为5.0,随后让pH自然下降,经12 h左右的冲击(pH 3.0)后回调pH值至4.0左右,直至发酵结束。同样经过连续8 d补料分批发酵,ε-PL产量达到54.7 g/L。大量研究表明,发酵过程中将pH控制在4.0左右是S.albulus积累ε-PL的先决条件[8,10-11]。目前,关于低pH促进S.albulus高产ε-PL的原因主要有2种观点,第1种观点认为,低pH能够有效的抑制ε-PL降解酶(PL dehydrogenase, Pld)的酶活,防止产生的ε-PL被降解[12-13];第2种观点认为,ε-PL合成酶(PL synthetase, Pls)是一种依赖于ATP的非核糖体肽合成酶,低pH环境有利于胞内ATP的积累,从而促进ε-PL的合成[14]。
然而,低pH除了影响Pld酶活和胞内ATP浓度之外,还会对菌体生长速率产生影响[15],而生长速率的不同又会影响微生物的代谢流分布[16-17]。王泽建等[18]研究发现:在粪产碱杆菌中,随着比生长速率的升高(0.05 h-1到0.29 h-1),葡萄糖流向菌体生长的比例从18%增加到了47%,流向凝胶多糖合成的碳去向分布由45%降低到了12%;在高比生长速率的情况下,更多的碳源流向菌体的生长以及副产物的生成。那么比生长速率是否也是影响ε-PL合成的一个重要原因呢?目前关于菌体比生长速率对ε-PL合成的影响尚未有研究报道。因此,本研究将通过恒化培养方式,研究不同pH和菌体比生长速率对S.albulusM-Z18合成ε-PL的影响。
1 材料与方法
1.1 实验材料
1.1.1 菌种
StreptomycesalbulusM-Z18,本实验室保藏。
1.1.2 试剂
ATP检测试剂盒、BCA蛋白浓度测定试剂盒(增强型),碧云天生物技术公司;ε-PL标准品,郑州拜纳佛生物工程股份有限公司;葡萄糖(优级纯),西王药业有限公司邹平分公司;酵母粉,英国Oxoid公司;其他试剂(分析纯),国药集团化学试剂有限公司。
1.1.3 培养基
固体培养基(BNT)(g/L):葡萄糖 10,酵母粉 1,鱼粉蛋白胨 2,pH 7.5。
种子培养基(M3G培养基)(g/L):葡萄糖 50,酵母粉 5,(NH4)2SO410,MgSO4·7H2O 0.5,ZnSO4·7H2O 0.04,FeSO4·7H2O 0.03,KH2PO41.36,K2HPO40.8,pH 6.8。
分批培养基(RSM培养基)(g/L):葡萄糖 60,酵母粉 10,(NH4)2SO410,MgSO4·7H2O 0.8, FeSO4·7H2O 0.05,KH2PO44,pH 6.8。
恒化分批培养基(g/L):葡萄糖20,其他成分与分批培养基相同。
恒化补料培养基(g/L):葡萄糖22,其他成分与分批培养基相同。
1.1.4 仪器与设备
T&J-Miniskid 1 L*4迷你平行生物反应器,迪比尔生物工程(上海)有限公司;BT100-1F/DG蠕动泵,保定兰格恒流泵有限公司;Synergy H4多功能酶标仪,美国伯腾仪器有限公司;UV-2100紫外可见分光光度计,尤尼可仪器有限公司;AB204-N分析天平,瑞士梅特勒公司;3K15冷冻离心机,德国SIGMA公司;HYG-Ⅱ回转式恒温调速摇瓶柜,上海欣蕊自动化设备有限公司;BS1100+电子天平,上海友声衡器有限公司;GNP-9160恒温培养箱,上海光都仪器设备公司;SBA-40C生物传感分析仪,山东省科学院生物研究所。
1.2 培养方法
1.2.1 摇瓶种子培养
从活化的新鲜平板上刮取2环孢子接入装有80 mL种子培养基的500 mL摇瓶中,200 r/min、30 ℃摇床培养24 h。
1.2.2 分批发酵
将培养好的种子液以体积分数8%接种量接入T&J-Miniskid 1 L*4迷你平行生物反应器,装液量为600 mL,温度设置为30 ℃,通气量1.0 vvm,初始转速为200 r/min,溶氧设置为30%,转速溶氧联动控制。待pH分别自然下降至3.5、4.0、5.0和5.5时,用12.5%的NH3·H2O分别维持pH恒定直至发酵结束。期间每隔6 h取一次样,测定菌体干重(DCW)、ε-PL浓度、葡萄糖浓度等参数,以考察不同pH控制模式对S.albulusM-Z18生长以及ε-PL合成的影响。
1.2.3 恒化培养
恒化培养在T&J-Miniskid 1 L*4迷你平行生物反应器中进行,工作体积为600 mL,接种量为8%。分批阶段:初始转速为200 r/min,溶氧设置为30%,转速溶氧联动控制,直至葡萄糖基本耗完(18 h),转入恒化阶段[19]。恒化阶段:全程控制温度为30 ℃,转速为700 r/min,通气量为1.0 vvm,分别控制pH为4.0、5.0和5.5,置换4~5个体积后均能达到稳定状态(通过葡萄糖浓度、菌体干重、溶氧、ε-PL浓度等过程参数确定)。取稳定状态菌液进行分析。
1.3 分析方法
1.3.1 ε-PL浓度的测定
采用甲基橙比色法[20]。
1.3.2 DCW的测定
取10 mL发酵液,5 000×g离心10 min后,弃上清,沉淀用去离子水洗涤、离心2次后,于105 ℃烘干至恒重(约24 h)。
1.3.3 葡萄糖浓度的测定
使用生物传感分析仪进行测定。
1.3.4 胞内ATP浓度的测定
参照试剂盒说明书。
1.3.5 蛋白浓度的测定
参照试剂盒说明书。
1.3.6 动力学参数的计算[18,21-22]
比生长速率:使用Origin 9.0软件按照Logistic方程非线性拟合得到生长曲线,再经Origin 9.0软件进一步处理数据得出比生长速率曲线。
ε-PL比合成速率:方法类似于比生长速率。
恒化稳态时,比生长速率(μ,h-1)、稀释率(D,h-1)、细胞得率(YX/S,g/g)、ε-PL得率(YP/S,g/g)、以菌体生长为基准的ε-PL得率(YP/X,g/g)、葡萄糖比消耗速率(qS,g/(g·h)以及ε-PL比合成速率(qP,g/(g·h)参照以下公式。
(1)
(2)
(3)
(4)
(5)
qP=μ·YP/X
(6)
式中:F,补料速率,L/h;V,装液量,0.6 L;c(X),稳态时菌体干重,g/L;c(P),稳态时ε-PL质量浓度,g/L;c(S),稳态时葡萄糖质量浓度,g/L;c(S0),补料液中的葡萄糖质量浓度,g/L。
2 结果与讨论
2.1 pH对S. albulus M-Z18分批发酵的影响
微生物的生长需要一定的酸碱度,链霉菌的最适生长pH为中性偏碱性[23-24]。pH通过影响微生物细胞膜的电荷、酶活、营养物质和中间代谢产物的解离等进而影响微生物生长和产物合成[25]。pH对S.albulusM-Z18分批发酵结果如图1所示,随着分批发酵进行,pH值由初始6.8逐步下降至pH 5.5(13 h)、pH 5.0(14 h)、pH 4.0(14.5 h)和pH 3.5(15 h),随后依靠自动流加氨水将分批发酵过程控制在不同的pH进行。由图1-a可知,不同pH对S.albulusM-Z18菌体生长产生了显著影响,受控pH越高,发酵结束时菌体量就越高,该实验结果与前期研究保持一致[18]。pH 3.5时,最终生物量为(11.62±0.40)g/L,仅为pH 5.5时的一半[(22.53±0.42 g/L]。另外,在分批发酵分别达到受控pH值后(15 h),μpH 3.5约为0.04 h-1,μpH4.0约为0.07 h-1,μpH 5.0约为0.10 h-1,μpH 5.5约为0.13 h-1(图1-b),表明分批发酵受控pH, pH值越小,S.albulusM-Z18比生长速率越低。然而,ε-PL产量在pH 3.5时最高,达到(5.24±0.10) g/L;当pH高于5.0时,发酵液中检测不到ε-PL(图1-c)。通过对ε-PL比合成速率分析发现,ε-PL快速合成阶段主要集中于18~27 h左右。24 h之后,ε-PL比合成速率显著下降。在大部分时间里,pH 3.5时ε-PL比合成速率高于pH 4.0时(图1-d)。因此,S.albulusM-Z18在低pH环境下积累ε-PL与菌体生长速率存在一定关联。
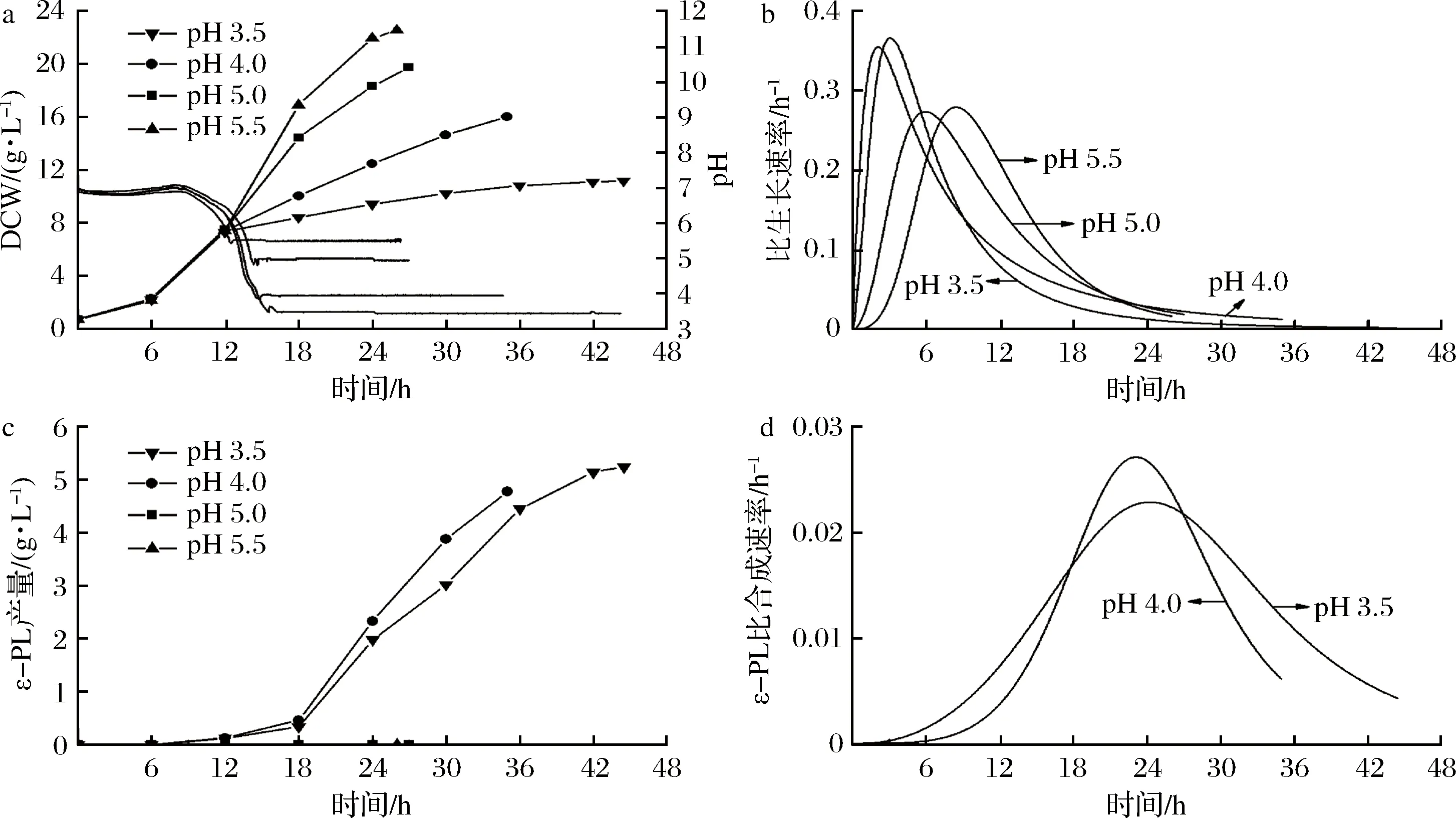
a-菌体生长;b-比生长速率;c-ε-PL产量;d-ε-PL比合成速率图1 pH值对分批发酵过程参数的影响Fig.1 Time profiles during batch fermentation at different pH
2.2 pH对S. albulus M-Z18恒化培养积累ε-PL的影响
恒化培养可以通过改变稀释率及限制性基质的种类和浓度灵活地控制微生物细胞的比生长速率。通过恒化培养可以使微生物细胞达到“稳态”,故常常被用于微生物生理方面的研究[26-27]。本文通过控制D=0.04 h-1,研究不同pH(4.0,4.5,5.0)对S.albulusM-Z18合成ε-PL的影响(在稀释率为0.04 h-1时,pH 3.5不能建立恒化体系),如图2a-c所示,随着pH值升高,S.albulusM-Z18生物量逐渐增大,而ε-PL质量浓度逐渐减小。在pH 4.0时,生物量为(8.19±0.05) g/L,ε-PL浓度为(2.43±0.04) g/L;在pH 5.0时,生物量为(12.19±0.14) g/L,ε-PL质量浓度为(0.76±0.02) g/L;在pH 5.5时,生物量为(15.63±0.09) g/L,ε-PL质量浓度为0 g/L。实验结果表明,pH值对于恒化条件下的菌体生长和ε-PL合成影响,与上述分批发酵结果基本一致:低pH有利于ε-PL合成,而不利于菌体生长。进一步动力学参数分析发现,随着pH值降低,细胞得率(YX/S)逐渐减小,葡萄糖比消耗速率(qS)逐渐增大,ε-PL比合成速率(qP)也逐渐增加。特别是在pH 4.0时,YX/S最低(0.376 g/g),qS最高(0.106 g/(g·h)),qP最大(0.012 g/(g·h))(表1)。这表明,低pH时,细胞会快速消耗葡萄糖用于ε-PL的合成。胞内ATP浓度检测发现(图2-d),在pH 4.0时,胞内ATP浓度最高为(7.11±0.80) nmol/mg蛋白,而pH 5.0与pH 5.5胞内ATP浓度分别只有(4.23±0.43) 和(2.66±0.70) nmol/mg蛋白。这表明,pH值越低越有利于胞内ATP积累。事实上,ε-PL合成依靠的ε-PL合成酶是一种依赖于ATP浓度的非核糖体肽合成酶,即ATP浓度越高,酶活越高[14],ε-PL合成速率就越快。另外,已有的研究表明S.albulus中存在2种ε-PL分解酶,它们的最适pH为7.0左右,且酶活会随着pH降低而逐渐减小,在pH 4.0时酶活基本丧失[12-13]。综上,在菌体比生长速率相同情况下,低pH一方面抑制了分解酶活性,另一方面使得底物葡萄糖更多地用于ATP和ε-PL合成,从而有利于ε-PL积累。
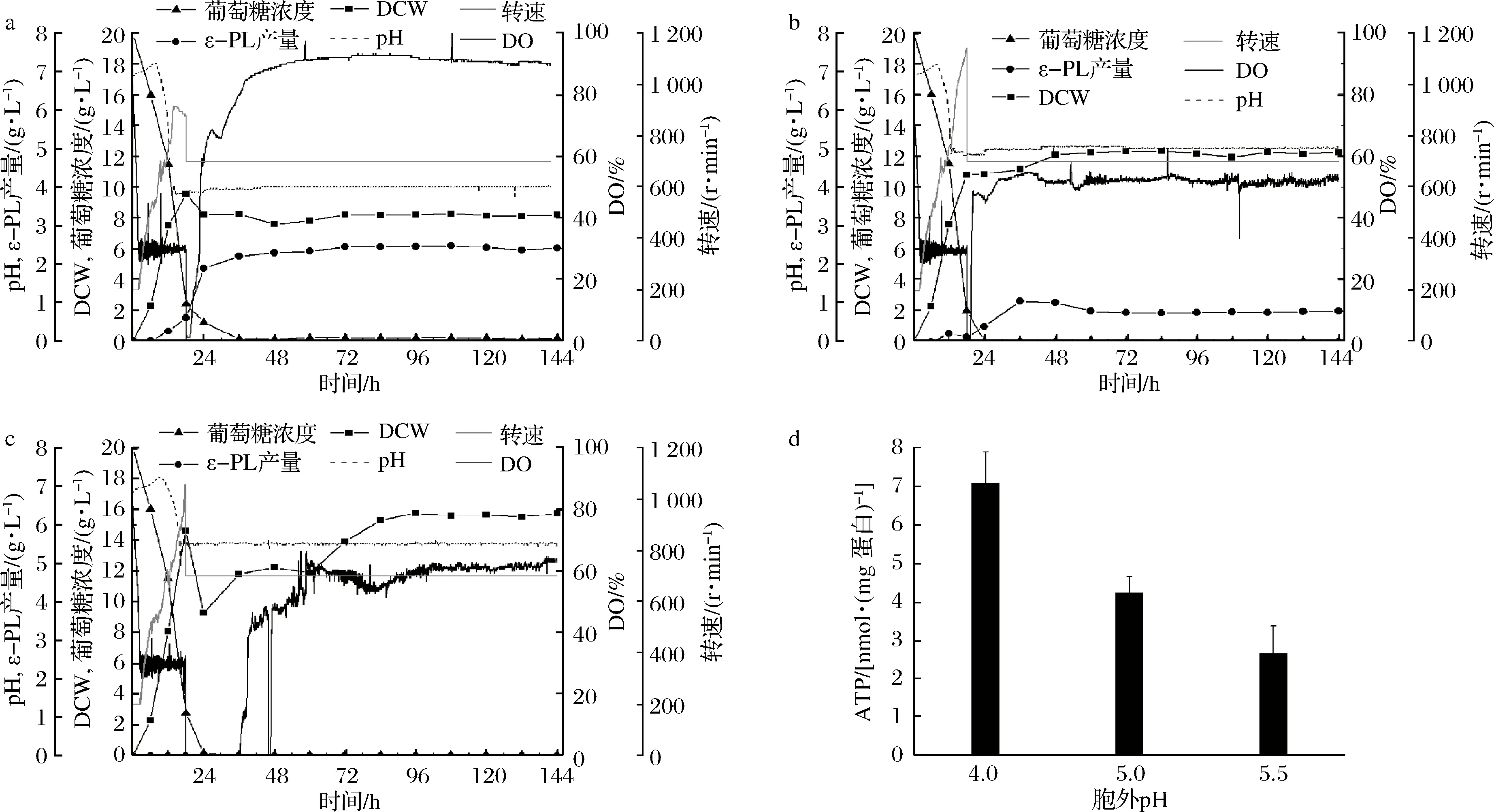
a-pH 4.0;b-pH 5.0;c-pH 5.5;d-胞内ATP含量图2 S. albulus M-Z18在不同pH下的恒化培养(D=0.04 h-1)过程参数和胞内ATP含量Fig.2 Time profiles and intracellular ATP concentrations of S. albulus M-Z18 in chemostat (D=0.04 h-1) at different pH

表1 不同pH值下S. albulus M-Z18恒化培养(D=0.04 h-1)动力学参数Table 1 Kinetic paraments of S. albulus M-Z18 in chemostat (D=0.04 h-1) at different pH
2.3 比生长速率对恒定pH 4.0条件下S. albulus M-Z18合成ε-PL的影响
S.albulusM-Z18在pH 4.0条件下,不同稀释率的恒化培养体系中达到“稳态”时(D=0.08 h-1有轻微洗脱现象),μ=0.04、0.06和0.08 h-1的生物量分别为(8.19±0.05)、(7.83±0.04)和(6.81±0.07) g/L;ε-PL浓度分别为(2.43±0.04)、(2.29±0.06)和(1.68±0.06) g/L(图3a-c)。随着菌体比生长速率的增加(稀释率升高),qS和qP均呈逐渐增加趋势(表2)。相比于D=0.04 h-1、D=0.06 h-1时,qS和qP分别提高了43%和50%;相比于D=0.06 h-1、D=0.08 h-1时,qS提高了70%,而qP只提高了11%。

表2 不同稀释率S. albulus M-Z18恒化培养(pH 4.0)动力学参数Table 2 Kinetic paraments of S. albulus M-Z18 in chemostat (pH 4.0) at different dilution ratios
另外,不同稀释率恒化体系中菌体胞内ATP浓度检测发现,稀释率为0.04、0.06和0.08 h-1时,胞内ATP浓度分别为(7.11±0.80)、(12.98±0.45)和(16.06±1.41) nmol/mg蛋白。相比于D=0.04 h-1、D=0.06 h-1胞内ATP增加了82.5%左右,约6 nmol/mg蛋白。而相比于D=0.06 h-1、D=0.08 h-1胞内ATP仅增加了23.7%,约3 nmol/mg蛋白。综上,在恒定pH 4.0时,菌体比生长速率越高,底物葡萄糖消耗速率、ε-PL比生成速率和胞内ATP浓度就越大,而细胞得率和ε-PL得率(YP/S)却在总体下降。由此可以看出,随着菌体比生长速率提高,底物葡萄糖消耗速率加快,更多的葡萄糖流向了菌体合成和ATP生产,但是ε-PL比生成速率提高不显著,而YP/S下降明显(特别是在D=0.08 h-1时),故过高的菌体比生长速率会降低发酵的经济性。因此,在发酵过程中,除了将pH控制在合适范围内,也需要调节菌体的生长速率保持在合理区间(如0.06 h-1左右),才能实现ε-PL的最高效发酵。
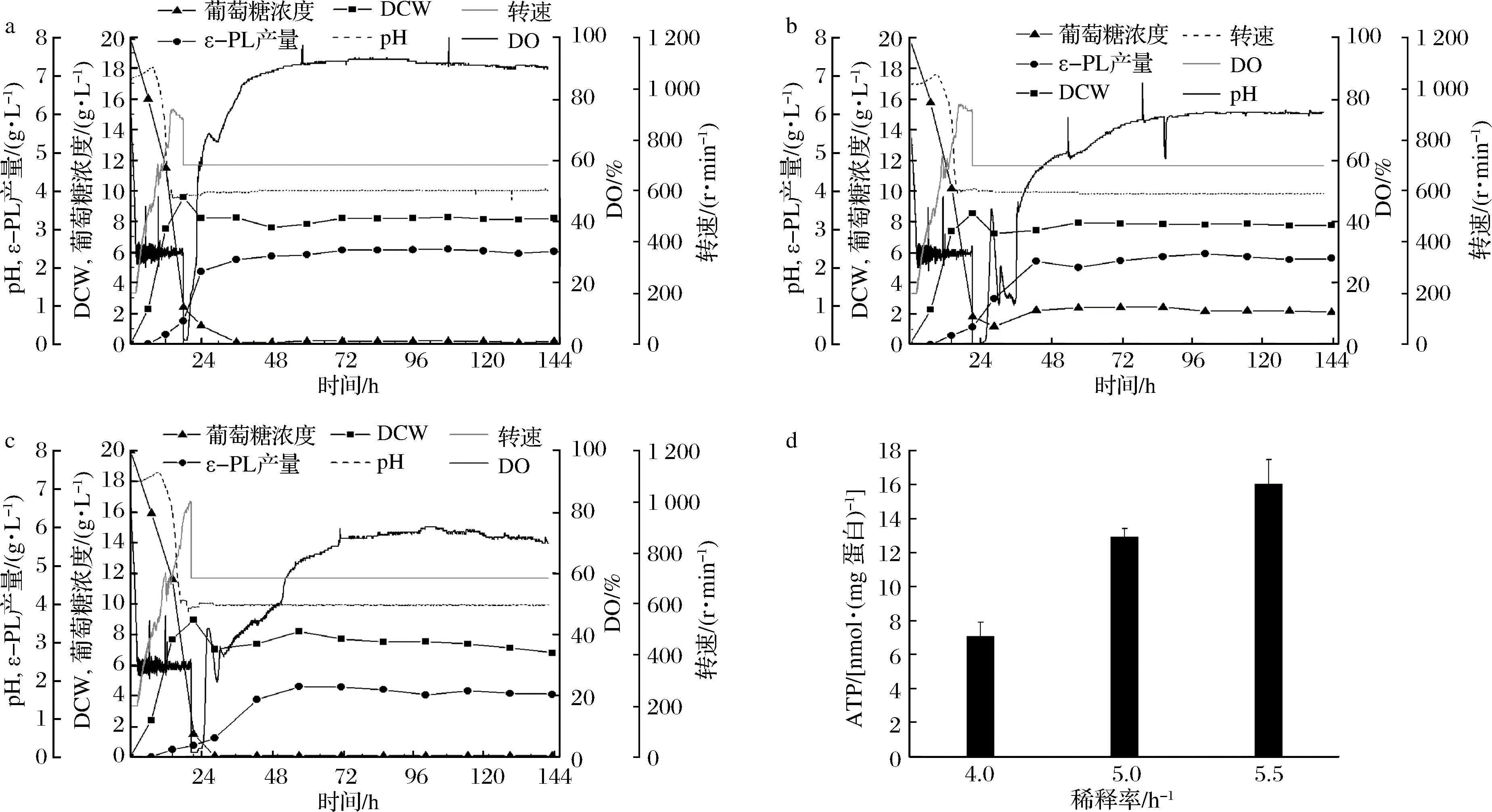
a-0.04 h-1;b-0.06 h-1;c-0.08 h-1;d-胞内ATP含量图3 S. albulus M-Z18在不同稀释率的恒化培养(pH=4.0)过程参数和胞内ATP含量Fig.3 Time profiles and intracellular ATP concentrations of S. albulus M-Z18 in chemostat (pH 4.0) at different dilution ratios
3 结论
为了探究ε-PL发酵过程的关键影响因素,本文从发酵动力学角度,分析了pH值和菌体比生长速率对ε-PL发酵过程参数的影响。研究结果表明,发酵过程控制pH在4.0左右,不仅可以抑制ε-PL分解酶活性,同时使得底物葡萄糖更多地用于ATP和ε-PL合成,从而有利于ε-PL的积累;另外,维持菌体比生长速率在合理区间(0.06 h-1左右),也是获得ε-PL高效积累的重要控制条件。因此,在发酵过程中将pH控制在较低水平,不仅能够抑制分解酶活性、提高胞内ATP浓度,还可以将菌体生长控制在合适的速率范围,最终共同调控了ε-PL大量积累。基于上述发现,在ε-PL补料分批发酵过程中(pH冲击模式),当菌体增长缓慢时,可通过流加有机氮源(如酵母粉)促进菌体生长;而当菌体增长过快,可通过适当下调pH,以维持细胞比生长速率在0.06 h-1左右,进一步达到高产ε-PL的目的。
