化学氧化后深层土壤中多环芳烃的缺氧微生物降解
2020-01-10麻俊胜苟雅玲王兴润杨苏才程言君宋云
麻俊胜,苟雅玲,王兴润,杨苏才*,程言君,宋云
1.轻工业环境保护研究所 2.中国环境科学研究院
多环芳烃(PAHs)具有致畸、致癌、致突变性[1]。PAHs污染土壤的修复已成为研究热点[2- 3],过氧化氢氧化是其常用的修复方法之一[4- 6]。但单独使用过氧化氢氧化通常需要大量的氧化剂和多次注入才能达到修复目标[7],使修复成本大幅提高;而修复成本低、二次污染小的微生物修复技术也受限于其较长的修复周期。为了克服单一修复技术的局限性,已研发出多种基于过氧化氢氧化的微生物修复技术[4,8]。化学氧化处理后土壤中微生物的数量会减少,微生物的生长环境也会改变,如土壤有机质减少,营养物质流失,pH变化等[3,9],使后续的微生物降解变得困难,但化学氧化后的土壤经过一定时间的好氧培养后微生物数量能够得到恢复[4,9- 10]。如Chen等[9]发现过氧化氢处理后的土壤,在好氧培养前5 d细菌数量不断减少,但经过120 d的培养后细菌数量从1.1×104CFU/g(以土壤质量计,全文同)增加到1.0×108CFU/g。有关化学氧化与微生物联合降解土壤中PAHs的研究得到了广泛的开展[4,10- 11],但目前已有的研究多集中于化学氧化与好氧微生物联合降解土壤中的PAHs,与缺氧微生物联合降解的应用鲜有报道。这可能是因为缺氧/厌氧微生物降解PAHs的效率远低于好氧降解[12]。据Rockne等[13]报道,缺氧/厌氧微生物降解PAHs的速率比好氧降解低1~2个数量级。但深层土壤中PAHs的原位生物修复往往与缺氧或厌氧条件有关[14]。由于深层土壤中微生物数量比表层土壤低1~2个数量级,且在缺氧条件下微生物的呼吸和代谢速率均比好氧条件下低[15],因此,化学氧化后深层土壤中PAHs的缺氧降解难度较大。随着受污染土壤治理需求的加大,近年来深层土壤中PAHs的化学氧化与缺氧微生物联合降解的研究越来越受到关注。笔者以华北某PAHs污染场地土壤为研究对象,通过分析缺氧培养前后土壤中微生物数量及PAHs浓度的变化,考察化学氧化后土壤中微生物恢复情况,探讨化学氧化后土壤中PAHs缺氧降解的规律,并对其原因进行解析,以期为PAHs污染土壤原位修复提供方法和途径。
1 材料与方法
1.1 供试土壤与药品
试验所用土壤采集自华北某PAHs污染场地地下3~4 m处。土壤样品过2 mm筛并混合均匀,密封保存于-20 ℃条件下备用。试验所用正己烷和二氯甲烷(均为色谱级)购于美国的J T Baker公司;包含16种PAHs的混合标准溶液和包含5种PAHs氘代物的混合内标液购于美国AccuStandard公司;过氧化氢购于国药集团化学试剂有限公司;无水硫酸钠购自北京化工厂,在450 ℃烘烤6 h后用作干燥剂。
1.2 试验方法
1.2.1土壤化学氧化处理
将100 g土壤样品和150 mL浓度为10%的过氧化氢先后加入1 L烧杯中,用磁力搅拌器搅拌4 h进行氧化。搅拌结束后静置4 h,再将烧杯中泥浆进行抽滤分离,得到氧化后的土壤样品(oxidized soil,OS)。将OS分成两部分,一部分密封保存于-20 ℃条件下备用,另一部分用于接种微生物。
1.2.2氧化后土壤接种微生物
参照文献[16]的方法,在100 g OS中添加10 g未氧化的土壤(untreated soil,US),用磁力搅拌器搅拌2 h。搅拌结束后静置4 h,再将烧杯中泥浆进行抽滤分离,得到氧化后接种的土壤(inoculated soil,IS),密封保存于-20 ℃条件下备用。
1.2.3土壤缺氧培养试验
选择配有聚四氟乙烯衬里的丁基橡胶塞和铝制密封盖的50 mL血清瓶进行缺氧培养试验。所有培养试验的操作均在充满氮气的缺氧手套箱中完成。采用IS和OS 2种土壤进行缺氧培养试验。每种土壤均设置以下4个处理:1)仅添加去离子水作为对照处理(CK);2)仅添加营养盐(CY);3)仅添加2 000 mg/kg硫酸盐作为电子受体(CS);4)添加营养盐和2 000 mg/kg硫酸盐(YS)。每个处理设置6个重复。
培养试验时,在每个血清瓶中装入30 g土壤样品,并添加7 mL硫酸盐、营养盐或去离子水,使土壤含水率超过100%土壤持水能力。其中,营养盐配制:K2HPO4,1 g/L;KH2PO4,1 g/L;NH4Cl, 1 g/L;CaCl2,0.02 g/L;MgCl2,0.2 g/L;FeCl3,0.05 g/L。密封完成的血清瓶转移至培养箱中恒温30 ℃避光培养。每个处理分别在第0天和第180天随机抽取3个样品进行土壤中微生物和PAHs测试。
1.3 分析与检测方法
1.3.1PAHs提取及检测
土壤样品中PAHs提取和测试方法参照文献[17]。取2 g冷冻干燥后的土壤放入40 mL聚四氟乙烯离心管中,分别加入正己烷和二氯甲烷各15 mL,利用超声清洗机萃取土壤中PAHs。超声萃取土壤中PAHs回收率试验结果:除了萘的回收率为56.9%外,其他15种PAHs的回收率为86.3%~112.6%。测试所用气相色谱- 质谱仪为安捷伦7890B- 5977A型,仪器状态:载气为高纯氦气;进样口温度为290 ℃,分流进样,分流比为10∶1,进样量为1.0 μL;起始温度为40 ℃,进样后保持2 min,随后以10 ℃/min升至240 ℃,保持3 min,再以5 ℃/min升至320 ℃,保持10 min。
1.3.2DNA提取与微生物数量分析
土壤DNA用Power Soil DNA Isolation Kit(MO BIO Laboratories,USA)试剂盒提取,操作步骤按照试剂盒说明书进行。以16S rDNA基因作为靶基因,利用实时荧光定量PCR检测基因拷贝数(N),检测方法参照文献[17],细菌数量以lgN计。
1.3.3理化性质检测
土壤总有机碳、总氮、速效磷、速效钾、硝酸盐氮、氨氮浓度与pH检测方法参照文献[18]。
2 结果与讨论
2.1 化学氧化对土壤中PAHs浓度、理化性质和微生物数量的影响
2.1.1PAHs浓度
化学氧化前后土壤中PAHs浓度变化如表1所示。由表1可知,化学氧化后,土壤中16种PAHs均发生了明显的降解,降解率为33.3%~95.9%。这可能是因为过氧化氢强烈的氧化性能够非选择性地破坏土壤中有机物[19]。过氧化氢分解过程中产生的羟基自由基(·OH)能将大分子的有机污染物分解为小分子有机物,最终氧化为二氧化碳和水,总化学反应方程式:有机污染物+·OH→CO2+H2O[20]。2环和3环PAHs降解率较高,而4环、5环和6环PAHs的降解率则相对较低,这与Jonsson等[2]报道的Fenton氧化后2环和3环PAHs的降解率分别为89%和59%,而4环、5环和6环PAHs降解率低于38%研究结果一致。其他学者也有类似报道[21]。表明低分子量的2环和3环PAHs比高分子量的4环、5环和6环PAHs更易降解。

表1 化学氧化前后、氧化后接种土壤中16种PAHs浓度
2.1.2理化性质
化学氧化前后土壤理化指标变化见表2。由表2可知,化学氧化后土壤理化性质发生了较大改变。土壤中总有机碳浓度从初始值5.04 g/kg下降至2.15 g/kg;土壤中氨氮和速效磷浓度有所上升,但是总氮、硝酸盐氮和速效钾浓度下降较多。这可能是由于过氧化氢氧化过程中产生的·OH在氧化污染物的同时非选择性地破坏了土壤有机组分(有机碳、有机氮等)。Sutton等[19,22]报道化学氧化可以非选择性地破坏土壤中大部分有机物,且氧化过程会导致土壤中的碳、氮向水溶液中释放。

表2 化学氧化前后土壤理化指标变化
注:pH为无量纲。
2.1.3微生物数量
化学氧化前后土壤中细菌数量见图1。由图1可知,化学氧化前土壤中细菌数量的lgN为8.8,化学氧化后减至5.3,表明过氧化氢氧化在降解PAHs的同时也对土壤中微生物产生了不利影响。这与已有研究的报道类似,如Lu等[11]发现类Fenton氧化后土壤中细菌数量从3.45×106CFU/g下降至4.21×103CFU/g,Gong[23]报道Fenton处理后土壤中细菌数量从1.38×108CFU/g下降至1.62×106CFU/g。除过氧化氢外,向土壤中施用其他氧化药剂(如过硫酸盐、臭氧和Fenton试剂)后,土壤中细菌数量也会下降[24- 26]。

注:图上字母不同表示处理间差异显著(P<0.05);字母相同表示处理间差异不显著(P>0.05)。图1 US、IS、OS及IS、OS不同处理的土壤样品中细菌数量Fig.1 Number of bacterial in the soil of US, IS, OS, and different treatments of IS and OS
2.2 化学氧化后缺氧培养对土壤中微生物数量的影响
化学氧化后IS和OS及其不同处理的细菌数量见图1。由图1可知,IS、OS细菌数量的lgN分别为7.5和5.3,经过180 d的缺氧培养,不同处理的细菌数量呈现显著差异(P<0.05)。IS和OS的CK、CS中细菌数量没有明显增加,但是CY中细菌数量明显增加。可见,添加营养盐或接种微生物都可以增加微生物数量,添加营养盐后,IS、OS中微生物数量都能明显增加。此外,YS中微生物数量增长最多,其细菌数量的lgN也较高,IS、OS的YS处理分别为8.9和6.5。特别是IS的YS处理,其细菌数量甚至可以恢复到比氧化前土壤更高的水平。结合表2可知,化学氧化导致土壤中的营养物质明显减少,因此在后续缺氧培养过程中提供微生物生长所需的营养物质是必要的。
可见,在缺氧条件下,尽管微生物恢复相比于好氧条件需要更长时间,但如果能够提供适宜的条件,如添加营养盐和电子受体等,化学氧化后土壤中微生物数量在缺氧条件下也能得到较好恢复。
2.3 化学氧化后缺氧培养对土壤中14种PAHs降解的影响
2.3.114种PAHs降解情况

注:图上字母不同表示处理间差异显著(P<0.05);字母相同表示处理间差异不显著(P>0.05)。图2 IS、OS不同处理培养180 d后土壤中3环PAHs保留率Fig.2 Percentages of 3- rings PAHs remaining in soil after 180 days by different treatments of IS and OS

注:图上字母不同表示处理间差异显著(P<0.05);字母相同表示处理间差异不显著(P>0.05)。图3 IS、OS不同处理培养180 d后土壤中4环PAHs保留率Fig.3 Percentages of 4- rings PAHs remaining in soil after 180 days by different treatments of IS and OS
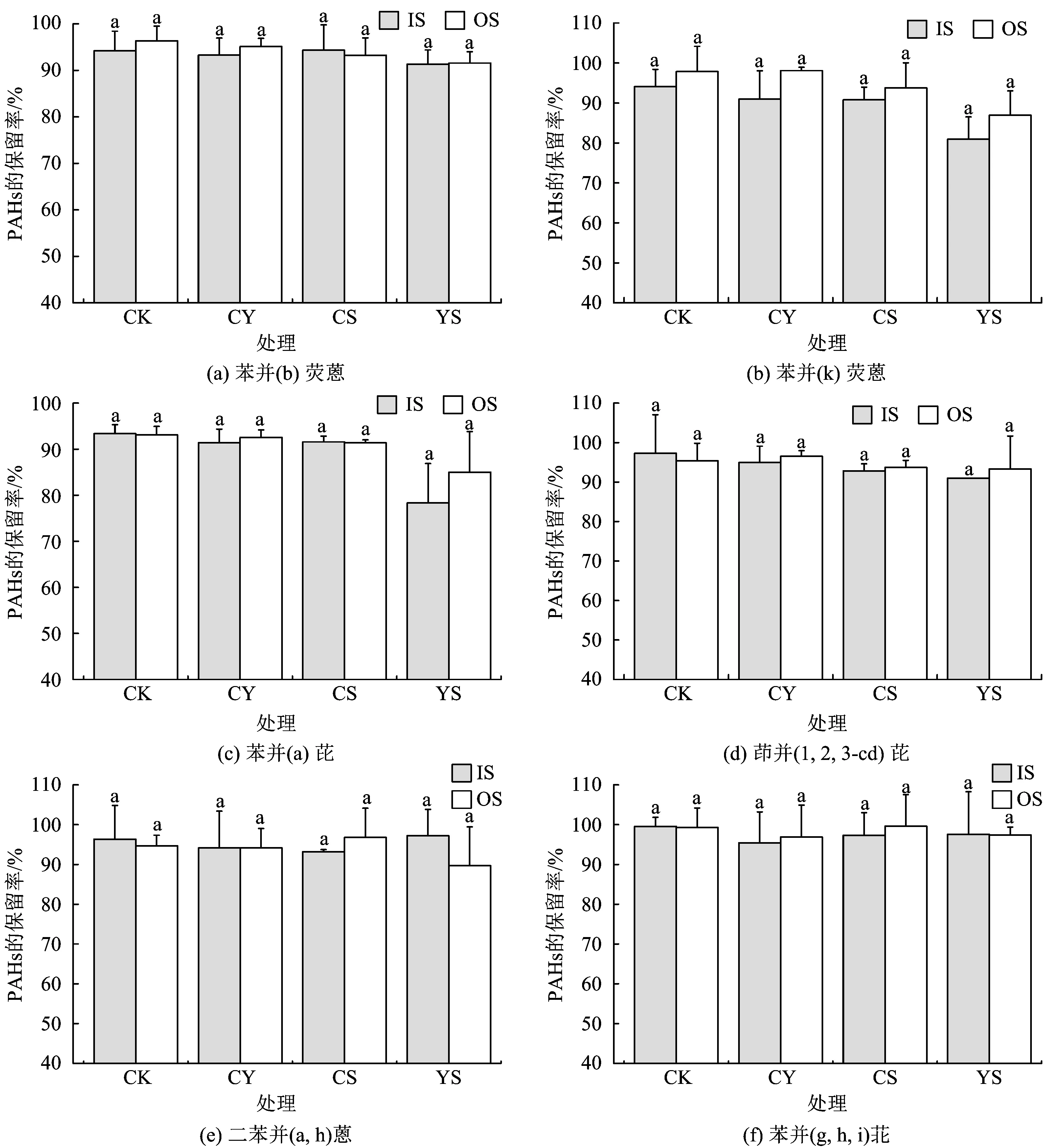
注:图上字母相同表示处理间差异不显著(P>0.05)。图4 IS、OS不同处理培养180 d后土壤中5环和6环PAHs保留率Fig.4 Percentages of 5- and 6- rings PAHs remaining in soil after 180 days by different treatments of IS and OS
化学氧化后,土壤中萘和苊烯的浓度非常低(表1),故后续的缺氧培养试验中不再考察这2种PAHs的降解情况。其余14种PAHs的降解情况如图2~图4所示。由图2~图4可知,CK中14种PAHs均没有发生明显的降解。这表明化学氧化后,若不采取任何措施增加微生物数量或提供电子受体等,土壤中的PAHs在较短的时间内(如180 d)很难缺氧降解。IS、OS分别单独施用营养盐或电子受体对14种PAHs仅起到较弱的降解作用。

2.3.2原因解析
由2.3.1节可知,单独施用硫酸盐电子受体或营养盐不能促进PAHs的降解,但同时添加营养盐和电子受体能促进PAHs的降解。在同时添加电子受体和营养盐时,接种微生物的处理中3环和部分4环PAHs(荧蒽和芘)的降解率普遍高于未接种微生物的处理。这可能是因为微生物、营养盐和电子受体都是PAHs微生物降解过程中不可缺少的因素[27- 28]。在缺氧条件下,电子受体是微生物降解PAHs所必需的[1,27],但由于土壤中电子受体数量往往不能满足微生物的需求,需要在土壤中添加更多的电子受体来提高微生物降解PAHs的效率[17,29]。由于化学氧化后土壤中微生物(图1)和营养盐(表2)都明显减少,氧化后接种土壤中的lgN比未接种土壤中高2.4(图1),而微生物数量是PAHs降解过程中的关键因素。因此,化学氧化后土壤中PAHs若要在缺氧条件下降解,接种一定数量的微生物是必要措施。
由2.3.1节可知,接种微生物、添加营养盐和电子受体均不能促进4环(除了荧蒽和芘)、5环和6环PAHs的降解,可能是这些PAHs自身的物理化学性质(高分子量、低水溶性、高辛醇- 水分配系数和复杂的苯环排列方式)所致[30]。此外,PAHs通常会吸附在土壤有机碳或矿物质表面导致其生物可利用性降低,而土壤中PAHs较低的生物可利用性是其降解缓慢的主要原因之一[5]。在缺氧条件下,微生物对不同PAHs降解的难易程度不同,其降解途径也存在较大差别。对于萘、芴、菲等小分子PAHs,缺氧微生物可以直接对其进行降解,而对于高环PAHs,缺氧微生物往往需要以共代谢的方式对其进行转化[31]。近年来,研究者对萘、菲等低环PAHs的缺氧微生物降解途径有了较清楚的了解,而对于4环及4环以上PAHs的降解途径研究较少。缺氧微生物对萘的降解根据起始反应差异分为羧基化和甲基化2种途径[31]。然而,近期的研究发现萘的降解途径只有羧基化[32]。Davidova等[33]研究发现,菲的缺氧降解途径可能与萘的缺氧降解途径相似。
2.4 化学氧化后缺氧培养对PAHs的降解效果
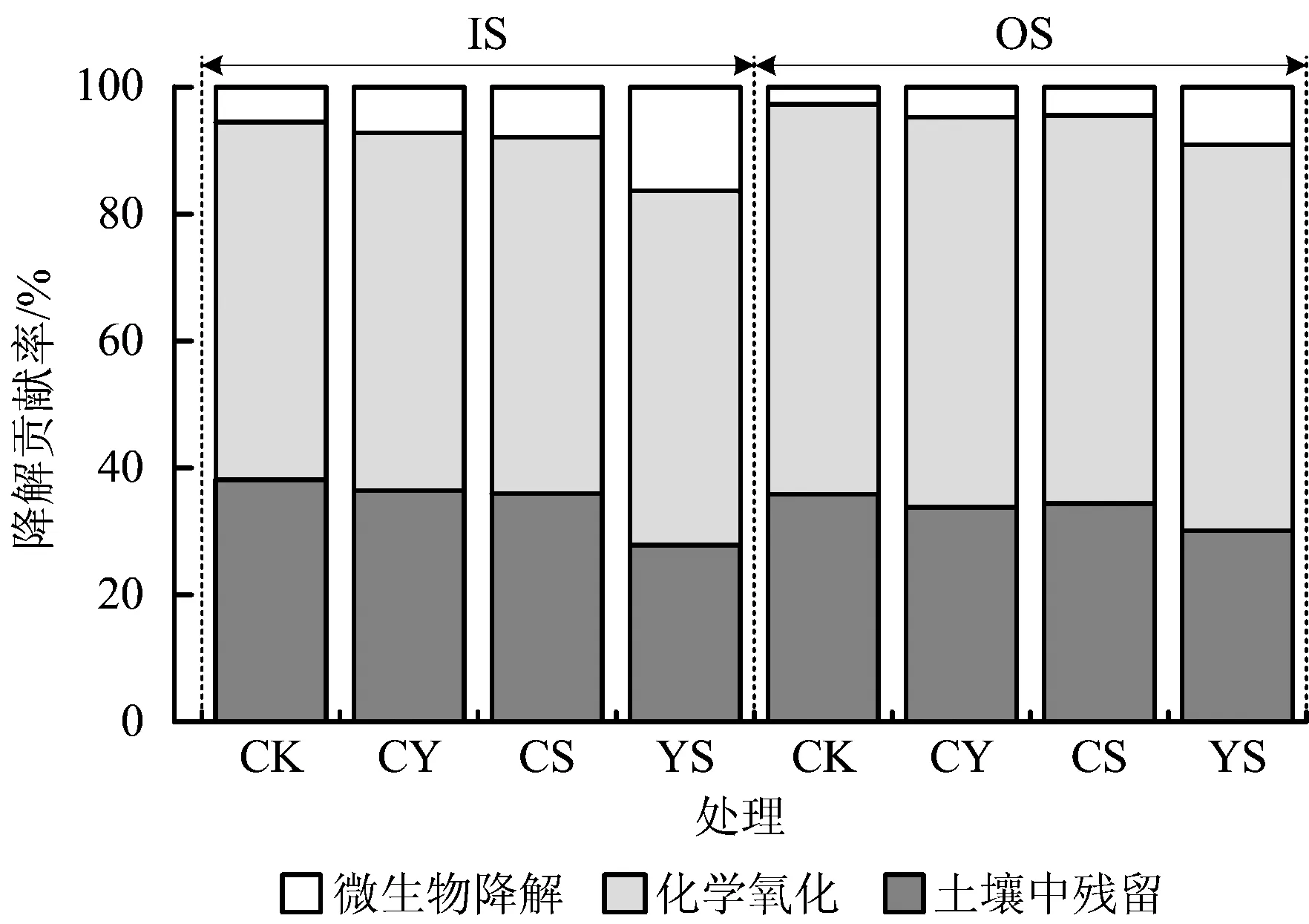
图5 IS、OS不同处理时化学氧化和缺氧微生物对PAHs的降解贡献率Fig.5 Removal efficiency of total PAHs by chemical oxidation and anoxic biodegradation in different treatments of IS and OS
IS和OS不同处理时化学氧化和缺氧微生物对土壤中PAHs降解贡献率如图5所示。由图5可知,化学氧化降解了大约50%的PAHs,经过180 d缺氧培养后,PAHs降解率进一步提高。其中,IS在YS的强化处理时,对PAHs的降解率在化学氧化的基础上提高了15%左右。IS在YS处理时化学氧化和缺氧微生物对14种PAHs的降解贡献率见图6所示。由图6可知,3环PAHs表现出明显的微生物降解,其降解贡献率为12.8%~19.7%;4环PAHs芘的微生物降解贡献率也较高,大于20%;但5环和6环PAHs未能发生明显的微生物降解,其降解贡献率小于6.2%。可见,化学氧化与缺氧微生物联合降解用于修复PAHs污染土壤是可行的。

图6 IS的YS处理时化学氧化和缺氧微生物对14种PAHs的降解贡献率Fig.6 Removal efficiency of 14 PAHs by chemical oxidation and anoxic biodegradation in YS treatments of IS
3 结论
(1)过氧化氢氧化对土壤中16种PAHs均表现出较好的去除效果,但同时也造成土壤中有机碳、营养物质和微生物数量减少。对过氧化氢氧化后的土壤采取一定的措施(添加营养盐和电子受体/接种微生物)且缺氧培养180 d后,土壤中微生物数量可以得到较好的恢复。
(2)过氧化氢氧化后的土壤缺氧培养180 d后,单独添加电子受体或营养盐未能明显提高PAHs的降解率,但同时添加电子受体和营养盐能够促进PAHs的微生物降解。
(3)添加电子受体和营养盐后,接种微生物的处理中3环和部分4环(荧蒽和芘)PAHs可以发生明显的降解,且其降解率明显高于未接种微生物的处理。化学氧化与缺氧微生物联合降解土壤中PAHs是可行的。
