牛大力根化学成分及其抑制破骨细胞产生活性
2020-01-09刘雅兰张毓婷滕希峰
刘雅兰,张毓婷,顾 琼,滕希峰,何 琳
1广东药科大学药学院;2中山大学药学院,广州 510006;3广东药科大学医药化工学院 广东省化妆品工程技术研究中心,中山 528458;4广东药科大学中药学院 国家中医药管理局岭南药材生产与开发重点研究室,广州 510006
牛大力(MillettiaspeciosaChamp.)是豆科崖豆藤属植物,别名血藤、猪脚笠、倒吊金钟、山莲藕、金钟根、大力薯、美丽崖豆藤等,主要分布于我国的福建、广西、广东、贵州、海南等地[1,2]。牛大力作为传统的药食同源植物在民间的食用历史悠久,主要用于腰肌劳损、肺虚咳嗽、风湿性关节炎、跌打损伤等疾病[3]。据报道,牛大力中化学成分包括异黄酮类、黄酮类、生物碱、香豆素和三萜等化合物[4- 6]。但牛大力根、茎和叶的化学成分有所不同,其中根部富含异黄酮类化合物,以高丽槐素为主[3]。近年来,因极高的经济及药用价值,牛大力在两广地区及香港等地的使用量逐年增多,造成了牛大力资源的短缺[2]。因此,深入研究牛大力显得十分必要。为了进一步研究其物质基础并寻找可能的抑制破骨细胞产生活性成分,我们对产于广西的牛大力干燥根部分进行了系统化学成分研究,从中提取分离到了11个化合物,分别鉴定为millettiaosa A(1)、高丽槐素(2)、medicarpin(3)、羽扇豆醇(4)、β- 谷甾醇亚油酸酯(5)、β- 谷甾醇(6)、单棕榈酸甘油酯(7)、二十七烷酸甘油酯(8)、香草醛(9)、琥珀酸甲酯(10)和1- 辛醇(11)。化合物5和10为首次从崖豆藤属中分离得到。同时测定了化合物1~11的抑制破骨细胞产生活性。其中化合物2、3、4和6显示出显著的抑制破骨细胞产生活性,其IC50分别为2.23、1.39、2.25和1.63 μM。其中化合物2为首次报道具有抑制破骨细胞产生活性。
1 仪器与材料
LC- MS液质联用仪(美国Agilent公司);1H NMR,13C NMR用Bruker Advance 500型或400型超导核磁共振仪(德国Bruker公司)测定,溶剂为CDCl3和CD3OD;柱层析填料:正相硅胶(200- 300目,青岛海洋化工有限公司),反相填充材料RP- 18(40- 75 μm,Biotage公司),Sephadex LH- 20(瑞典GE healthcare);GF254薄层层析正相硅胶板(青岛海洋化工有限公司);显色剂为10%的硫酸乙醇溶液;MEM-α培养基(美国Gibco);胎牛血清(美国Hyclone);青霉素和链霉素双抗溶液(美国Hyclone);巨噬细胞集落刺激因子(macrophage colony stimulating factor,mcsf);GST- rRANKL(中山大学药学院药物分子设计中心);DMSO(上海翌圣生物科技);MTT(上海翌圣生物科技);4%多聚甲醛(安徽Biosharp);TRAcP染色试剂盒(美国Sigma Aldrich)。
牛大力(M.speciosaChamp.)根部分于2017年11月采购于广西南宁邕宁区那楼镇屯吴农科组,由广东药科大学中药资源系滕希峰老师鉴定,标本存放于广东药科大学中药学院。
2 提取与分离
将牛大力(M.speciosaChamp.)根部分10.5 kg,粉碎后称重,加入适量95%乙醇,加热回流提取,提取3次,每次2 h。过滤回收提取液并减压浓缩得粗提物589.5 g。95%乙醇浸膏用水混悬后,依次用石油醚、二氯甲烷、乙酸乙酯萃取,每种溶剂萃取三次,得到石油醚萃取物56.0 g,二氯甲烷萃取物20.0 g,乙酸乙酯萃取物40.7 g。
石油醚部分经硅胶柱(200~300目),以石油醚- 乙酸乙酯(V石油醚/V乙酸乙酯= 100∶0、50∶1、20∶1、10∶1、5∶1、2∶1、1∶1、0∶1)梯度洗脱,得到A1- A15十五个组分。A5经反复硅胶柱层析,MCI和Sephadex LH- 20纯化,得到化合物5(8 mg)。A9经反复硅胶柱层析,MCI和Sephadex LH- 20纯化,得到化合物6(39 mg)和7(6 mg)。二氯甲烷部分经硅胶柱(200- 300目),以二氯甲烷- 乙酸乙酯(V二氯甲烷/V乙酸乙酯=100∶0、50∶1、20∶1、10∶1、5∶1、2∶1、1∶1、0∶1)梯度洗脱,得到B1- B4四个组分。B1经反复硅胶柱层析,MCI和Sephadex LH- 20纯化,得到化合物9(4 mg)。B2经反复硅胶柱层析,MCI和Sephadex LH- 20纯化,得到化合物1(8 mg)。B3经反复硅胶柱层析,MCI和Sephadex LH- 20 纯化,得到化合物4(6 mg)。乙酸乙酯部分经硅胶柱(200~300目),以二氯甲烷- 甲醇(V二氯甲烷/V甲醇=100∶0、50∶1、20∶1、10∶1、5∶1、2∶1、1∶1、0∶1)梯度洗脱,得到C1- C4 四个组分。C1经反复硅胶柱层析,MCI和Sephadex LH- 20纯化,得到化合物8(7 mg)。 C2经反复硅胶柱层析,MCI和Sephadex LH- 20纯化,得到化合物3(5 mg)和11(4 mg)。C3经反复硅胶柱层析,MCI和Sephadex LH- 20纯化,得到化合物10(3 mg)和2(6 mg)。
3 波谱数据和结构鉴定
化合物1淡黄色无定形粉末;C17H14O5,ESI- MS:m/z321 [M + Na]+;1H NMR(CDCl3,400 Hz)δH:7.36(1H,d,J=8.4 Hz,H- 1),6.72(1H,s,H- 11),6.55(1H,dd,J=8.3,2.6 Hz,H- 2),6.43(1H,s,H- 8),6.41(1H,d,J=2.6 Hz,H- 4),5.90(2H,d,J=11.0 Hz,OCH2O),5.47(1H,d,J=6.9 Hz,H- 6a),4.22(1H,dd,J=11.1,5.1 Hz,H- 6),3.63(1H,d,J=10.9 Hz,H- 6),3.47(1H,m,H- 12a),1.25(2H,m,H- 12);13C NMR(CDCl3,100 Hz)δC:132.2(C- 1),112.7(C- 1a),109.9(C- 2),157.3(C- 3),103.8(C- 4),156.8(C- 4a),66.6(C- 6),78.6(C- 6a),154.4(C- 7a),94.0(C- 8),148.2(C- 9),141.9(C- 10),104.9(C- 11),118.1(C- 11a),101.4(OCH2O),29.9(C- 12),40.30(C- 12a)。以上数据和文献[7]对照基本一致,故确定化合物为millettiaosa A。
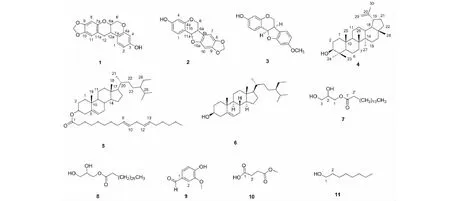
图1 化合物1~11的化学结构Fig.1 Chemical structures of compounds 1- 11
化合物2白色无定形粉末;C16H12O5,ESI- MS:m/z283.3 [M]+;1H NMR(CD3)2CO,400 Hz)δH:7.27(1H,s,H- 1),6.86(1H,d,J= 8.4,2.5 Hz,H- 2),6.52(1H,s,H- 7),6.36(1H,s,H- 4),6.32(1H,s,H- 10),5.87(2H,d,J= 11.8 Hz,OCH2O),5.46(1H,d,J= 6.8 Hz,H- 11a),4.24(1H,d,J= 10.5,4.5 Hz,H- 6α),3.59(1H,t,J= 10.5,9.5 Hz,H- 6β),3.54(1H,m,H- 6a);13C NMR(CD3)2CO,100 Hz)δC:133.1(C- 1),110.5(C- 2),159.8(C- 3),104.0(C- 4),157.8(C- 4a),67.1(C- 6),41.1(C- 6a),119.6(C- 6b),106.0(C- 7),142.5(C- 8),149.0(C- 9),94.0(C- 10),155.4(C- 10a),79.5(C- 11a),112.9(C- 11b),102.2(OCH2O)。以上数据和文献[8]对照基本一致,故确定化合物为高丽槐素。
化合物3黄色油状物;C16H14O4,ESI- MS:m/z271 [M + H]+;1H NMR(CDCl3,400 Hz)δH:7.38(1H,d,J=8.4 Hz,H- 1),7.13(1H,d,J=8.8 Hz,H- 7),6.56(1H,dd,J= 8.4,2.5 Hz,H- 2),6.46(1H,dd,J= 5.6,2.4 Hz,H- 8),6.46(1H,d,J= 2.4 Hz,H- 10),6.42(1H,d,J= 2.5 Hz,H- 4),5.49(1H,d,J= 6.7 Hz,H- 11a),4.23(1H,dd,J= 10.8,4.8 Hz,H- 6β),3.77(3H,s,9- OCH3),3.61(1H,d,J= 10.8 Hz,H- 6α),3.53(1H,ddd,J= 11.6,8.0,3.4 Hz,H- 6a);13C NMR(CDCl3,100 Hz)δC:132.3(C- 1),109.9(C- 2),156.8(C- 3),103.8(C- 4),157.3(C- 4a),66.7(C- 6),39.7(C- 6a),119.3(C- 6b),124.9(C- 7),106.5(C- 8),161.3(C- 9),97.1(C- 10),160.8(C- 10a),78.7(C- 11a),112.7(C- 11b),55.7(9- OCH3)。以上数据和文献[9]对照基本一致,故确定化合物为medicarpin。
化合物4白色粉末;C30H50O,ESI- MS:m/z426 [M]+;1H NMR(CDCl3,400 Hz)δH:4.68(1H,s,H- 29),4.57(1H,s,H- 29),3.19(1H,dd,J=11.2,5.1 Hz,H- 3),1.68(3H,s,30- CH3),1.01(3H,s,26- CH3),0.97(3H,s,23- CH3),0.94(3H,s,27- CH3),0.83(3H,s,25- CH3),0.79(3H,s,28- CH3),0.76(3H,s,24- CH3);13C NMR(CDCl3,100 Hz)δC:38.8(C- 1),27.6(C- 2),79.2(C- 3),39.0(C- 4),55.4(C- 5),18.5(C- 6),34.4(C- 7),41.0(C- 8),50.6(C- 9),37.3(C- 10),21.1(C- 11),22.9(C- 12),38.2(C- 13),43.0(C- 14),25.3(C- 15),35.7(C- 16),43.2(C- 17),48.4(C- 18),48.1(C- 19),151.1(C- 20),29.9(C- 21),40.2(C- 22),28.1(C- 23),15.5(C- 24),16.3(C- 25),16.1(C- 26),14.7(C- 27),18.2(C- 28),109.5(C- 29),19.5(C- 30)。以上数据和文献[10]对照基本一致,故确定化合物为羽扇豆醇。
化合物5淡黄色油状物;C47H80O2,ESI- MS:m/z677 [M + H]+;1H NMR(CDCl3,400 Hz)δH:5.43(4H,m,H- 9′,10′,12′,13′),4.61(1H,m,H- 3),2.77(2H,t,J=6.7 Hz,H- 11′),2.27(2H,t,J=7.4 Hz,H- 2′),2.10(4H,m,H- 8′,14′),1.68(m,- (CH2)n- ),1.02(3H,s,19- CH3),0.91(3H,s,21- CH3),0.89(3H,t,J=6.3 Hz,CH3),0.85(3H,m,29- CH3),0.84(3H,s,26- CH3),0.80(3H,s,27- CH3),0.68(3H,s,18- CH3);13C NMR(CDCl3,100 Hz)δC:37.2(C- 1),28.4(C- 2),73.8(C- 3),38.3(C- 4),139.9(C- 5),122.7(C- 6),32.1(C- 7),32.1(C- 8),50.2(C- 9),36.7(C- 10),21.2(C- 11),39.9(C- 12),42.5(C- 13),56.8(C- 14),24.4(C- 15),29.3(C- 16),56.2(C- 17),12.0(C- 18),19.5(C- 19),36.3(C- 20),19.2(C- 21),34.1(C- 22),26.2(C- 23),46.0(C- 24),29.5(C- 25),18.9(C- 26),20.0(C- 27),23.2(C- 28),12.1(C- 29),173.5(C- 1′),34.9(C- 2′),25.2(C- 3′),29.8(C- 4′),29.5(C- 5′),32.0(C- 6′),29.9(C- 7′),27.4(C- 8′),128.1(C- 9′),130.4(C- 10′),25.8(C- 11′),130.2(C- 12′),128.2(C- 13′),28.0(C- 14′),29.8(C- 15′),31.7(C- 16′),22.9(C- 17′),14.3(C- 18′)。以上数据和文献[11]对照基本一致,故确定化合物为β- 谷甾醇亚油酸酯。
化合物6无色针状结晶;C29H50O,ESI- MS:m/z437.5 [M + Na]+;1H NMR(CDCl3,500 Hz)δH:5.35(1H,d,J= 5.4 Hz,H- 6),3.59(1H,m,H- 3),1.01(3H,s,19- CH3),0.92(3H,d,J= 6.6 Hz,21- CH3),0.84(3H,t,J=7.8 Hz,29- CH3),0.81(3H,d,J=6.9 Hz,27- CH3),0.68(3H,s,18- CH3);13C NMR(CDCl3,125 Hz)δC:36.3(C- 1),29.9(C- 2),72.0(C- 3),39.9(C- 4),140.9(C- 5),121.9(C- 6),31.8(C- 7),42.5(C- 8),50.3(C- 9),36.7(C- 10),21.2(C- 11),37.4(C- 12),42.5(C- 13),56.2(C- 14),24.5(C- 15),28.4(C- 16),56.9(C- 17),12.0(C- 18),18.9(C- 19),34.1(C- 20),19.2(C- 21),32.1(C- 22),26.2(C- 23),46.0(C- 24),29.3(C- 25),19.6(C- 26),20.0(C- 27),23.2(C- 28),12.1(C- 29)。以上数据和文献[12]对照基本一致,故确定化合物为β- 谷甾醇。
化合物7白色粉末;C19H38O4;ESI- MS:m/z353 [M + Na]+;1H NMR(CDCl3,400 Hz)δH:4.24(1H,m,H- 1a),4.16(1H,m,H- 1b),3.96(1H,m,H- 2),3.69(1H,dd,J=11.4,3.9 Hz,H- 3a),3.59(1H,dd,J=11.5,5.8 Hz,H- 3b),2.34(2H,t,J=7.6 Hz,H- 2′),1.62(2H,d,J=7.3 Hz,H- 3′),1.25(24H,s,H- 4′~15′),0.87(3H,t,J=6.6 Hz,16′- CH3);13C NMR(CDCl3,100 Hz)δC:65.3(C- 1),70.4(C- 2),63.5(C- 3),174.5(C- 1′),34.3(C- 2′),32.1(C- 3′),14.3(C- 16′)。以上数据和文献[13]对照基本一致,故确定化合物为单棕榈酸甘油酯。
化合物8白色粉末状结晶;C30H60O4,ESI- MS:m/z507.7 [M + Na]+;1H NMR(CDCl3,400 Hz)δH:4.23(2H,m,H- 1),3.96(1H,m,H- 2),3.70(1H,dd,J= 11.5,4.0 Hz,H- 3b),3.60(1H,dd,J= 11.4,5.8 Hz,H- 3a),2.35(2H,t,J=7.6 Hz,H- 2′),1.69(2H,m,H- 3′),1.25(46 H,m,H- 4′~H- 26′),0.87(3H,t,J=6.6 Hz,27′- CH3);13C NMR(CDCl3,100 Hz)δC:65.3(C- 1),70.4(C- 2),63.5(C- 3),174.5(C- 1′),34.3(C- 2′),32.1(C- 3′),29.9~29.8(C- 4′~C- 19′),29.6(C- 20′),29.5(C- 21′),29.4(C- 22′),29.3(C- 23′),25.1(C- 24′),22.8(C- 25′),14.3(C- 27′)。以上数据和文献[14]对照基本一致,故确定化合物为二十七烷酸甘油酯。
化合物9无色针状结晶;C8H8O3,ESI- MS:m/z151 [M- H]+;1H NMR(CDCl3,400 Hz)δH:9.83(1H,s,1- CHO),7.43(1H,d,J=6.3 Hz,H- 6),7.26(1H,s,H- 2),7.04(1H,d,J=8.5 Hz,H- 5),5.30(1H,s,4- OH),3.97(3H,s,3- OCH3);13C NMR(CDCl3,100 Hz)δC:130.0(C- 1),108.9(C- 2),147.3(C- 3),151.8(C- 4),114.5(C- 5),127.7(C- 6),191.1(CHO),56.3(3- OCH3)。以上数据和文献[15]对照基本一致,故确定化合物为香草醛。
化合物10无色油状物;C5H8O4,ESI- MS:m/z155 [M + Na]+;1H NMR(CDCl3,500 Hz)δH:3.70(3H,s,4- OCH3),2.71(2H,m,H- 2),2.66(2H,m,H- 3);13C NMR(CDCl3,125 Hz)δC:177.3(COOH),172.9(COO),52.1(OCH3),29.9(C- 2),28.8(C- 3)。以上数据和文献[16]对照基本一致,故确定化合物为琥珀酸甲酯。
化合物11白色油状物;C8H18O,ESI- MS:m/z153.4 [M + Na]+;1H NMR(CDCl3,400 Hz)δH:3.66(2H,s,H- 1),1.42(2H,s,H- 2),1.25(n×CH2),0.89(3H,t,J=6.4 Hz,8- CH3);13C NMR(CDCl3,100 Hz)δC:77.4(C- 1),32.1(C- 2),30.5(C- 3),29.9(C- 4),29.5(n×CH2),22.9(C- 7),14.3(C- 8)。以上数据和文献[17]对照基本一致,故确定化合物为1- 辛醇。
4 化合物的抑制破骨细胞产生活性筛选
采用体外RANKL诱导分化的成熟的破骨细胞(osteoclast,OC),评价11个化合物的抑制破骨细胞产生活性。
分离正常C57BL/6J小鼠骨髓单核巨噬细胞(bone marrow macrophage,BMM),将BMM细胞以6×104个/mL接种于96孔板中,每孔100 μL,细胞培养过夜后,用完全培养基配置待测化合物,所有化合物的终浓度均为10 μM,弃去板中原有的培养基,将配置好的化合物分别加入孔中。同时加入M- CSF和GST- rRANKL,使培养液中M- CSF和GST- rRANKL的终浓度分别为30和50 ng/mL。每两天换药一次,直至第4或第5天对照组出现明显的细胞融合。弃去培养基,用4%的多聚甲醛固定30 min。之后用dd H2O轻轻洗三次,加入配好的TRAcP染液,37 ℃孵育30 min直至出现颜色。将板置于光学显微镜下观察,将细胞核大于等于三个的融合细胞视作破骨细胞,计数,结果见图2与图3。用多功能酶标仪工作站检测其在 540 nm 处的吸收强度。
活性测试结果发现化合物2、3、4和6具有显著的抑制破骨细胞产生活性,其IC50值分别为2.23、1.39、2.25和1.63 μM。

图2 化合物1~11的抑制破骨细胞产生活性Fig.2 Inhibitory effects of compounds 1- 11 on osteoclastic cell formation activity
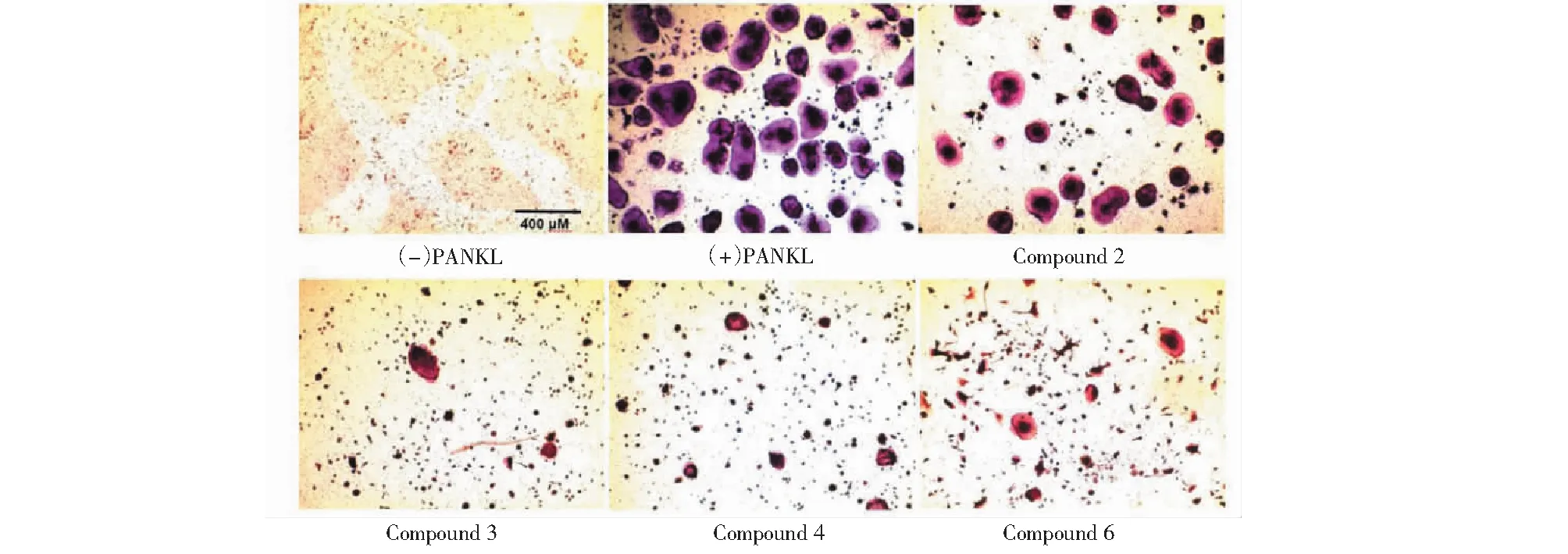
图3 破骨细胞的TRAcP染色图片 Fig.3 Pictures of osteoclasts stained with TRAcP注:化合物2、3、4和6的浓度均为10 μM。Note:Concentrations of compounds 2,3,4 and 6 are all 10 μM.
5 结论
本研究从牛大力(M.speciosaChamp.)根的乙醇提物中分离鉴定了11个化合物,化合物5和10为首次从崖豆藤属中分离得到。对分离到的11个化合物进行抑制破骨细胞产生活性研究,其中化合物2、3、4和6有显著的抑制破骨细胞产生活性。化合物5是化合物6碳3位被亚油酸取代,未显示抑制破骨细胞产生活性,说明3位长链脂肪酰基取代不利于抑制破骨细胞产生活性。化合物2为首次报道具有抑制破骨细胞产生活性。本研究,为牛大力在骨性疾病上的应用以及牛大力的进一步开发应用提供了依据。
