联合有氧运动对高脂血症大鼠影响
2020-01-08田祯祥耿青青徐德刚
田祯祥,耿青青,徐德刚
(1.枣庄学院体育学院,山东 枣庄 277160;2.山东体育学院,山东 济南 250001)
近年来,随着生活质量的提高和生活方式的改变,高血脂症患病率正逐年递增,这是诱发脂肪肝、冠心病、动脉粥样硬化等疾病的首要因素,患者机体脂质代谢紊乱的同时伴随着整体抗氧化水平的显著降低。HO/CO系统体内有HO-1、HO-2、HO-3三种同工酶,作为一种新兴的内源性介质,该系统对机体抗氧化、抗炎症、抗细胞增殖等方面具有重要的作用。其中,HO-1是一种对多种细胞有应激反应的血液降解酶,在传统上被认为能够产生对氧化应激、炎症和血管收缩的适应性反应[1],到目前为止已经发现HO-1在所有细胞类型的研究中都会产生反应,其亚细胞的定位、表达水平、诱导性和功能与病理状态下高度相关[2]。HO-1的作用机制包括NF-кB、sGC、Akt-eNOS以及MAPKs多个通路,MAPKs通路最为重要,MAPKs能够调节细胞的生长、凋亡、分化以及对环境、刺激的反应[2,3]。内源性CO主要由HO-1/CO系统中血红素合酶对血红素的分解而来,是细胞重要的信使分子,通过激活可溶性cGMP,可增加环鸟苷酸的合成,发挥信使作用[4]。越来越多研究表明,HO-1及其反应产物胆红素和CO在心脏缺血性诱导损伤(如心肌梗死、缺血再灌注损伤和梗死后结构重构等)中具有特殊的保护作用。CO也被证明介导了许多有益的HO-1作用,包括抗氧化损伤、调节细胞凋亡、调节炎症和促进血管生成。
激素敏感脂肪酶(Hormone-sensitve lipase,HSL)是存在于多种动物体内,调节脂肪分解的关键酶。研究发现,高脂血症中的脂质代谢紊乱与基因的改变有关,同时也与HSL的活性密切相关。前人在对肌肉、胰腺、睾丸、肾上腺等组织的研究中发现,HSL不仅对此有所反应,而且发挥的作用更加独特。现有研究表明饥饿、禁食、运动等生理刺激可以通过激活肾上腺素能系统,再激活PKA,进而激活HSL等酶和相关蛋白质,最终刺激脂肪分解和增加脂肪动员[5]。脂蛋白脂肪酶(lipoprteinpase,LPL)是在脂质代谢和运转中起到关键作用的酶类物质,它不仅调控各种脂蛋白,而且参与降解血浆中富含脂质的脂蛋白,因此与机体脂代谢密切相关[6]。
中药降脂由来已久,常用的药材有荷叶、绞股蓝、紫苏叶等。荷叶中的槲皮素、生物碱和黄酮类等有效成分,具有抑制胰脂肪酶、抗氧化、抑菌等药理作用[7]。紫苏叶主要含有多糖类和黄酮类化合物,其中黄酮类化合物是调节血脂的功能因子,可有效降低甘油三酯,防止动脉硬化。绞股蓝的提取物绞股蓝总苷素有“南方人参”之称,有防止高脂血症、动脉粥样硬化的作用[8]。本实验所采用的复方中药制剂是由荷叶、紫苏叶、绞股蓝的提取物,以2∶1∶1的比例混合而成的,富含多种活性成分,如黄酮类化合物、β-胡萝卜素、α-生育酚、维生素C等。本实验选取SD大鼠为实验动物模型,以荷叶、紫苏叶及绞股蓝3种植物提取物为原料制成的中药复方制剂,笔者将其加以有氧运动作为对比联合实验,以探究HO-1/CO系统在脂质紊乱机体降脂过程中可能发挥的保护作用。
1 材料方法
1.1 动物与分组
雄性 SD大鼠(体重100~180 g,购于广东省实验动物中心), SPF级喂养, 室内空气流通,温度23±2 ℃,湿度50 %~60 %,昼夜节律用日光灯控制,每日光照时间12小时。大鼠分笼饲养,每笼4只,基础饲料选用由广东省实验动物中心提供的国家标准啮齿类动物混合饲料; 高脂饲料配方为78.8%基础饲料,1%胆固醇,10%蛋黄粉,10%猪油,0.2%胆盐。大鼠自由进食,饮水。动物饲养笼具、饮水瓶定期消毒,动物房内定期用紫外灯照射消毒。
动物适应性喂养一周后,取静脉血测定血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C),按 TC水平和体重分为对照组(C组)、复方中药制剂组(M组)、单纯有氧运动组(Y1组)、中药+有氧运动组(Y2组)。实验开始时,各组间体重与TC均无明显差异,P>0.05。如表1所示:
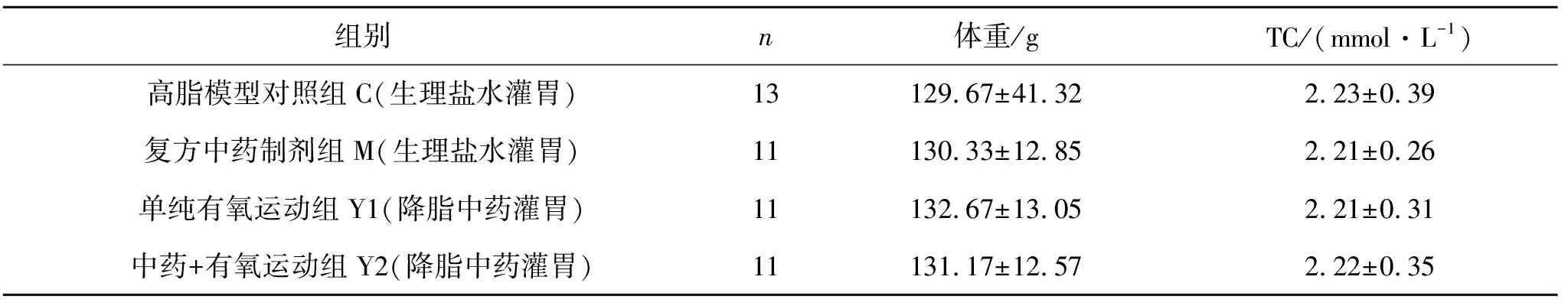
表1 实验前大鼠体重、TC比较(X±S)
本实验所采用的荷叶、紫苏叶及绞股蓝提取物复方制剂由广州一方制药有限公司提供。造模30 d后,复方中药制剂组(M组)和中药+有氧运动组(Y2组)进行中药制剂灌胃;高脂模型对照组(C组)、有氧运动组(Y1组)每天进行同剂量的生理盐水灌胃。灌胃标准为300 mg/kg体重,灌胃量为0.5 ml/100g,相当于70 kg成人饮用250 ml的量。连续治疗5周。
1.2 运动训练方案
运动组(Y1、Y2组)大鼠先进行一周的适应性运动训练:跑台(0°,10 mmin),持续运动10分钟;运动实验前2 h禁食,所有大鼠正式实验前半小时灌胃。运动组大鼠进行5周训练,每周6日,每天1次,每次30 min,25 m/s的有氧运动。
1.3 检测指标
本研究测试以下指标:大鼠血清T-AOC值、骨骼肌和心肌血红素氧合酶1(HO-1)水平及 CO含量、骨骼肌甘油三酯及骨骼肌HSL与LPL酶活性。
1.3.1 血清总抗氧化能力(T-AOC值)的测定
采用化学比色法测定,试剂盒购于南京建成生物工程研究所。将试剂及样本参照说明书比例混入,用旋涡混匀器充分混匀,放置10min,96孔板加样双蒸馏水调零,测各管吸光值。1cm光径,520nm处测各吸光度,代入以下公式并进行计算:
1.3.2 大鼠心肌和骨骼肌组织HO-1的测定
分别称取适量的骨骼肌和心肌放入玻璃匀浆器中,加入生理盐水在冰浴中充分研磨,制成浓度为10 %的溶液,3000 转/min 离心30 min,吸取上清液分装待测。用纯化的抗体包被微孔板,做成固相载体,在微孔中依次加入标本或标准品、生物素化的抗目的蛋白抗体、HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。用酶标仪在450 nm波长下测定吸光度(OD值),计算样品浓度。
1.3.3 大鼠心肌和骨骼肌组织CO含量的测定
通过722分光光度计测定样品568 nm与581 nm的吸光度,计算ΔOD的绝对吸光值差,再由标准曲线,通过回归方程计算得出待检稀释碳氧血红蛋白百分比浓度,即HbCO %。
取未处理的10 %组织匀浆上清液0.05 ml,加入2.5 ml的血红蛋白测定应用液,混匀,静置5分钟后,用1 cm光径蒸馏水调零,540 nm测定各管吸光度值。
组织匀浆中血红蛋白含量的计算公式为:血红蛋白克数/升=540 nm处吸光度值*73.54
1.3.4 组织匀浆中组织蛋白的测定:
混匀,放入37 ℃水浴10分钟,流水冷却后,波长540 nm,光径1 cm,用蒸馏水调零,测各管吸光度OD值
蛋白含量mg/ml=(测定管OD值-空白管OD值)/(标准管OD值-空白管OD值)×蛋白标准浓度(mg/ml)
1.3.5 肌内甘油三酯(IMTG)的测定
肌内甘油三酯(IMTG),试剂盒购于创烨生物有限公司。采用722分光光度计,将波长调为546 nm,光径调为10 mm进行测定。
1.3.6 HSL与LPL活性的测定
HSL与LPL活性采用固相夹心酶联免疫吸附法,严格按照试剂盒操作步骤进行测定, 实验仪器为TECAN Infinite M200瑞士TECAN公司,由广州体院提供。
操作步骤
1.4 数据统计处理
本研究数据用SPSS20.0统计软件进行处理,以均值±标准差(M±SD)表示,并用独立样本T检验进行各组间的差异显著性检验。P<0.05为差异具有显著性,P<0.01为差异有极显著性。
2 结果与分析
2.1 复方中药制剂联合有氧运动干预后大鼠体重和血清总抗氧化能力(T-AOC)的变化
相对于对照组(C组)大鼠体重,复方中药制剂组(M组)、单纯有氧运动组(Y1组)和运动+中药组(Y2组)体重数分别降低了4.13(P<0.05)、4.97(P<0.05)和5.35(P<0.01)。提示:复方中药制剂和有氧运动均具有减脂降体重的作用,单纯有氧运动干预较复方中药制剂干预的降体重效果更明显,而两者结合效果更好(见表2)。
相对于对照组(C组)大鼠的血清总抗氧化能力(T-AOC),复方中药制剂组(M组)、单纯有氧运动组(Y1组)和运动+中药组(Y2组)分别升高了24.67 %(P>0.05)、33.92 %(P<0.05)和45.37 %(P<0.01)。这表明复方中药制剂和有氧运动均能不同程度地提高机体抗氧化水平且有氧运动改善机体抗氧化系统的作用较显著(P<0.05);此外,两种因素联合干预具有累加效应,即Y2组较C组具有非常显著性差异(P<0.01),这表明机体在服用复方中药制剂的同时坚持有氧运动更有利于提高机体抗氧化能力,但两者是否是简单的累积效应仍需进一步的研究。

表2 复方中药制剂结合有氧运动对比大鼠体重和血清总抗氧化能力的影响(M±SD)
注:与高脂模型对照组(C)比较,*P<0.05,有显著性差异,**P<0.01,有非常显著性差异;与单纯有氧运动组(Y1)比较,△P<0.05,有显著性差异,△△P<0.01,有非常显著性差异;与复方中药制剂组(M)组比较,◇P<0.05,有显著性差异,◇◇P<0.01,有非常显著性差异
机体抗氧化能力由多方面因素决定,如抗氧化酶活性、自由基的产生与清除体系的动态平衡等,但T-AOC/MDA的变化更能反映自由基产生与清除的平衡关系,作为反映整个抗氧化防御系统的适应性指标,其意义更加重大[9]。为了增加其非凡的抗氧化能力,胆绿素和胆红素都可以通过抑制活性氧(ROS)的形成来调节细胞氧化还原状态,有效中和脂质过氧化作用,通过降低白细胞黏附分子和中性粒细胞黏附的表达来发挥抗炎作用[10]。该结果揭示:中药制剂中的生物碱、黄酮类成分和绞股蓝总苷素等多种活性成分有影响脂肪的分解与合成的作用,另一方面有氧运动促进脂肪的燃烧,增加了脂肪的动员和分解,抑制脂肪的合成。因此,在选择有效中药制剂的同时,结合适量的运动会使减肥效果更好。
2.2 复方中药制剂结合有氧运动干预后大鼠骨骼肌和心肌HO-1水平的变化
表3中显示,大鼠骨骼肌组织中HO-1含量的变化:相对于对照组C组,中药组(M组)HO-1降低了21.43 %(P<0.01),单纯有氧运动组(Y1)和运动+中药组(Y2组)较中药M组有所回升,但仍分别低于对照组(C组)11.53 %(P>0.05)和17.10 %(P<0.05)。大鼠心肌组织中HO-1含量的变化:与高脂模型对照组(C)相比,复方中药制剂组(M组)和有氧运动+中药组(Y2组)分别降低了20.76 %(P<0.05)和16.39 %(P<0.05),单纯有氧运动组(Y1组)升高了8.95 %(P>0.05)。心肌组织各组HO-1含量与骨骼肌组织相应各组HO-1含量比较,均没有显著性差异(P>0.05)。

表3 有氧运动结合复方中药制剂对比肥胖大鼠骨骼肌HO-1水平的影响(M±SD)
注:与高脂模型对照组(C)比较,*P<0.05,有显著性差异,**P<0.01,有非常显著性差异;与单纯有氧运动组(Y1)比较,△P<0.05,有显著性差异,△△P<0.01,有非常显著性差异;与复方中药制剂组(M)组比较,◇P<0.05,有显著性差异,◇◇P<0.01,有非常显著性差异
本实验中,骨骼肌和心肌的Y1组HO-1水平较M组和Y1组呈升高状态,可以推测有氧运动与复方中药制剂提高机体抗氧化能力的机制是完全不一样的。提示:有氧运动通过升高HO-1表达抑制机体病理状态,而复方中药制剂是通过降低血脂等有害因子进而使HO-1表达降低,具体机制有待进一步研究。国内已有研究证明长期运动可以激发主动脉平滑肌中的HO-CO的活性水平,并且随着运动负荷的增加,HO-CO的活性可相应上调[11]。笔者在本文对骨骼肌和心肌中也得到了相应的结论。
骨骼肌中M组HO-1水平较C组显著下降,具有非常显著性差异,表明伴随复方中药制剂增强机体抗氧化能力的同时,应激升高的HO-1有所回落;Y1组HO-1水平较M组升高,但仍低于C组,两者之间没有显著性差异,这一现象提示考虑增加正常体重个体与肥胖个体的对比研究,更能有效探讨有氧运动对HO-1/CO系统的影响机制;Y2组HO-1水平则介于M组和C组之间,较C组降低明显,具有显著性差异,可以推测有氧运动可以部分抵消复方中药制剂引起的HO-1的回落。
大鼠心肌的HO-1水平与骨骼肌HO-1水平变化趋势基本一致,但整体上,心肌HO-1水平略高于骨骼肌HO-1水平,组间比较没有显著性差异。但有研究[12]表明,外界应激因素对HO-1/CO体系的影响具有组织选择性,这可能与HO-1/CO在不同组织的表达不同有关。
2.3 有氧运动结合复方中药制剂干预后大鼠心肌和骨骼肌CO含量的变化
从表4我们可以得知大鼠心肌组织CO含量的变化:单纯运动组(Y1组)、运动+中药组(Y2组)和复方中药制剂组(M组)分别较高脂模型对照组(C组)降低了20.95 %(P>0.05)、39.44 %(P<0.01)和52.91 %(P<0.01),复方中药制剂组(M组)较单纯有氧运动组(Y1组)降低了40.43 %(P<0.05)。
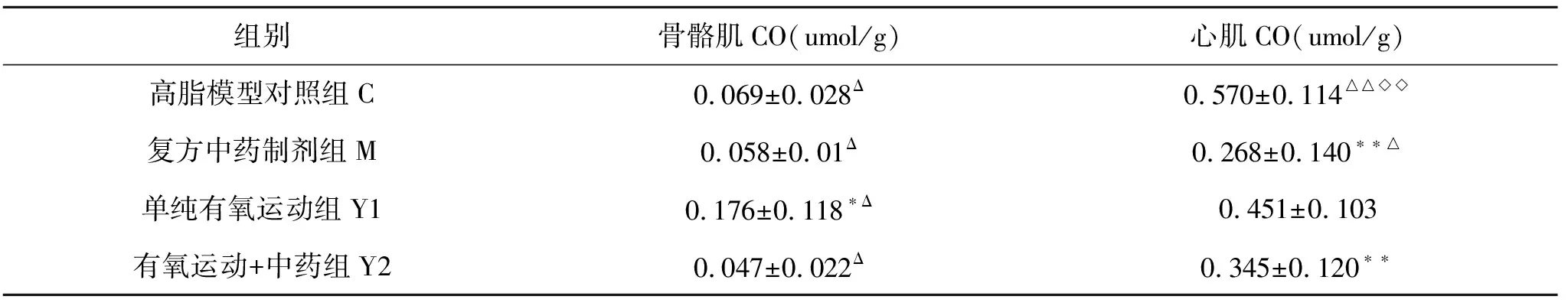
表4 有氧运动结合复方中药制剂对比肥胖大鼠心肌CO含量的影响(M±SD)
注:与高脂模型对照组(C)比较,*P<0.05,有显著性差异,**P<0.01,有非常显著性差异;与单纯有氧运动组(Y1)比较,△P<0.05,有显著性差异,△△P<0.01,有非常显著性差异;与复方中药制剂组(M)组比较,◇P<0.05,有显著性差异,◇◇P<0.01,有非常显著性差异
大鼠骨骼肌组织CO含量的变化为复方中药制剂组(M组)与运动+中药组(Y2组)较高脂模型对照组分别降低了16.01 %(P>0.05)、32.81 %(P>0.05),单纯有氧运动组(Y1组)较高脂模型对照组(C组)显著升高(P<0.05);心肌各组CO含量高于骨骼肌中相应各组CO含量(P<0.01)。
心肌中CO的含量明显高于骨骼肌,提示内源性CO可能在心肌中发挥着更重要的作用,以往的研究也多集中在心血管系统,心血管系统被认为是细胞内的信号分子,具有增加血管弹性、抗炎和抗凋亡[13]、抑制血管平滑肌细胞增殖[12]和诱导血管生成的特性。同时也有研究报道Hb通过其降解产物(铁、胆绿素及CO)产生毒性作用[13],红细胞溶解后释放Hb,产生血红素,同时诱导HO-1的明显上调。本实验数据显示,骨骼肌组织中整体CO含量较低,较心肌组织相应各组比较具有非常显著性差异,但骨骼肌组织Y1组CO含量较其各组CO含量显著升高,鉴于此推测相对心肌而言,骨骼肌CO的反应受运动的影响较大。虽然骨骼肌总的CO含量较少,但其受到运动刺激的反应明显,具体机制有待进一步研究。
另外,大鼠心肌组织中HO-1与CO的反应呈正性相关,推测CO的产生受到HO-1的影响,这可能与心脏是心血管循环系统的主要器官,富含各种血色素蛋白,担负着机体血液循环的重要功能有关。骨骼肌中HO-1与CO表达并不一致,骨骼肌组织中HO-1水平在高脂模型对照组(C组)中表达最显著,复方中药制剂组(M组)和有氧运动组(Y1组)中HO-1都有所降低,有氧运动+中药组处于M组和Y1组之间,而CO的表达则是Y1组最高,与其他各组比较均有显著性差异,笔者推测其原因是骨骼肌中有较多的CO是由有机分子的氧化产生,特别是微粒体膜上类脂的过氧化。
2.4 有氧运动结合复方中药制剂干预后大鼠骨骼肌甘油三酯含量的变化
实验结果表明:与对照组(C组)相比,复方中药制剂组(M组)、单纯有氧运动组(Y1组)以及运动+中药组(Y2组)骨骼肌内甘油三酯含量均有所下降(P<0.05),与Y,Z组大鼠差异无显著性。经过6周实验后,模型对照组骨骼肌内甘油三酯含量最高为0.0366±0.0046 mmol/L,各实验组大鼠与模型对照组相比,骨骼肌内甘油三酯含量均有所下降。运动组(Y1),和中药组(M)骨骼肌内甘油三酯含量分别降低了17.49 %(P>0.05)、和17.49 %(P>0.05),这说明有氧运动和降脂中药制剂均有使骨骼肌甘油三酯减少的作用。运动加中药组(Y2)骨骼肌内甘油三酯含量只有0.025 5±0.005 2 mmol/L,降低了30.32 %(P<0.05),说明有氧运动与中药制剂对肌内甘油三酯氧化增加有协同作用。目前有关中药对肌内甘油三酯影响的研究较少,但是中药制剂能起到预防性减肥和降脂的作用,其原因可能是本实验所采用的复方中药制剂是由荷叶、紫苏叶及绞股蓝组成,它们均含有大量活性成分,前人的研究显示荷叶、紫苏叶及绞股蓝均有调节血脂的作用,都能使甘油三酯含量下降。有研究[14-15]通过对生物总碱干预高脂血症大鼠,提示荷叶生物总碱能明显抑制大鼠的体重增长,使甘油三酯下降。紫苏中富含的α-亚麻酸能够改变大鼠脑和肝脏中的脂肪酸含量,也可以降低血清中较高的甘油三酯含量(见表5)。

表5 骨骼肌内甘油三酯含量比较(X±S)
注: 和对照组比较*P<0.05,有显著性差异
2.5 有氧运动结合复方中药制剂干预后大鼠骨骼肌HSL酶活性变化
脂肪沉积受饮食、内分泌、神经及自身等多方面因素的影响,这决定了它将是一个复杂的生理生化过程。动物体内脂肪代谢始终处于动态平衡的状态,其限速酶活性受到激素的调控,故称为激素敏感脂肪酶。经过6周实验后,与模型对照组(C)相比,其余三组大鼠骨骼肌HSL酶活性均有不同程度升高。实验结果显示:运动组(Y1),中药组(M)大鼠骨骼肌 HSL酶的活性,分别升高了25.08%(P>0.05)和17.92%(P>0.05),说明降脂中药制剂与有氧运动都有提高骨骼肌HSL酶活性的作用。运动加中药组(Y2)骨骼肌HSL酶的活性比对照组升高了49.73%(P<0.05)。降脂中药制剂结合有氧运动提高骨骼肌HSL酶活性的效果显著,表明降脂中药制剂的作用机理与提高大鼠骨骼肌LPL和HSL酶活性有关。其可能原因是:制剂中每种植物的活性成分都具有减肥降脂的作用,并能使脂蛋白代谢酶活性发生变化。降脂中药中的有效成分不仅能够降低甘油三酯含量,还能上调HSLmRNA与LPLmRNA的表达,使其酶活性升高(见表6)。

表6 骨骼肌HSL酶的活性比较(X±S)
注: 和对照组比较*P<0.05,有显著性差异
2.6 有氧运动结合复方中药制剂干预后大鼠骨骼肌LPL酶活性变化
本研究发现经过6周实验,与高脂模型对照组相比,中药组(M)大鼠骨骼肌LPL活性上升了3.65%。目前关于降脂中药对骨骼肌LPL活性的影响研究较少,有待深入研究。但有关实验研究发现绞股蓝总皂甙能使 LPL酶活性增高,而酶活性的增加能加快TG脂蛋白的代谢,降低血清和组织TG的含量;黄酮类物质也可以改变脂肪组织与骨骼肌组织中LPL的活性比值,从而影响血浆脂蛋白及TG水平。研究显示,荷叶黄酮对高脂血症大鼠有明显降低体重、降低血清胆固醇、降低血清甘油三酯和升高血清HDL-C和血清脂蛋白脂酶(LPL)活力的作用(见表7)。
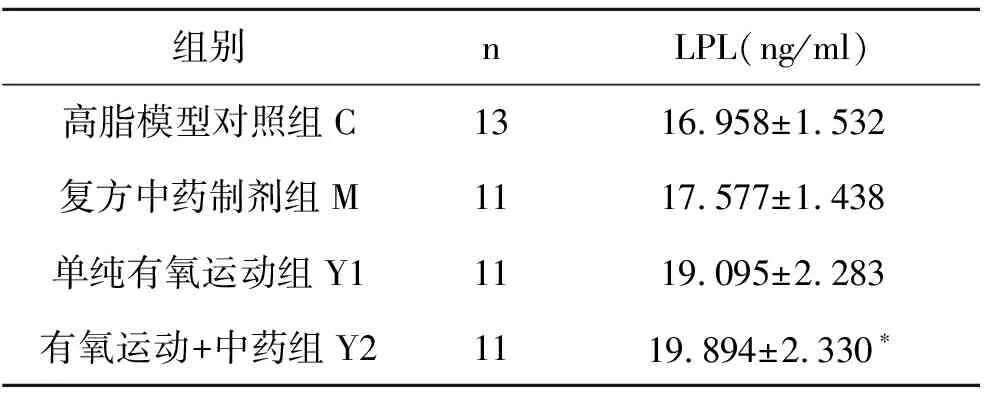
表7 骨骼肌LPL酶的活性比较(X±S)
注: 和对照组比较*P<0.05,有显著性差异
3 讨论
高脂血症是血浆脂质浓度超出正常值的病理症状。中医学中并无“高脂血症”这一名称,但其症状多散见于“肥胖、中风、眩晕、失眠”等病的记载中,属中医学中的“污血病”范畴[13-15]。高脂饮食诱导高脂血症后会造成体内自由基的大量增加,同时伴随自由基清除能力的下降[14]。T-AOC作为机体酶类和非酶类抗氧化物的总水平,其参数水平的变化可以反映机体自由基抗氧化系统。高脂饮食诱发高脂血症后可造成实验大鼠血清中抗氧化物酶活性下降,自由基产生过量,体内脂质过氧化反应增强,导致过氧化损伤的发生。本实验结果显示:复方中药制剂和有氧运动可有效地逆转高脂饮食造成的机体抗氧化能力下降。
现代学者为提高内源性抗氧化能力,尝试了多种方法,但到目前为止尚无有效方法能够快速促进机体抗氧化能力。一项有趣的研究甚至提出通过HO-1控制参与ROS生成的含血红素蛋白的活性来降解血红素[17]。前人已通过较多研究发现,经过科学有效地运动训练个体,其肌肉中抗氧化酶和非酶抗氧化物水平有升高的趋势,并对运动引起的或与之相关的氧化应激产生较高的耐受性[18]。我们推测这些适应可归因于重复训练对抗氧化酶基因在体内表达的累积效应,正如Finkel和Holbrook[19]提出的氧化应激本身就是提高机体内源性抗氧化能力的最好方法。本实验所用的三种中药复方制剂,因其有效成分使机体血脂水平及抗氧化水平得到广泛关注。荷叶依靠荷叶槲皮素、生物碱类和黄酮类的活性成分,荷叶多酚也能够不同程度地清除羟基自由基、DDPH和ABST自由基。更有研究结果表明:槲皮素可通过HO-1/CO系统在体内和体外增强线粒体的生物发生[20]。同时,临床研究发现绞股蓝有降脂作用,绞股蓝总皂苷能不同程度地降低肥胖大鼠血脂及自由基水平。不同含量绞股蓝皂苷对降低高脂血症大鼠血脂水平是不同的,有研究显示绞股蓝皂苷对DPPH自由基的清除率在浓度为4mg/ml可达到92%,对羟基自由基的清除率在浓度为3mg/ml可达到82%,对超氧阴离子的清除率在浓度为3mg/ml可达到73 %,且与总皂苷含量呈负相关关系[21]。并且家兔实验[6]表明紫苏叶提取物有调节血脂作用,可明显降低家兔动脉粥样硬化血液中 TC 和 TG 水平。
Niess等学者[22]指出有氧运动能够促进内源性CO合成,在本实验中也得到了相应的体现,进而参与机体免疫反应,提高机体抵抗疾病的能力。范学辉等[23]学者的研究则显示单纯的有氧运动并没有完全消除高脂饮食的负面影响,他们指出药物和饮食是高脂血症治疗中不可或缺的两个方面;而在本实验的研究中三种复方中药制剂和运动联合干预达到了更好的效果,中药提取物中的药物效应在本实验中得到很好的凸显。
