血管新生及抗血管新生靶向治疗在神经纤维瘤中的研究进展
2020-01-08顾熠辉任捷艺李青峰王智超
顾熠辉,任捷艺,李青峰,王智超
上海交通大学医学院附属第九人民医院整复外科,上海 200011
Ⅰ型神经纤维瘤病是一种由NF1基因突变引起的常染色体显性遗传病,全球发病率约为1/3 000[1]。NF1基因是最常见的抑癌基因之一,其编码的神经纤维素是一种Ras-GTPase活化蛋白(RasGAP),具有负向调节Ras信号转导的作用。在Ⅰ-型神经纤维瘤病中,NF1基因突变导致神经纤维素失去其负性调节作用,从而引起Ras及下游信号通路过度激活,导致异常的细胞增殖和肿瘤生长[2-4]。
临床上,Ⅰ型神经纤维瘤病患者易患多种中枢和外周神经系统肿瘤,其中以神经纤维瘤最为常见。神经纤维瘤是外周神经系统的良性神经鞘膜瘤,主要分为皮肤型神经纤维瘤(cutaneous neurofibroma,cNF)和丛状神经纤维瘤(plexiform neurofibroma,pNF)。除了导致外形损坏、疼痛以及周围组织压迫等症状,8%~13% 丛状神经纤维瘤可恶变为高度侵袭性的恶性周围神经鞘膜瘤(malignant peripheral nerve sheath tumor,MPNST)[5]。MPNST患者易发生远处转移及局部复发,其5年总生存率低于50%[6]。
不论是MPNST还是良性的神经纤维瘤在外科根治性手术中常遇到难以控制的出血,极大增加了手术难度。自发性或轻微创伤后出血虽然罕见,却是危及患者生命的潜在问题[7]。此外,前期研究提示,血管生成可能有助于pNF增生以及向MPNST 转变[8]。总而言之,神经纤维瘤的丰富血供是滋养神经纤维瘤浸润性生长和影响手术根治性切除的关键因素之一。因此,本文针对神经纤维瘤中的血供特点以及抗血管新生靶向治疗在神经纤维瘤中的研究进展进行综述,为神经纤维瘤的临床治疗提供新思路。
1 神经纤维瘤的血供特点
神经纤维瘤作为一种良性肿瘤,其术中大量出血且止血困难的问题在临床治疗中一直备受关注。病理学分析结果提示,神经纤维瘤的出血问题与NF1相关的动脉发育不良和神经纤维瘤侵犯血管引起的血管脆性增加有关[8-10]。NF1相关动脉发育不良的具体表现为纤维肌性发育不良与内膜增厚。其发病被认为与血管内皮细胞和平滑肌细胞中神经纤维素的功能缺失有关[11]。此外,研究发现,神经纤维瘤中的血管密度与正常组织相似,提示血管新生并非神经纤维瘤发生自发性出血及术中大量出血的直接原因。然而,当pNF恶变为MPNST以后,血管密度和形态皆发生了变化。在MPNST中,血管密度较正常组织显著增加,并且呈现为不规则的海绵网格状,同时血管壁缺少成熟稳定的结构。pNF与MPNST血供特点的显著差异提示血管新生是pNF向MPNST 转化的重要病理变化之一[12]。
2 促血管新生因子在神经纤维瘤中的表达差异
在神经纤维瘤和MPNST中,血管内皮生成引子(VEGF)、bFGF和Midkine均存在高表达[13],同时促血管新生因子在不同类型的神经纤维瘤中的表达水平也存在差异。pNF和MPNST中VEGF的表达水平明显高于cNF。VEGF作为肿瘤血管生成的主要调节因子,能够促进循环中的内皮细胞迁移、增殖、在肿瘤组织中形成新生血管。尽管pNF中VEGF的表达水平升高,但血管密度较正常组织并未增加,这可能归因于VEGFR的低表达[14]。
3 神经纤维瘤血管新生机制
肿瘤血管密度的增减与肿瘤大小直接相关,提示抑制神经纤维瘤的血管新生可能是一种有效的治疗选择[15]。因此,了解促血管新生因子在神经纤维瘤中的来源,探究其作用靶点以及促进肿瘤血管新生的具体机制,是开发及应用抗血管新生靶向药物治疗神经纤维瘤的基础。
3.1 NF-/-Schwann细胞是神经纤维瘤中VEGF的主要来源 VEGF是促进肿瘤血管新生主要的调节因子,在神经纤维瘤中高表达。在缺乏肿瘤微环境作用的条件下,肿瘤Schwann细胞NF1基因的单倍剂量不足或NF1基因突变引起的神经纤维素的功能缺失,可以通过激活mTOR-HIF-1a-VEGF途径引起神经纤维瘤中VEGF上调,这是神经纤维瘤中VEGF的主要来源[16]。而肿瘤Schwann 细胞与肿瘤微环境的相互作用也是促进神经纤维瘤血管新生的机制之一。研究[17]提示,非Schwann细胞中VEGF的上调本身不足以诱导神经纤维瘤的血管新生和丰富血供的形成。
3.2 肿瘤微环境的作用是影响神经纤维瘤血管新生的关键因素 神经纤维瘤微环境中包含大量的非肿瘤细胞,包括肥大细胞、成纤维细胞、内皮细胞。这些细胞与肿瘤Schwann细胞之间复杂的相互作用也是促进神经纤维瘤中血管新生的重要机制之一。NF1-/-Schwann细胞分泌高浓度的干细胞因子(SCF),募集和激活NF1+/-肥大细胞[18]。激活的肥大细胞分泌多种促血管新生因子(如VEGF、PDGF、bFGF),这些促血管新生因子可以与Schwann细胞分泌的细胞因子共同刺激内皮细胞和平滑肌细胞向肿瘤部位趋化、增殖,最终促进新血管生成。除肥大细胞之外,肿瘤相关成纤维细胞可通过改变细胞外基质的生物学特性间接调控血管新生[19];而巨噬细胞可分泌多种生长因子、炎症因子和VEGFA,通过促进内皮细胞存活、活化和增殖调节肿瘤血管新生[20]。后两种在神经纤维瘤中高表达的细胞成分对于血管新生的作用还有待进一步研究。
3.3 神经纤维瘤中NF1+/-内皮细胞高度活化后增强血管新生 实验研究显示,NF1+/-小鼠在NF1-/-Schwann细胞分泌的生长因子作用下新生血管有所增加。其具体机制为:在神经纤维瘤杂合突变的微环境中,NF+/-内皮细胞因Ras-Erk途径的异常活化对bFGF和VEGF的反应性显著提高,具体表现为内皮细胞迁移和增殖增加。实验中局部给予Erk信号通路上游Mek的抑制剂PD98059能够完全抑制NF1+/-和WT小鼠对VEGF和bFGF的血管生成反应,提示内皮细胞是抗血管新生治疗的潜在靶点[21]。
总之,在神经纤维瘤中,肿瘤Schwann细胞与其激活的肥大细胞,以及微环境中其他细胞成分,分泌多种生长因子和趋化因子,通过重塑细胞外基质、改变内皮细胞功能等复杂的作用机制共同促进血管新生。其中,不论是NF1基因在Schwann细胞中的纯合性突变或是在其他细胞成分中的杂合性突变,皆通过不同下游信号通路的激活,促进肿瘤中的血管新生。除上述机制以外,目前关于神经纤维瘤血管新生的机制研究仍存在许多空白,未来有待更多研究来为抗血管新生药物在神经纤维瘤中的应用提供新思路。
4 抗血管新生靶向治疗
神经纤维瘤的丰富血供和术中出血一直是临床治疗中被重点关注的问题。除了传统手术治疗,在神经纤维瘤靶向药物的应用中,血管新生因其重要的促肿瘤作用也成为研究热点之一。抗血管新生治疗不仅能够减少肿瘤的血管密度,缩小肿瘤体积,同时也可改善异常的血管结构和功能缺陷,增加药物传递[22-24]。因此,抗血管新生靶向药物可单独用药,或作为增强剂与其他药物联合应用发挥抗肿瘤作用。已有一些抗血管新生药物在神经纤维瘤的临床前试验中充分显示出其有效性,目前正在进行临床试验,这些药物可能在不久的将来造福于神经纤维瘤患者[25-27]。
4.1 抗血管新生药物分类 肿瘤血管新生的机制复杂,抗血管新生药物的作用靶点和种类繁多,其中大多数以VEGF信号通路为靶点。此类药物可分为3类:(1)阻断VEGF配体与受体结合的配体结合剂,如与VEGF-A结合的bevacizumab,;(2)通过VEGF受体阻断信号传导的抗体,如与VEGFR2结合的ramucirumab;(3)阻断VEGFR1、VEGFR2和VEGFR3激酶活性的酪氨酸激酶抑制剂,如sorafenib。此外,一些以VEGF信号通路以外的分子为靶点的抗血管生成药物也已进入临床前和临床评估,包括靶向血小板衍生生长因子受体(PDGFR)和成纤维细胞生长因子受体(FGFR)等靶点的药物,以及内源性、合成的广谱抗血管生成药物,例如内皮抑素、血管抑素、thalidomide等[28-30]。
4.2 应用于神经纤维瘤的抗血管新生药物 随着基因工程小鼠(GEM)模型的发展和应用,关于神经纤维瘤的临床前研究大量开展,强大的小鼠模型不仅提供了发现药物新治疗靶点的实验平台,而且还能够在人体临床试验之前快速评估新药物[31]。虽然目前临床上没有可用于神经纤维瘤的抗血管新生药物,但是已有相关药物在临床前实验和临床试验中充分显示其临床应用价值。例如:沙利度胺的开放性Ⅰ期试验用于治疗pNF患者,试验中观察到在4例接受治疗的患者中,肿瘤减小25%[32];PEG-IFN-α-2b在Ⅱ期临床试验中用于治疗进展的pNF患者,与安慰剂组相比,其导致至疾病进展时间延长1倍以上[33]。
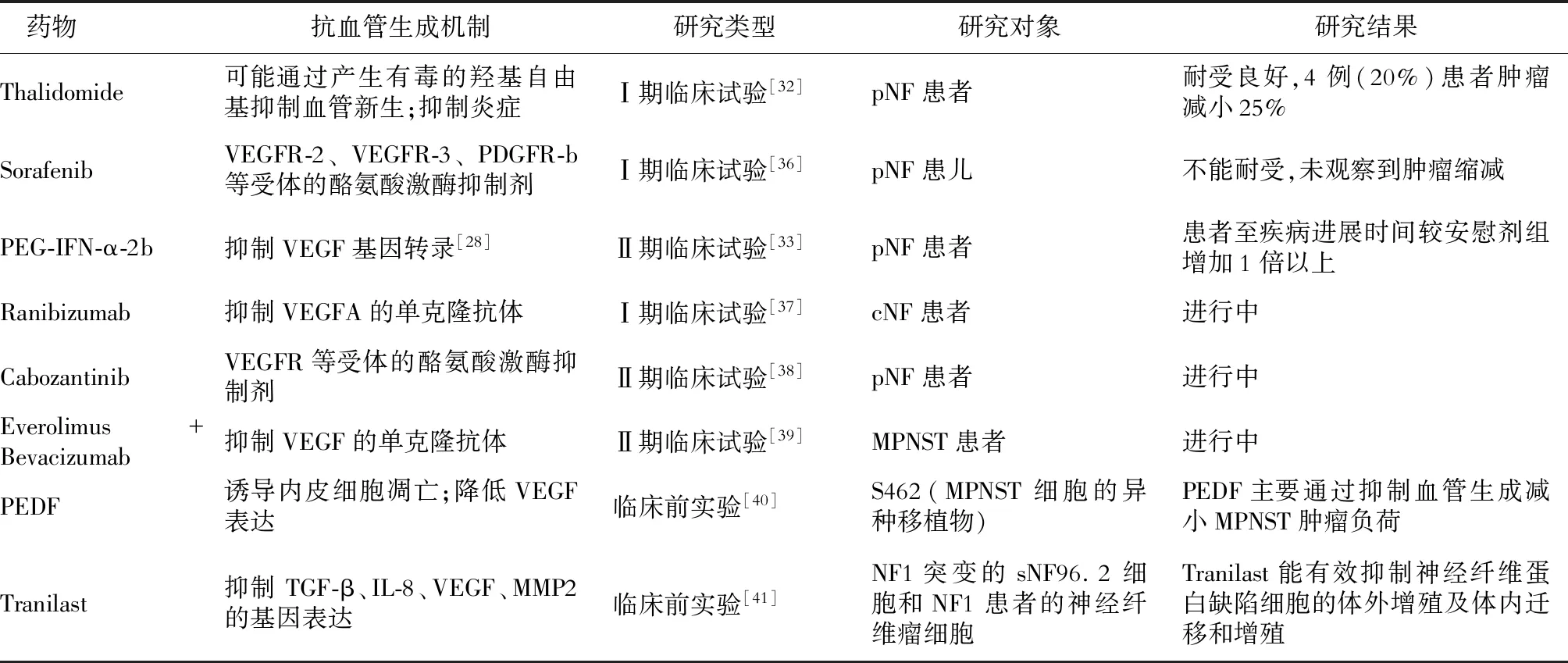
表1 抗血管生成药物在神经纤维瘤中的应用
4.3 应用抗血管新生药物治疗神经纤维瘤的问题和挑战 神经纤维瘤是一种具有血管异常改变和恶变潜力的良性肿瘤,应用抗血管生成靶向治疗具有其特殊性。因此,一些已被FDA批准作为抗癌药物,或者在其他疾病的临床试验中显示有效的血管生成抑制剂是否对治疗神经纤维瘤有效,仍需要进一步实验证明。考虑到Ⅰ型神经纤维瘤病患者需要长期治疗,甚至于生长发育期进行治疗,除了有效性之外,较低的局部和全身不良反应发生率以及良好的耐受性也尤为重要。在PEG-IFN-α-2b的Ⅱ期临床试验中,尽管药物的有效性得到了证实,但也有部分患者发生了需要改变剂量和终止治疗的不良反应,例如注意力缺陷、多动障碍等行为问题的加重疲劳等[33]。此外,耐药性也是肿瘤抗血管生成治疗需要重点考虑的问题,根据发生机制可以分为先天性耐药和获得性耐药[34]。而获得性耐药的发生机制为肿瘤重新找到了对治疗不敏感的代偿通路来驱动血管化,或使肿瘤适应了这种低血供的环境[35]。因此,找到相关的生物标志物来预测患者对药物的反应性,以及探索抗血管生成药物和抑制NF1下游信号通路的靶向药物的联合用药方案,以获得最佳疗效,是未来在研究抗血管新生药物靶向治疗神经纤维瘤中需要深入探讨的关键问题。
5 结 语
神经纤维瘤的丰富血供、促血管新生因子的高表达以及不断增大的生长趋势皆提示了血管新生对于神经纤维瘤的重要影响,而抗血管新生药物在神经纤维瘤的相关研究中也充分显示出潜在的临床应用价值。但是,目前神经纤维瘤中血管新生的具体机制仍未明确,未来还需要更深入的研究以发掘更多潜在的治疗靶点,指导临床用药。目前手术切除是神经纤维瘤的主要治疗方法,但是相信在不久的将来,抗血管新生靶向药物将可以为神经纤维瘤患者的非手术治疗带来希望。
