益气养阴疏肝合剂通过Fas/FasL途径治疗大鼠桥本氏甲状腺炎
2020-01-07李婵孙勤国
李婵, 孙勤国
[武汉大学同仁医院(武汉市第三医院)中医科,湖北武汉 430062]
桥本氏甲状腺炎(Hashimoto's thyroiditis,HT)是最常见的自身免疫性甲状腺疾病之一。其特征是存在高滴度的抗甲状腺球蛋白(Tg)和抗甲状腺过氧化物酶(TPO)的自身抗体,同时伴有甲状腺淋巴细胞的浸润,最终导致甲状腺功能减退和甲状腺组织纤维化。自1995年在全国范围实施食盐碘化以来,加之现代生活节奏的加快,甲状腺疾病的发病率有所提高[1-3],而且桥本氏甲状腺炎可发生于任何年龄段[4]。然而,桥本氏甲状腺炎的发病机制仍然没有完全阐明。目前,西医针对桥本氏甲状腺炎主要采用替代疗法和免疫疗法[5]。甲状腺激素替代疗法能弥补甲状腺激素缺失的问题,但不能从病因解决问题,且无免疫调节作用,不能降低较高水平的甲状腺自身抗体。在桥本氏甲状腺炎病程早期,糖皮质激素可以进行免疫调节,然而停药反弹率高,长期或大剂量使用副作用较大且患者的耐受性较差。因此,西医治疗桥本氏甲状腺炎的副作用大,复发率高,远期疗效欠佳[6]。而雷公藤多苷片能有效治疗桥本氏甲状腺炎[7],但其具有较强的毒性,其低毒高效制剂的开发仍在探索中。结合桥本氏甲状腺炎的临床证候特征我们总结了以黄芪90 g、白芍30 g、墨旱莲30 g、鬼箭羽30 g、郁金30 g、玄参30 g等中药组成的益气养阴疏肝合剂,有明显临床疗效。因此,本研究建立实验性自身免疫性甲状腺炎大鼠模型,并给予益气养阴疏肝合剂治疗,观察益气养阴疏肝合剂对实验性自身免疫性甲状腺炎大鼠血清炎性细胞因子水平的影响,探讨益气养阴疏肝合剂对桥本氏甲状腺炎的治疗机制,现将研究结果报道如下。
1 材料与方法
1.1 动物 健康SPF级SD雌性大鼠60只,4~6周龄,体质量(110±10)g,购自湖北省实验动物研究中心,许可证号:SCXK(鄂)2015-0018。饲养地点和实验单位为湖北中医药大学动物实验中心。饲养环境通风良好,温度保持在20~24℃,喂养方式采用自由摄食、饮水,定期清洗鼠笼。
1.2 药物 益气养阴疏肝合剂组成中黄芪、白芍、墨旱莲、鬼箭羽、郁金、玄参等中药材购自湖北中医药大学附属医院湖北省中医院中药药房。每mL生药含量2.73 g,低温冷藏备用。雷公藤多苷片,10 mg/片,100片/瓶,由贵州汉方药业有限公司生产,批号:国药准字Z52020369。
1.3 试剂与仪器 碘化钠(NaI)购自上海羽朵生物科技有限公司(中国);牛甲状腺球蛋白(bTg)、弗氏完全免疫佐剂和弗氏不完全免疫佐剂均购自上海羽朵生物科技有限公司(中国);甲状腺球蛋白抗体(TGAb)、甲状腺过氧化酶抗体(TPOAb)、肿瘤坏死因子α(TNF-α)、白细胞介素10(IL-10)酶联免疫吸附分析(ELISA)试剂盒和Fas、FasL免疫组化试剂盒均购自武汉基因美生物科技有限公司。352型酶标仪(芬兰Labsystems Multiskan MS公司)。
1.4 分组与造模 将60只SD雌性大鼠随机分为正常组(N=15只)、造模组(N=45只)。实验性自身免疫性甲状腺炎大鼠模型复制方法:造模组饮用高碘水浓度为0.64 g/L,连续2周。双足皮下多点注射由完全弗氏佐剂(CFA)充分乳化成油包水状的甲状腺球蛋白(TG)(TG∶CFA=1∶1),每只大鼠注射100μg,注射2次,2次注射时间间隔2 d,作为初次免疫。之后,于后背皮下多点注射由不完全弗氏佐剂(IFA)乳化的TG,每只注射100μg,每周1次,连续4周,作为加强免疫[8]。将成模后的大鼠随机分为模型组、中成药组和中药合剂组,每组各15只。
1.5 给药 给药方法和剂量按人和动物体表面积折算[9]的等效剂量比值表计算出大鼠等效剂量。中药合剂组给予益气养阴疏肝合剂煎液(剂量为21.4 g·kg-1·d-1)灌胃;中成药组给予雷公藤多苷片悬浊液(剂量为6.25 mg·kg-1·d-1)灌胃;模型组及正常组灌服等量蒸馏水。每天给药1次,连续6周。
1.6 苏木素—伊红(HE)染色法观察大鼠甲状腺病理变化 将大鼠甲状腺组织经过脱水,包埋于蜡块中,以6μm的厚度均匀切片。石蜡切片脱蜡至水,苏木素液染核7 min,流水冲洗2 h,以1%的盐酸酒精溶液分化3 s,用伊红染液染色5~10 min,体积分数95%酒精、无水酒精脱水,二甲苯透明,中性树胶封固。
1.7 ELISA法检测血清TGAb、TPOAb、TNF-α、IL-10、IL-6、IL-12含量 治疗后第42天腹腔注射麻醉大鼠,腹主动脉采全血,以3 000 r/min离心15~20 min取血清。具体步骤按照试剂盒说明书进行操作。在酶标包被板上待测样品孔中先加样品40μL,然后再加生物素标记的抗体10μL。将样品加于酶标板孔底部,混匀。每孔加入酶标试剂50μL,空白孔除外。用封板膜封板后置37℃温育30 min。将30倍浓缩洗涤液用蒸馏水30倍稀释后备用。揭掉封板膜,弃液体,涤液5次。每孔先加入显色剂A 50μL,再加入显色剂B 50μL,混匀,37℃避光显色10 min。加终止液50μL,终止反应。在酶标仪上以540 nm的波长检测吸光度(D)值,绘制标准曲线,根据样品的吸光度值和标准曲线得出各组大鼠血清TGAb、TPOAb、TNF-α、IL-10、IL-6、IL-12的含量。
1.8 免疫组化法检测甲状腺组织Fas/FasL表达 腹腔注射过量戊巴比妥钠(100 mg/kg)后,处死大鼠,取甲状腺组织,浸泡在甲醛溶液中,石蜡包埋。石蜡切片常规脱蜡和水化后,浸于0.01 mol/L枸橼酸溶液(pH为6.0),微波炉中火10 min进行抗原修复。滴加体积分数3%H2O237℃恒温箱孵育15 min,以消除内源性过氧化物酶的活性。PBS洗2次,体积分数10%正常山羊血清封闭,恒温孵育15 min,去血清,滴加一抗,4℃孵育过夜,加二抗37℃孵育30 min,滴加DAB显色液2~4 min,控制显色,冲洗,苏木素复染,1%盐酸酒精分化,显微镜下观察,控制染色程度。自来水温和冲洗20 min后,封片。高倍视野下观察Fas/FasL阳性细胞细胞核,胞浆呈棕黄色颗粒为阳性染色细胞。观察全片,无免疫染色阳性的标本记为0分;免疫染色阳性细胞较少,弥散分布的样本记1分;而免疫阳性细胞较多,分布密集记2分;免疫阳性细胞多于60%则记3分。
1.9 统计方法 采用SPSS 17.0统计软件进行数据分析,计量资料以均数±标准差(-x±s)表示。若符合正态分布及方差齐性,多组比较采用单因素方差分析,两两比较采用LSD-t检验法;若不符合正态分布及方差不齐,采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠甲状腺病理变化 图1结果显示:正常组大鼠甲状腺滤泡呈规则椭圆形或圆形,甲状腺上皮细胞排列均匀、整齐,无淋巴细胞浸润;模型组大鼠甲状腺滤泡消耗明显,呈现扁平形,大小不等,滤泡形状不规则,内有浆细胞浸润,甲状腺上皮细胞排列紊乱,见明显淋巴细胞浸润。中药合剂组、中成药组大鼠甲状腺病理表现较模型组有所缓解,可见上皮细胞排列较均匀、整齐,淋巴细胞浸润减少。
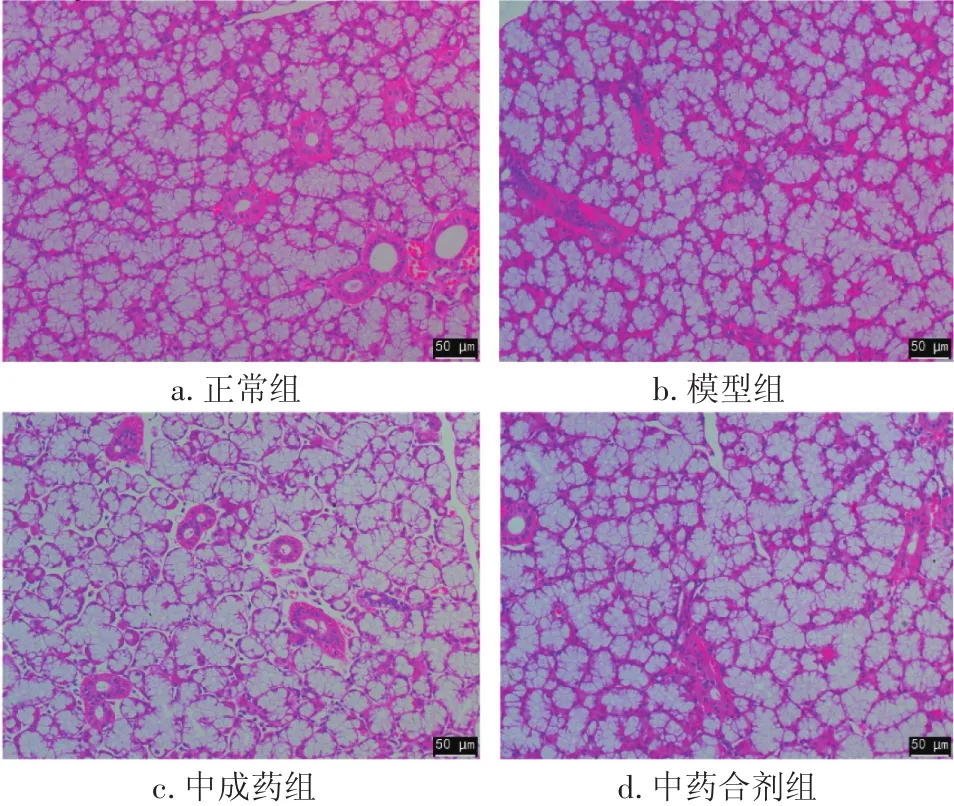
图1 各组大鼠甲状腺病理变化(HE染色,×200)Figure 1 Comparison of pathological features in rat thyroid of various groups(by HE staining,×200)
2.2 各组大鼠血清TGAb、TPOAb水平比较 表1结果显示:与正常组比较,模型组大鼠血清TGAb、TPOAb水平均显著升高(P<0.05);与模型组比较,中药合剂组和中成药组血清TGAb、TPOAb水平均显著降低(P<0.05),且中药合剂组与中成药组之间比较,差异无统计学意义(P>0.05)。
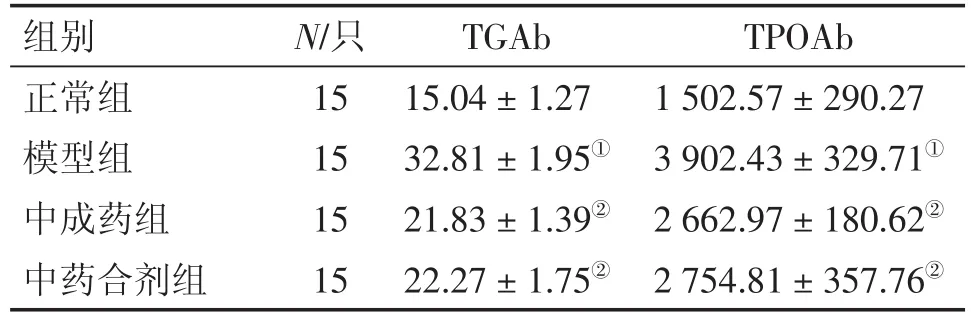
表1 各组大鼠血清TGAb、TPOAb水平比较Table 1 Comparison of the serum levels of TGAb and TPOAb in various groups[-x±s,ρ/(pg·mL-1)]
2.3 各组大鼠血清IL-6、IL-12、TNF-α、IL-10水平比较 表2结果显示:与正常组比较,模型组大鼠的IL-6、TNF-α水平均显著升高,IL-12、IL-10水平均显著降低(P<0.05);与模型组比较,中药合剂组和中成药组的IL-6、TNF-α水平均显著降低,IL-12、IL-10水平均显著升高(P<0.05),而中药合剂组与中成药组之间比较,差异无统计学意义(P>0.05)。
2.4 各组大鼠甲状腺组织Fas、FasL表达比较 图2、3及表3结果显示,模型组大鼠甲状腺组织Fas、FasL表达水平显著高于正常组(P<0.05)。与模型组比较,中药合剂组、中成药组Fas、FasL表达水平显著降低(P<0.05),且中药合剂组与中成药组之间比较,差异无统计学意义(P>0.05)。
3 讨论
TGAb、TPOAb不仅是甲状腺自身免疫反应的重要指标,同时也是桥本氏甲状腺炎临床诊断、治疗及预后的重要依据。TGAb和TPOAb可通过抗体依赖性细胞介导的细胞毒作用或与补体依赖的细胞毒作用损伤甲状腺细胞,最终破坏甲状腺细胞导致桥本氏甲状腺炎患者出现甲状腺功能减退[10]。Prummel等[11]发现TPOAb抗体水平与促甲状腺激素(TSH)水平和甲状腺组织中淋巴细胞浸润密切相关。在亚临床甲状腺功能减退的患者中存在升高的抗TPO滴度有助于预测其向明显的甲状腺功能减退进展[12]。因此,降低TGAb、TPOAb是桥本氏甲状腺炎的一个重要目标。本研究结果显示,模型组血清2种抗体TGAb、TPOAb均明显高于正常组,表明动物造模成功;而中药合剂组及中成药组血清TGAb、TPOAb等2种抗体均明显下降,表明益气养阴疏肝合剂和雷公藤多苷片对于桥本氏甲状腺炎均有良好的治疗效果。

表2 各组大鼠血清IL-6、IL-12、TNF-α和IL-10水平比较Table 2 Comparison of the serum levels of IL-6,IL-12,TNF-αand IL-10 in various groups[-x±s,ρ/(pg·mL-1)]
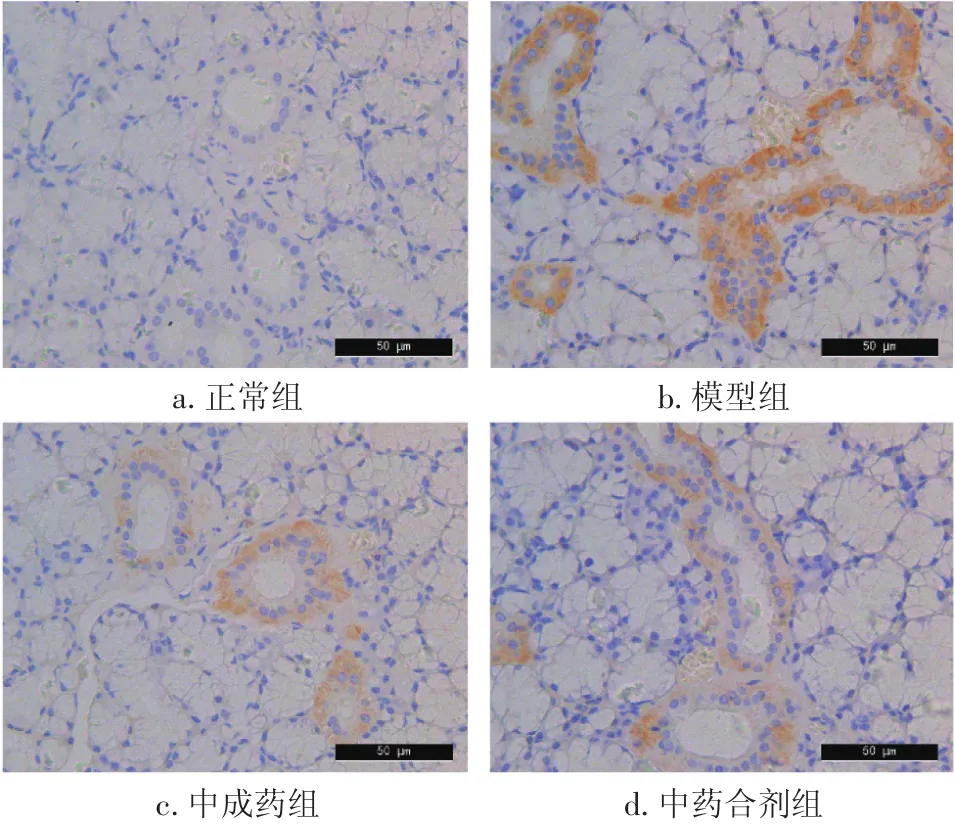
图2 各组大鼠甲状腺组织Fas表达比较(免疫组化法,×400)Figure 2 Comparison of Fas expression in rat thyroid of various groups(by immunohistochemistry,×400)
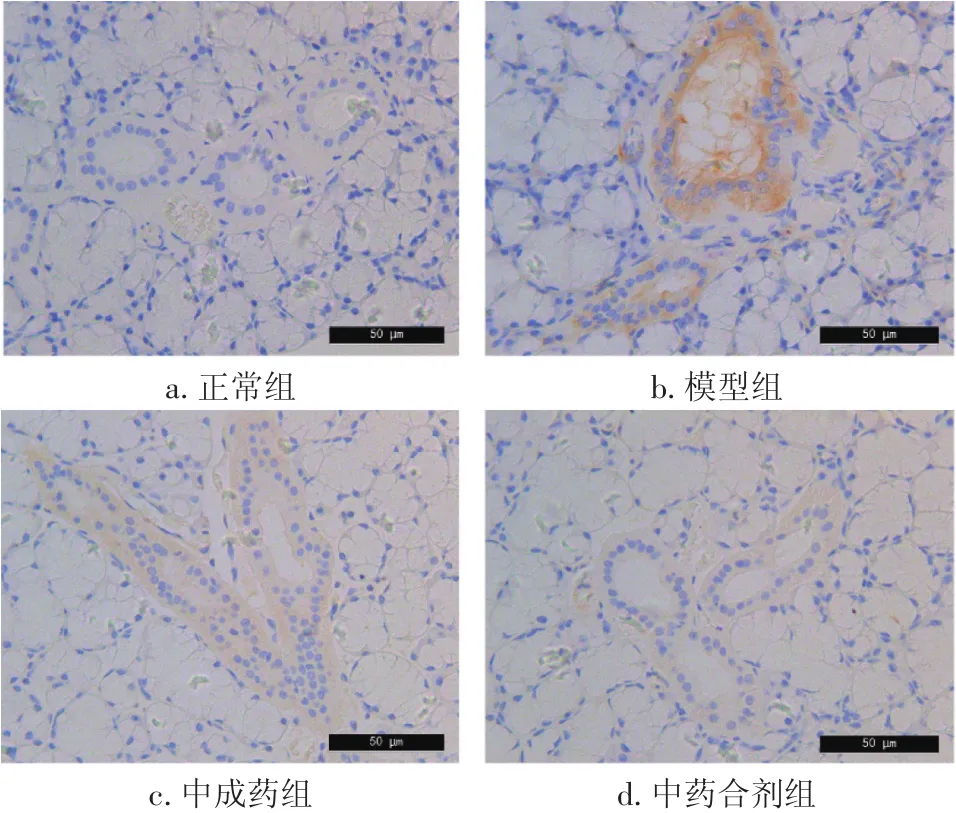
图3 各组大鼠甲状腺组织FasL表达比较(免疫组化法,×400)Figure 3 Comparison of FasL expression in rat thyroid of various groups(by immunohistochemistry,×400)
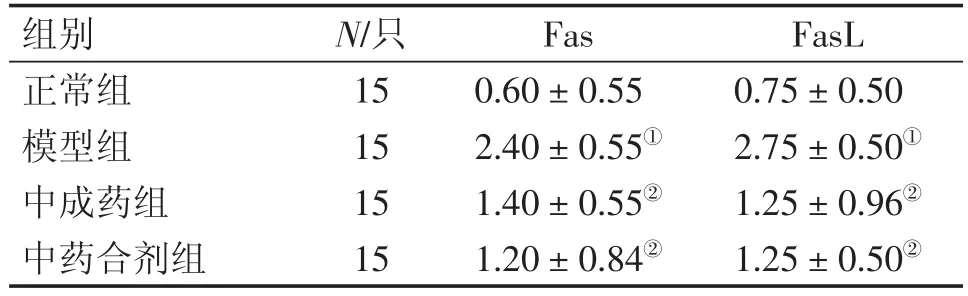
表3 各组大鼠甲状腺组织Fas、FasL表达比较Table 3 Comparison of the expression levels of Fas and FasL in rat thyroid of various groups (-x±s)
桥本氏甲状腺炎患者甲状腺细胞凋亡蛋白Fas表达增加,FasL是Fas在人体内的抗原配体,属于肿瘤坏死因子家族。当Fas与FasL结合,将信号传递到胞质区,致Fas的死亡域结构活化,Fas/FasL能引起的甲状腺破坏,是引起甲状腺功能减退的原因之一[13-14]。FasL是Fas在人体内的天然配体,Fas和FasL相互作用是诱导细胞凋亡的重要途径。本研究结果显示,中药合剂组甲状腺组织Fas/FasL的表达显著低于模型组,表明益气养阴疏肝合剂可显著降低Fas/FasL的表达。
TNF-α、IL-6和IL-12均为Th1型细胞因子,而IL-10为Th2型细胞因子。Th1因子产生高水平的干扰素γ(IFN-γ),而这种促炎症细胞因子促进巨噬细胞活化,进一步生产TNF-α、IL-1、IL-6和活性氧等炎性介质而导致甲状腺组织的破坏[15]。本研究结果还显示,造模成功后的模型组血清TNF-α和IL-6显著高于正常组,IL-10水平则显著低于正常组,提示桥本氏甲状腺炎特征是Th1细胞因子的水平升高,而Th2细胞因子的水平降低,亦证实了Th1介导细胞免疫应答在桥本氏甲状腺炎中占主导作用[16],由Th2细胞因子产生的IL-10水平的升高及Th1细胞因子产生的TNF-α水平的下降[17]。IL-10可以抑制活化T淋巴细胞,减少甲状腺内CD4+和CD8+淋巴细胞数量,抑制淋巴细胞甲状腺浸润,并防止甲状腺滤泡细胞的破坏[18]。在模型组中IL-12含量的下降可能是由于机体的炎症反应导致。细胞因子的变化显示了药物干预机理可能与Th1/Th2平衡学说有关[19]。Th1/Th2细胞亚群漂移状态与自身免疫性甲状腺炎关系密切,若恢复Th1/Th2平衡状态,可以达到治疗某些特定疾病的目的[20-22]。本研究中,在造模成功后,显示模型组大鼠血清TNF-α和IL-6水平升高同时伴IL-10水平下降,可见Th1/Th2发生了偏倚。而药物干预后,TNF-α和IL-6水平的下降及IL-10水平的升高又改变了偏倚的状态,使Th1/Th2之间恢复平衡,从而达到治疗桥本氏甲状腺炎的目的。
中医学认为,桥本氏甲状腺炎患者多因情志内伤,肝郁气滞,致使脏腑、气血功能失调,导致正气亏虚,气虚则血行无力,血行不利则血停为瘀而致颈前肿大[23-25]。而本研究方中重用黄芪补益元气,为方中君药。白芍养阴柔肝,墨旱莲补益肝肾,玄参养阴散结,三药配伍柔肝养阴散结,为方中之臣药。鬼箭羽破血消瘕,郁金疏肝解郁,与白芍、墨旱莲、玄参共治肝气肝结,为方中之佐使药。诸药合用,共奏益气养阴、疏肝解郁、消瘿散结之功。益气养阴疏肝合剂能显著降低实验性自身免疫性甲状腺炎大鼠血清TGAb、TPOAb的水平和甲状腺组织Fas/FasL的表达,并通过调节Th1/Th2的平衡,提高自身免疫水平,缓解桥本氏甲状腺炎的症状。
