松仁清蛋白抗氧化肽的分离纯化及结构鉴定
2020-01-07卢红妍刘诗梦闵伟红
卢红妍,杨 行,方 丽,刘诗梦,闵伟红,*
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.小麦和玉米深加工国家工程实验室,吉林 长春 130118)
氧化应激是指机体内产生过多活性氧簇自由基,超出机体清除能力,导致体内氧化系统与抗氧化系统失衡[1]。而体内氧化还原状态失衡与慢性代谢性疾病,如心脑血管疾病、糖尿病、类风湿性关节炎和癌症发生、发展等有关[2-4]。国内外研究发现生物活性肽可调节血脂、清理血栓、预防高血压和神经退行性疾病[5-7]等,同时研究证明,从芝麻粉、蛋清、比目鱼肌肉和大麻籽等[8-10]蛋白中提取的小分子质量活性肽均具有较强的抗氧化活性,并且富含疏水性氨基酸和巯基、羟基基团的肽具有较好的抗氧化活性[11-12]。
长白山松仁(Pinus konaiensis Sieb. et Zucc.)为松科植物红松的种子仁,蛋白质量分数达16.7%[13],富含人体所需的8 种必需氨基酸,是优质的植物蛋白来源。其中松仁清蛋白占总蛋白含量的38.71%,且清蛋白的暴露巯基和总巯基含量最高[14]。因此,松仁清蛋白可作为抗氧化肽制备来源。
本研究以松仁清蛋白为原料,采用碱性蛋白酶制备高抗氧化活性肽,通过现代色谱分离技术进行纯化,利用电喷雾串联质谱(electrospray tandem mass spectrometer,ESIMS/MS)仪进行结构鉴定,在此基础上,合成结构明确的松仁清蛋白活性肽,并对其进行活性验证。为松仁资源的开发利用及抗氧化肽的深度研究提供参考。
1 材料与方法
1.1 材料与试剂
长白山松仁清蛋白为实验室自制,通过碱溶酸沉法和Osborne法制备[15]。
碱性蛋白酶 丹麦诺维信公司;荧光素钠、2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、菲洛嗪、SephadexG-25、SephadexG-15美国Sigma公司;偶氮二异丁脒盐酸盐(2,2’-azobis[2-methylpropionamidine] dihydrochloride,AAPH) 美国SECOMA公司;其他均为国产分析纯。
1.2 仪器与设备
UV-1700型紫外-可见分光光度计 日本岛津公司;FD-1B-50型冷冻干燥机 北京博医康实验仪器有限公司;ZY-1000切方流超滤系统 上海紫裕生物科技有限公司;SPECTRA-MAX190型酶标仪 美国Molecular Devices公司;DBS全自动部分回集器 上海嘉鹏科技有限公司;HD-21-88紫外检测器 上海琪特分析仪器有限公司;2695高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Waters公司;Q Exactive四极杆-轨道阱高分辨质谱仪 美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 松仁清蛋白肽的制备
以松仁清蛋白为原料,选用碱性蛋白酶进行水解,最佳酶解工艺条件:酶解温度57 ℃,pH 9.5,加酶量8 600 U/g,质量分数2%,反应时间150 min。酶解产物冻干备用。
1.3.2 抗氧化活性测定
氧自由基吸回能力(oxygen radical absorbance capacity,ORAC)测定参照Ou等[16]的方法;ABTS阳离子自由基清除能力测定参照Kong Baohua等[17]的方法;DPPH自由基清除能力测定参照Xie Zhengjun等[18]的方法;羟自由基清除能力测定参照Amarowicz等[19]的方法;以上实验均以谷胱甘肽为阳性对照。铁离子螯合能力测定参照Lee等[20]的方法,以乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)为阳性对照。
1.3.3 肽酶解液的超滤
对松仁清蛋白酶解产物的超滤分离选用切方流超滤系统及Biomax改良聚醚砜复合膜包,膜包截流分子质量分别为10 kDa和3 kDa,控制恒流泵进口压力为1.5 bar,回流压力为0.4 bar,将获得的3 个组分冷冻干燥,测定其抗氧化活性。
1.3.4 SephadexG-25、SephadexG-15凝胶层析
基于超滤的抗氧化活性结果,选择最优组分进行SephadexG-25层析分离,样品质量浓度100 mg/mL,上样量15 mL,洗脱流速1.5 mL/min,检测波长280 nm,分别回集各峰组分,冻干后测定抗氧化活性。选取活性最好组分进一步经SephadexG-15纯化,样品质量浓度80 mg/mL,上样量1.5 mL,洗脱流速0.8 mL/min,280 nm波长下进行检测,分别回集各组分,冻干后测定各组分抗氧化活性。
1.3.5 反相高效液相色谱(reversed phase-high performance liquid chromatography,RP-HPLC)分离
将SephadexG-15分离获得的高抗氧化活性肽经Waters HPLC仪进一步纯化,选用Diamonsil C18(250 mm×4.6 mm,5 μm)色谱柱。流动相A:水(含0.1%三氟乙酸);B:乙腈(含0.1%三氟乙酸)。样品质量浓度40 mg/mL,上样量50 μL,检测波长220 nm。洗脱条件:0~30 min,95%~70% A;30~40 min,70% A;40~60 min,70%~95% A。每次洗脱结束平衡色谱柱15 min,按图谱回集各组分,多次上样,回集冻干。
1.3.6 质谱鉴定
采用HPLC-ESI-MS/MS进行结构鉴定,将样品复溶于水后经由配备在线纳喷离子源的LC-MS/MS分析。整套系统为串联EASY-nano-LC 1200的Q Exactive Plus质谱仪,共上样8 μL样品(捕集柱:Acclaim PepMap C18(100 μm×2 cm);分析柱:Acclaim PepMap C18(75 μm×15 cm))。以线性梯度分离:60 min内3%~28% B(含0.1%甲酸的ACN溶液)。柱流量控制在300 nL/min,柱温40 ℃,电喷雾电压2 kV。
Q Exactive Plus质谱仪在数据依赖采集模式下运行,自动在MS和MS/MS采集间切换。质谱参数设置如下:MS:扫描范围m/z 350~1 650;分辨率70 000;AGC目标3e6,最大喷射时间50 ms,包括电荷状态2~7,动态排除时间auto;HCD-MS/MS:分辨率35 000,隔离窗口1.6,AGC目标1e5,最大喷射时间110 ms,碰撞能量27。
1.3.7 抗氧化肽的合成
采用Fmoc固相合成法,由北京中科亚光生物科技有限公司合成。
1.4 数据统计分析
2 结果与分析
2.1 酶解液指标测定结果
最佳酶解工艺条件下酶解,酶解液肽质量浓度为0.634 mg/mL,水解度为28.98%。酶解产物质量浓度为4 mg/mL时,DPPH自由基清除率为73.12%,羟自由基清除率为70.05%,具有较高的抗氧化活性,可用于进一步分离纯化。
2.2 超滤组分抗氧化活性
松仁清蛋白酶解产物经超滤获得3 个组分,分别为<3 kDa、3~10 kDa和>10 kDa,对各组分进行抗氧化活性验证。ORAC法是一种总抗氧化能力测定方法,其产生的自由基与生命体系中自由基具有高度一致性[21],因此选取ORAC为主要验证指标,并以不同反应机制的ABTS阳离子自由基、DPPH自由基、羟自由基清除能力和铁离子鳌合能力4 个指标辅助筛选。
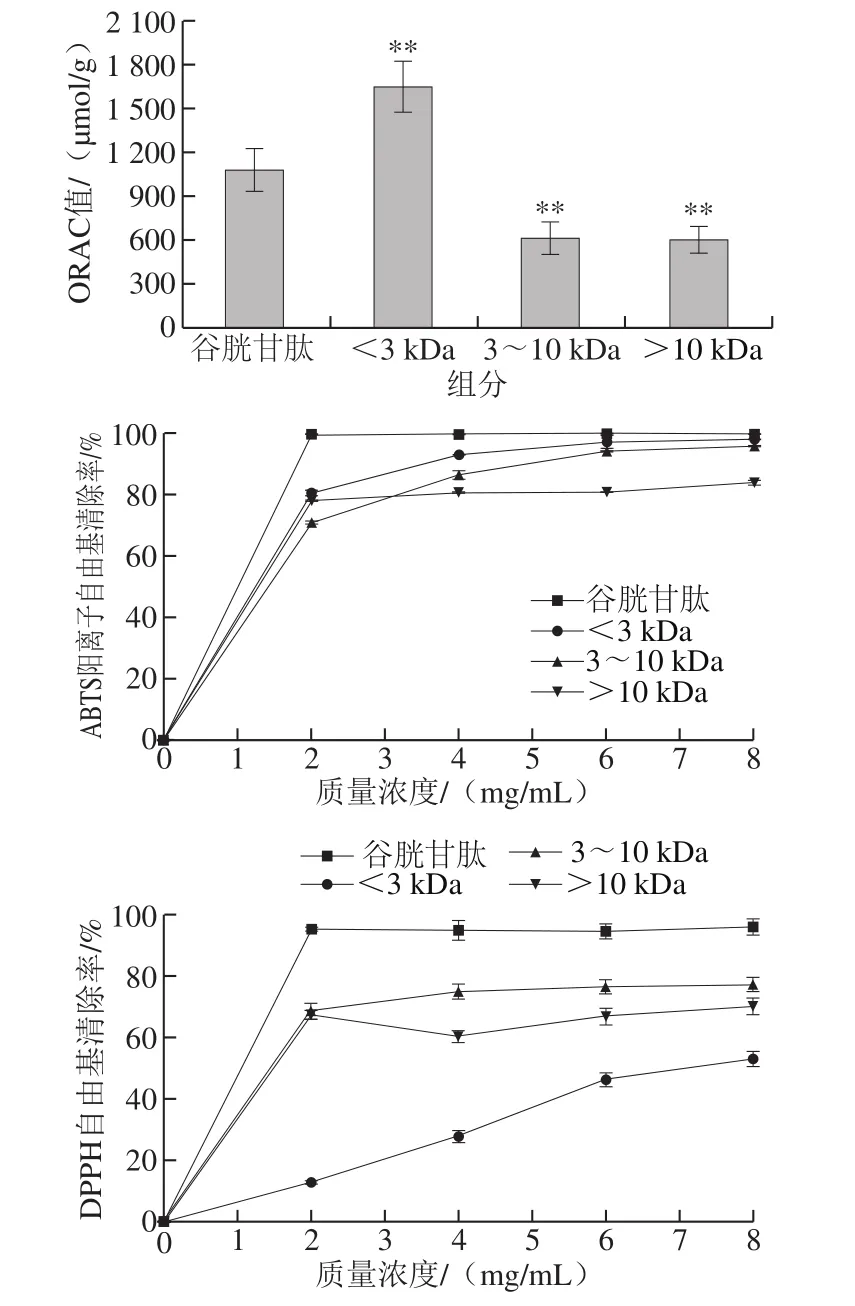
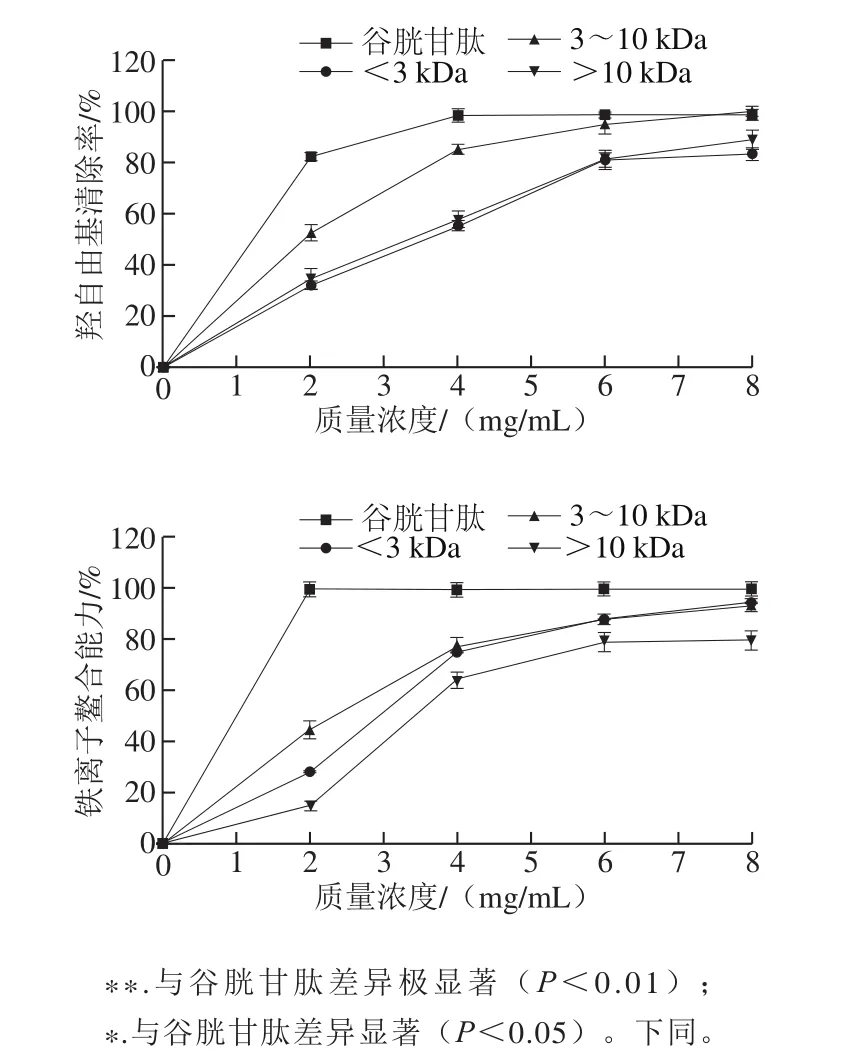
图1 超滤组分抗氧化活性Fig. 1 Antioxidant activities of the ultrafiltration fractions
如图1所示,在ORAC实验中,<3 kDa组分抗氧化活性优于谷胱甘肽,表现出极显著差异(P<0.01),而3~10 kDa和>10 kDa组分活性显著低于谷胱甘肽(P<0.01);在ABTS阳离子自由基清除实验中,<3 kDa组分的自由基清除能力低于谷胱甘肽,而优于其他2 个组分;DPPH自由基和羟自由基清除实验中,3~10 kDa组分的抗氧化活性最好,优于其他2 个组分;铁离子鳌合能力实验中,以EDTA为阳性对照,<3 kDa和3~10 kDa组分在8 mg/mL时,金属离子鳌合能力与EDTA相当。以上各实验中不同组分间抗氧化活性存在差异,这可能是因为碱性蛋白酶作用于不同酶解位点,酶解产物中暴露出不同氨基酸残基,活性肽的供氢或供电子能力存在差异,使各组分具有不同的抗氧化能力。综合考虑选择<3 kDa组分进一步纯化。
2.3 SephadexG-25、SephadexG-15分离纯化及抗氧化活性
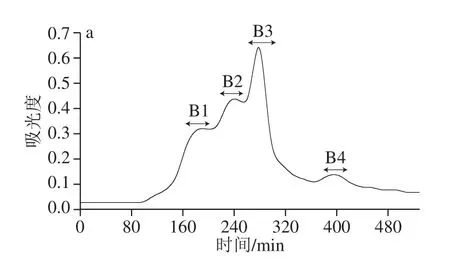
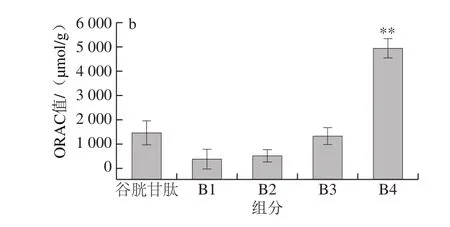
图2 SephadexG-25凝胶层析图谱(a)及ORAC(b)Fig. 2 SephadexG-25 chromatogram (a) and ORAC values (b) of eluates
如图2a所示,将<3 kDa组分进行SephadexG-25凝胶层析色谱分离,获得4 个组分,标记为B1、B2、B3、B4,回集各组分冻干,进行抗氧化活性验证。由图2b可知,ORAC实验中,各组分均表现出一定抗氧化能力,且分子质量越小ORAC越强,与谷胱甘肽相比B4组分表现出极显著性差异(P<0.01),B3组分与谷胱甘肽的ORAC相当,而B1与B2组分均低于谷胱甘肽。
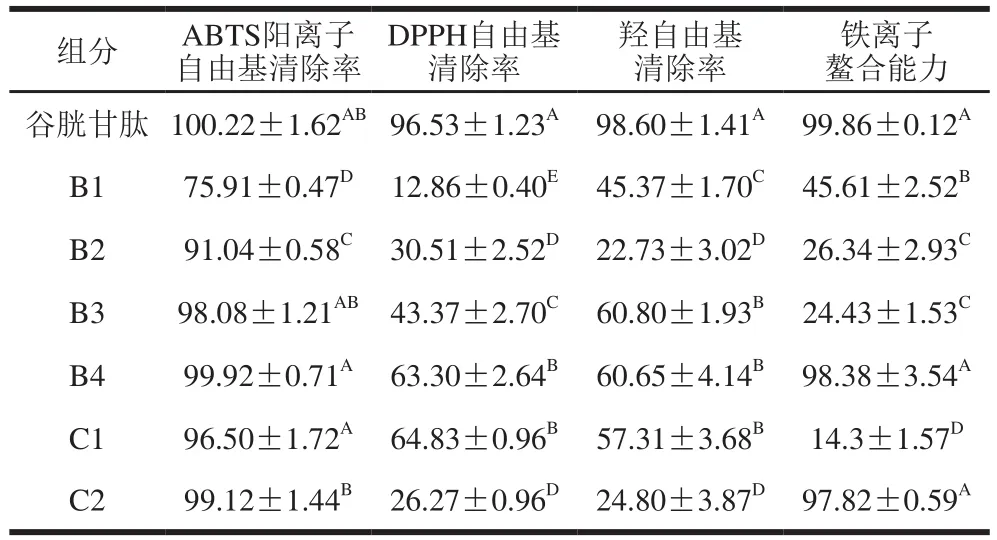
表1 SephadexG-25及SephadexG-15组分抗氧化活性Table 1 Antioxidant activities of on eluates from SephadexG-25 and SephadexG-15 columns%
在超滤纯化组分的测定中,各组分的抗氧化活性均表现出一定的剂量-效应关系,因此在后续实验中,选取质量浓度为4 mg/mL进行抗氧化活性测定。如表1所示,ABTS阳离子自由基清除实验中,B3和B4组分均有较高的自由基清除能力,与谷胱甘肽相比没有显著性差异(P>0.01);在DPPH自由基清除实验中,各组分间均存在显著性差异(P<0.01),清除能力依次为:B4>B3>B2>B1;B3组分羟自由基清除能力高于其他3 个组分;铁离子鳌合实验中,B4组分抗氧化活性最好,而B3组分活性较低。研究表明,肽的抗氧化活性与其分子质量之间存在相关性,其活性可能随着肽分子质量的降低而增加,而抗氧化肽的自由基清除作用可能与氨基酸的组成和序列有关[22]。因B4组分纯化获得数量极少,综合考虑,选择B3组分进一步纯化。
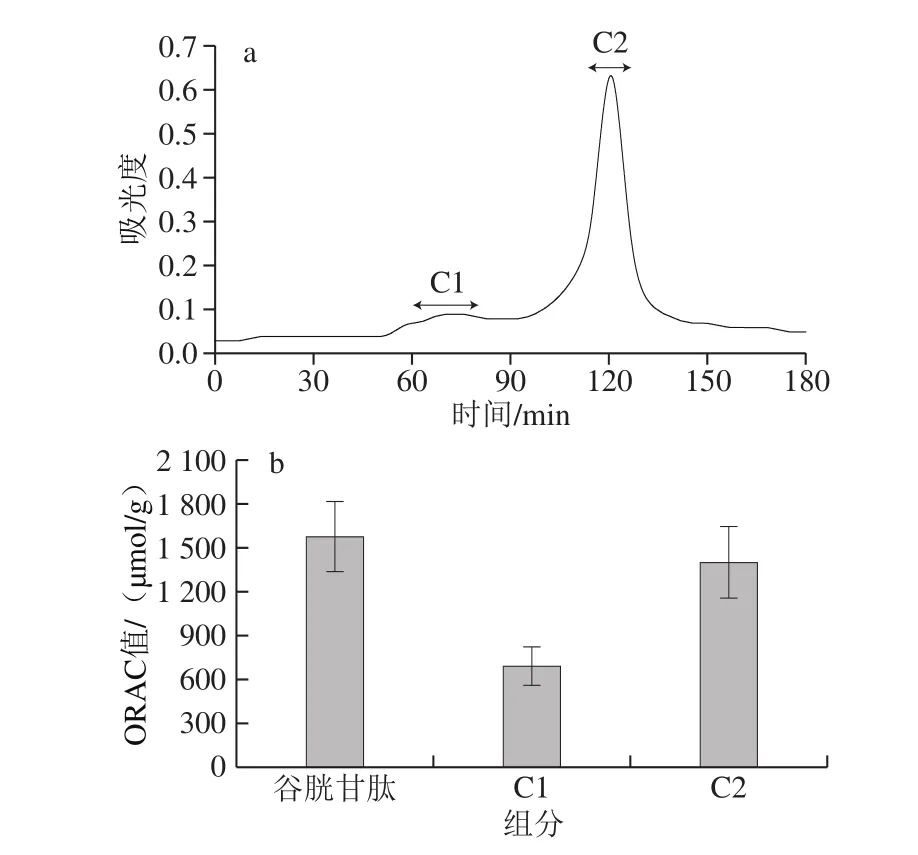
图3 SephadexG-15凝胶层析图谱(a)及ORAC(b)Fig. 3 SephadexG-15 chromatogram (a) and ORAC values (b) of eluates
如图3a所示,B3组分经SephadexG-15凝胶层析色谱分离,获得C1、C2两个组分,回集各组分冻干,进行抗氧化活性验证。由图3b可知,ORAC实验中,C1和C2组分与谷胱甘肽相比没有显著性差异,C2组分ORAC与谷胱甘肽相当,而C1组分活性较低。
如表1所示,在ABTS阳离子自由基清除实验中,C1组分清除率为96.50%,C2组分清除率为99.12%;DPPH自由基和羟自由基清除实验中,C1组分自由基清除能力高于C2组分;而在铁离子鳌合实验中,C2组分金属离子鳌合能力达到97.82%,与C1组分相比具有显著性差异(P<0.01)。有文献报道称,反应体系中pH值条件对抗氧化实验的有较大影响[23],因此推测针对不同实验,各组分的清除能力存在差异,可能是因为各组分中抗氧化肽具有不同酸性或非中性氨基酸残基。综合考虑,选择C2组分进行液相分离。
2.4 RP-HPLC分离
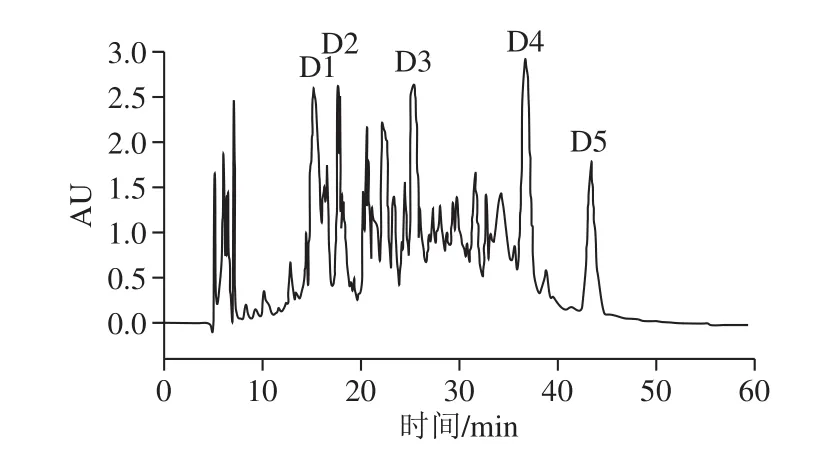
图4 C2组分RP-HPLC图Fig. 4 RP-HPLC analysis of fraction C2
如图4所示,0~10 min内出现的是溶剂峰,而样品峰主要集中在15~45 min内,样品峰中存在较多杂峰,说明经G15纯化后样品纯度较低,根据各峰的分离效果和响应值大小,回集5 个主要的洗脱峰D1、D2、D3、D4、D5,各洗脱峰的保留时间分别为15.2、17.7、15.5、36.9 min和43.7 min,洗脱峰与总峰面积比分别为7.85%、3.70%、5.98%、9.23%和4.62%。研究表明,经RP-HPLC分离,具有较弱极性和非极性物质在反相柱上保留时间长、出峰时间晚、疏水性高的特点[24]。D4、D5组分的洗脱峰峰形左右对称,纯化效果好含量高,且响应值较高,可能为主要的效应物质,因此选择回集D4和D5组分。
2.5 质谱鉴定结果
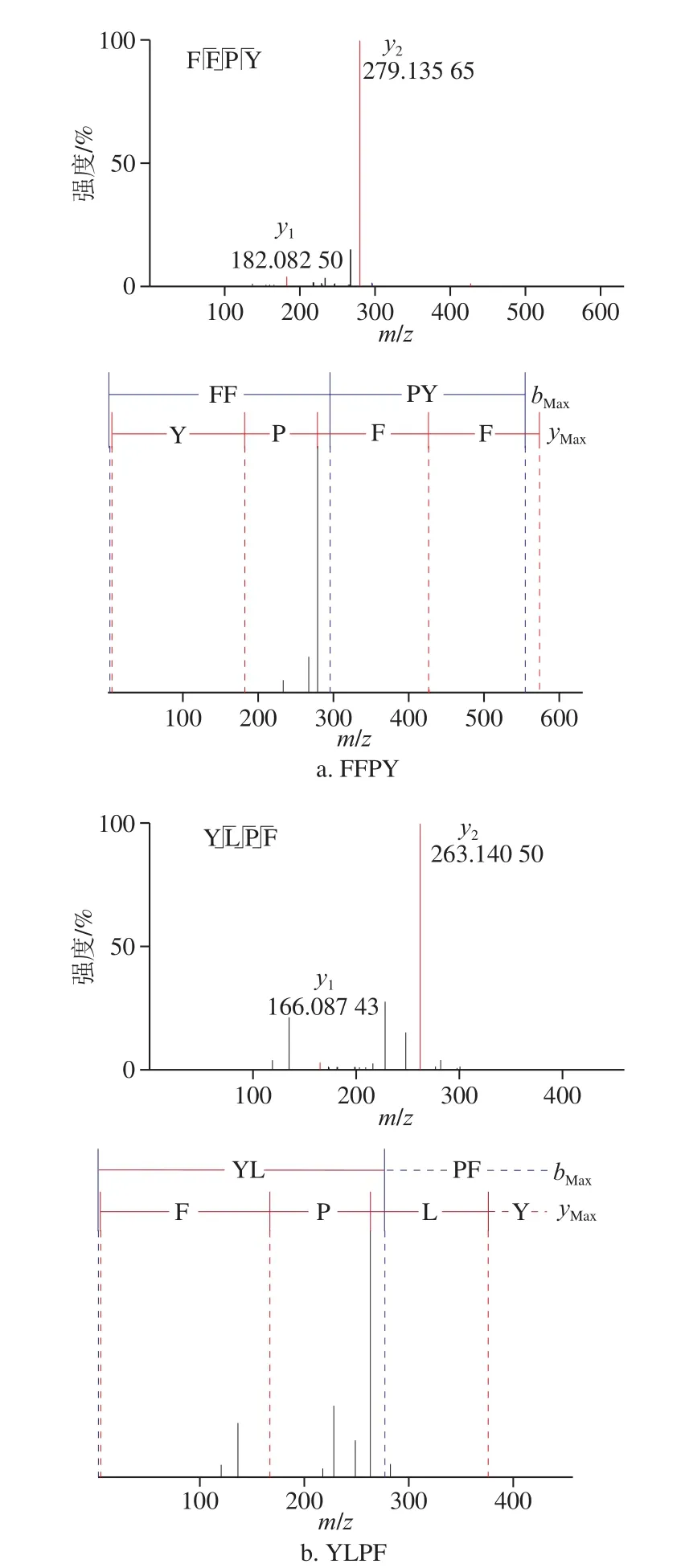
图5 FFPY和YLPF二级质谱图Fig. 5 Tandem mass spectra of FFPY and YLPF
将D4和D5组分进行ESI-MS/MS鉴定,通过从头测序和PEAKS Studio version 8.5分析,获得序列明确的高抗氧化活性肽。大量研究表明,与亲水性氨基酸相比,疏水性氨基酸在高抗氧化活性肽中占更高比例,并且被认为是影响肽自由基清除能力的关键因素[25]。另外有报道称,芳香族氨基酸(色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe))可以显著提高肽的抗氧化能力[26]。因此,综合数据库查阅结果和质谱可信度分析,从鉴定结果中选择氨基酸序列为苯丙氨酸-苯丙氨酸-脯氨酸-酪氨酸Phe-Phe-Pro-Tyr(FFPY)和酪氨酸-亮氨酸-脯氨酸-苯丙氨酸Tyr-Leu-Pro-Phe(YLPF)的活性肽进行抗氧化性分析,质谱图如图5所示。
2.6 抗氧化肽的合成及验证
抗氧化肽FFPY和YLPF进行化学合成,分子质量分别为572.67 Da和538.65 Da,纯度为99.16%和99.91%。对合成肽FFPY和YLPF进行抗氧化活性验证,ORAC值分别为7 329.63 μmol/g和2 835.47 μmol/g,此结果与先前报道一致,活性肽中疏水性氨基酸和芳香族氨基酸含量高,具有更好的抗氧化活性[27]。
3 讨论与结论
本研究利用ORAC、ABTS阳离子自由基、DPPH自由基、羟自由基清除能力和铁离子鳌合能力5 个实验对松仁清蛋白抗氧化肽进行分离纯化,其中ORAC法是基于氢原子转移的反应,目前氢原子转移反应被认为是自由基氧化反应的主要机制[28]。分析表明,在ORAC和ABTS实验中,各级组分的分子质量越小,抗氧化活性越好,这说明肽的抗氧化活性与其分子质量大小密切相关。基于单电子转移的DPPH自由基清除实验中,松仁清蛋白抗氧化肽可以提供氢供体,与DPPH自由基中心的氮相互作用,从而减少高氧化性自由基,终止自由基链式反应;张德举[29]研究表明,常见氨基酸中只检测到半胱氨酸具有DPPH自由基清除活性,因此纯化过程中,因各组分中半胱氨酸含量及所处位点不同,具有不同的DPPH自由基清除能力。Esteve等[30]研究表明,从橄榄油中提取的小分子质量生物活性肽比高分子质量活性肽具有更好抗氧化能力,这与此研究结果一致。这可能是因为抗氧化肽的氢基团作为氢供体与自由基发生反应,而只有这些肽在一定分子质量大小内,氢供体才能最大程度地暴露并与自由基反应[31]。
基于RP-HPLC分离结果,选择最优组分进行ESI-MS/MS分析,获得序列明确的抗氧化活性肽FFPY和YLPF,分子质量分别为572.67 Da和538.65 Da。这与所报道的典型抗氧化肽一般包含2~9 个氨基酸,分子质量范围大多在400~950 Da相一致[32]。Zou Tangbin等[33]研究发现,氨基酸组成对抗氧化活性影响较大,在42 种抗氧化肽中存在人体所含20 种氨基酸,其中甘氨酸、脯氨酸、亮氨酸占氨基酸总数的33.7%,丙氨酸、酪氨酸和缬氨酸占18.7%;另有研究表明,C-末端和N-末端的氨基酸残基是影响肽抗氧化活性的关键因素,且C-末端区域的氨基酸性质比N-末端区域的氨基酸性质更重要[34]。本研究中,抗氧化肽FFPY和YLPF中所含氨基酸均为疏水性氨基酸,且75%的氨基酸为组成抗氧化活性肽的主要氨基酸;同时,两个肽的C-末端和N-末端氨基酸均为芳香族氨基酸,C-末端为酪氨酸的合成肽FFPY比YLPF具有更高的ORAC。高抗氧化活性肽FFPY和YLPF来源于松仁清蛋白,这为松仁清蛋白的开发利用提供了参考和依据。
