新型非酒精性脂肪性肝炎小鼠模型的建立
2020-01-07苏晓鸥戚新明周向梅乔俊文
苏晓鸥,陈 静,戚新明,周向梅,乔俊文,任 进
(1.中国农业大学动物医学院,北京 海淀 100193;2.中国科学院上海药物研究所,上海 浦东 201203)
非酒精性脂肪性肝炎(NASH) 是以肝细胞脂肪变性、气球样变、肝小叶炎症,可伴有肝细胞或肝窦周围纤维化为病理特征的肝脏慢性炎性疾病,与肥胖、胰岛素抵抗、高脂血症等代谢紊乱关系密切,也是由单纯性脂肪肝发展至肝纤维化、肝硬化和肝癌的重要阶段[1]。随着人们生活水平的提高和生活方式的改变,我国NASH近些年发病率明显增加,但目前尚没有批准的NASH治疗方法。
在NASH研究和治疗领域,尽管已存在诸多动物模型,但还没有能完全复制人NASH疾病特征的动物模型。已有一些基于不同遗传背景或饮食控制的动物模型被开发出来,但多数模型没有展现出与人NASH相似的典型病变特征,如没有体重增加或肥胖、肝脏组织病理学特征不符、没有胰岛素抵抗或未见脂质代谢异常等。另外,其他动物种属从斑马鱼、果蝇到奥沙巴猪[2],有报道被用于NASH研究,但由于饲养和管理方面的困难,限制了它们在动物模型方面的广泛应用。因此,适用于实验室研究且与人类NASH高度相似的新型NASH动物模型的开发,对于NASH机制研究和治疗具有十分重要的意义。本试验将建立一种新型高脂高糖饮食诱导的肝脏特异性Dicer1基因敲除C57BL/6小鼠NASH模型。
1 试验材料
1.1 实验动物 本试验实验动物由Dicer1loxp小鼠与Alb-Cre启动子驱动的Cre重组酶转基因小鼠杂交获得肝脏特异性Dicer1基因敲除C57BL/6小鼠,由中国科学院上海药物研究所分子毒理实验室动物房自繁自养。种鼠由军事医学科学院王以政研究员惠赠。本试验所用动物为6-8周龄的肝脏特异性Dicer1基因敲除C57BL/6小鼠(下文简称KO小鼠),对照组为同周龄段的C57BL/6野生型小鼠(下文简称WT小鼠)。小鼠自由采食、饮水,照明/黑暗12 h循环。本试验符合实验动物管理规范。
1.2 主要试剂 总RNA提取试剂RNAiso,TaKaRa,宝生物工程(大连)有限公司;防RNA降解试剂RNAlater,QIAGEN公司;Primescript RT Reagent Kit(逆转录试剂盒),宝生物工程(大连)有限公司;SYBR Premix ExTaqTM(实时荧光定量PCR试剂盒),TaKaRa公司,宝生物工程(大连)有限公司;天狼星红染色试剂盒,北京索莱宝科技有限公司;苏木素,上海时代生物科技有限公司;油红O 染色液,国药集团化学试剂有限公司。
1.3 主要仪器设备 Bio-Rad CFX ConnectTMReal-Time PCR 检测系统(Bio-Rad 公司,美国);HITACHI 7080全自动生化分析仪(HITACHI,日本);脱水机(PC1501E0106,Thermo公司);生物组织包埋机(B64110021,Thermo公司);切片机(FN3240E1003,Thermo公司);自动染色机(RH2062E,Thermo公司);显微镜(Nikon Eclipse 80i)。
2 试验方法
2.1 动物分组和试验设计 雄性6-8周龄KO小鼠10只,随机分为2组;同龄雄性WT小鼠10只,随机分为2组;共4组,每组5只,记录实验动物试验初始体重,分别给予正常饮食(Normal Chow Diet)和高脂高糖饮食,12周。高脂成分为60 kcal%脂肪(每2 d更换1次),高糖为高果糖浆(High-Fructose Corn Syrup),成分为77.3%果糖(34 g/L)和22.7%葡萄糖(10 g/L),按重量计算为44 g/L(隔日更换)。KO小鼠给予正常饮食组,记为CK组;KO小鼠给予高脂高糖饮食组,记为HK组,即本试验建模组;WT小鼠给予正常饮食组,记为CW组;WT小鼠给予高脂高糖饮食组,记为HW组。
2.2 肝脏Dicer1基因表达水平检测 (1)试验12周后,各组小鼠安乐死,快速采集肝脏组织,液氮闪动,后转到-80 ℃保存,用于检测各组肝脏Dicer1基因表达水平;(2)提取肝脏总RNA,然后应用反转录试剂盒PrimeScript RT Master Mix将总RNA反转录成 cDNA,实时荧光定量PCR检测各组小鼠肝脏Dicer1基因mRNA表达量。肝脏Dicer1引物序列(由生工生物工程(上海)股份有限公司合成):上游: 5′-TCAGATCACTTCCCGTGGATT-3′;下游: 5′-CAGCCAACGAGGAGTTACAGC-3′。
2.3 口服糖耐量(OGTT) 检测 各组小鼠计划解剖前5-7 d内,隔夜禁食约16 h,自由饮水,后口服给予1.5 g/kg·bw葡萄糖溶液,取尾静脉血,记录 0、15、30、45、60、90 min和120 min时间点的血糖值,根据各时间点血糖浓度曲线下面积(AUC),计算每组AUC均值分析组间OGTT差异。
2.4 血清学检测 计划解剖当天,各组小鼠麻醉后采集血液于1.5 mL 离心管,4 ℃条件下离心取上清,利用生化分析仪检测几种血清指标,包括谷丙转氨酶(ALT)、谷草转氨酶(AST)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDLC)和高密度脂蛋白胆固醇(HDLC)。
2.5 组织病理学检查 计划剖检当天,记录各组动物临终体重。各组小鼠在麻醉、采血及安乐死后,收集各组小鼠肝脏、肾周脂肪、以及附睾周围脂肪进行称重。然后将肝脏左叶固定于10 %中性福尔马林缓冲液,之后进行常规组织脱水、包埋、切片,H.E.染色和天狼星红染色;另取一部分肝脏做冰冻切片,用于油红O 染色。对染色后的切片在显微镜下做组织病理学评分。主要参考NASH临床研究网(CRN)公布的相关标准,制定了如下评分标准:肝细胞脂肪变性评分为0(<5%)、1(5%~33%)、2(33%~66%)、3(>66%);肝细胞气球样变评分为0(无)、1(少数)或2(多数/明显);小叶炎症评分为0(无炎症)、1(炎性细胞主要分布在肝小叶III区)、2(炎性细胞主要分布在肝小叶III区,但II区和I区也可见炎性细胞)、3(炎性细胞弥漫至整个肝小叶);纤维化评分为0~4分别对应F0-F4期:F0期(无纤维化)、F1a期(轻度、III区、窦周肝纤维化)、F1b期(中度、III区、窦周肝纤维化)、F1c期(门静脉/门静脉周围纤维化)、F2期(窦周、门静脉/门静脉周围纤维化)、F3期(桥接纤维化)和F4期(肝硬化)。
2.6 统计分析 结果以平均值±标准差的方式表示。采用Graphpad Prism 7.0软件进行统计分析;多组比较(其他三组与HK组相比)使用One-way ANOVA分析。当P<0.05时,认为组间具有统计学差异。*代表P<0.05;**代表P<0.01;***代表P<0.001。
3 试验结果
3.1 各组肝脏Dicer1基因表达水平比较 肝脏Dicer1基因表达检测结果显示,HK组肝脏Dicer1 mRNA表达水平相比CW和HW组显著下降;CK组未检测到肝脏Dicer1 mRNA表达(图1)。
3.2 OGTT测试结果 OGTT是临床评价胰岛素抵抗(IR)常用的方法。OGTT结果显示,HK组平均OGTT AUC显著高于CW和CK组但低于HW组;提示HW和HK组经过高脂高糖诱导后糖耐量相比正常WT小鼠(CW组)降低,且HW比HK组糖耐量降低更显著(图2)。提示HK和HW组存在IR。
3.3 肝损伤一般指标变化 HK组肝脏重量比重(肝重相对体重比值)与CW和HW组相比显著升高(图3A)。血清生化检测结果显示,HK组与CW和HW组相比ALT水平显著升高;HK组AST水平相比CW、CK、HW组均升高(图3 B、C),表明HK组存在肝功能异常,提示肝损伤,与肝脏组织病理检查结果一致。
3.4 血脂指标变化 HK组相比CW和HW组,甘油三酯(TG)升高(图4A);HK组与相比其他三组,总胆固醇(TC)和低密度脂蛋白胆固醇(LDLC)升高(图4B、C);提示HK组血脂异常。此外,高密度脂蛋白胆固醇(HDLC)方面,各组间没有统计学差异(图4D)。
3.5 体重变化 在试验第1天,各组小鼠体重未见明显差异(图5A),在试验12周时,HK组体重高于其他三组,且具有统计学意义(图5B);HK组在试验的12周内体重增长也高于其他三组,且具有统计学差异(图5C)。
3.6 附睾和肾周白色脂肪重量变化 试验12周时,HK组肾周白色脂肪和附睾白色脂肪比重(肾周或附睾白色脂肪重量相对体重比值),与CK和CW组相比,均显著升高,与HW组相比未见明显差别(图6A,B)。
3.7 组织病理学结果 肝脏经常规病理制片和H.E.染色后,CW组未见明显异常(中插彩版图7A);HW组仅见部分肝细胞空泡变(中插彩版图7C,E);CK组和HK组显微镜下可见肝细胞胞浆有大小不一空泡,以及肝小叶炎症,HK组程度更为严重(中插彩版图7B,7D,7F);HK组肝脏还可见肝细胞气球样变(Hepatocellular ballooning),个别肝细胞胞浆还可见Mallory-Denk小体 (MDB)、以及单个肝细胞凋亡。此外,CK和HK组肝脏还可见纤维化。油红O染色证实肝细胞胞浆内的空泡为脂肪空泡(中插彩版图7G)。天狼星红染色进一步证实CK和HK组存在不同程度的纤维化,呈红染的鸡丝样结构,主要分布在肝细胞或肝窦周围(中插彩版图7H),HK组较CK组纤维化程度重。各组肝脏组织病理学半定量评分结果见图8,HK组肝脏的各项病变评分均明显高于其他三组。
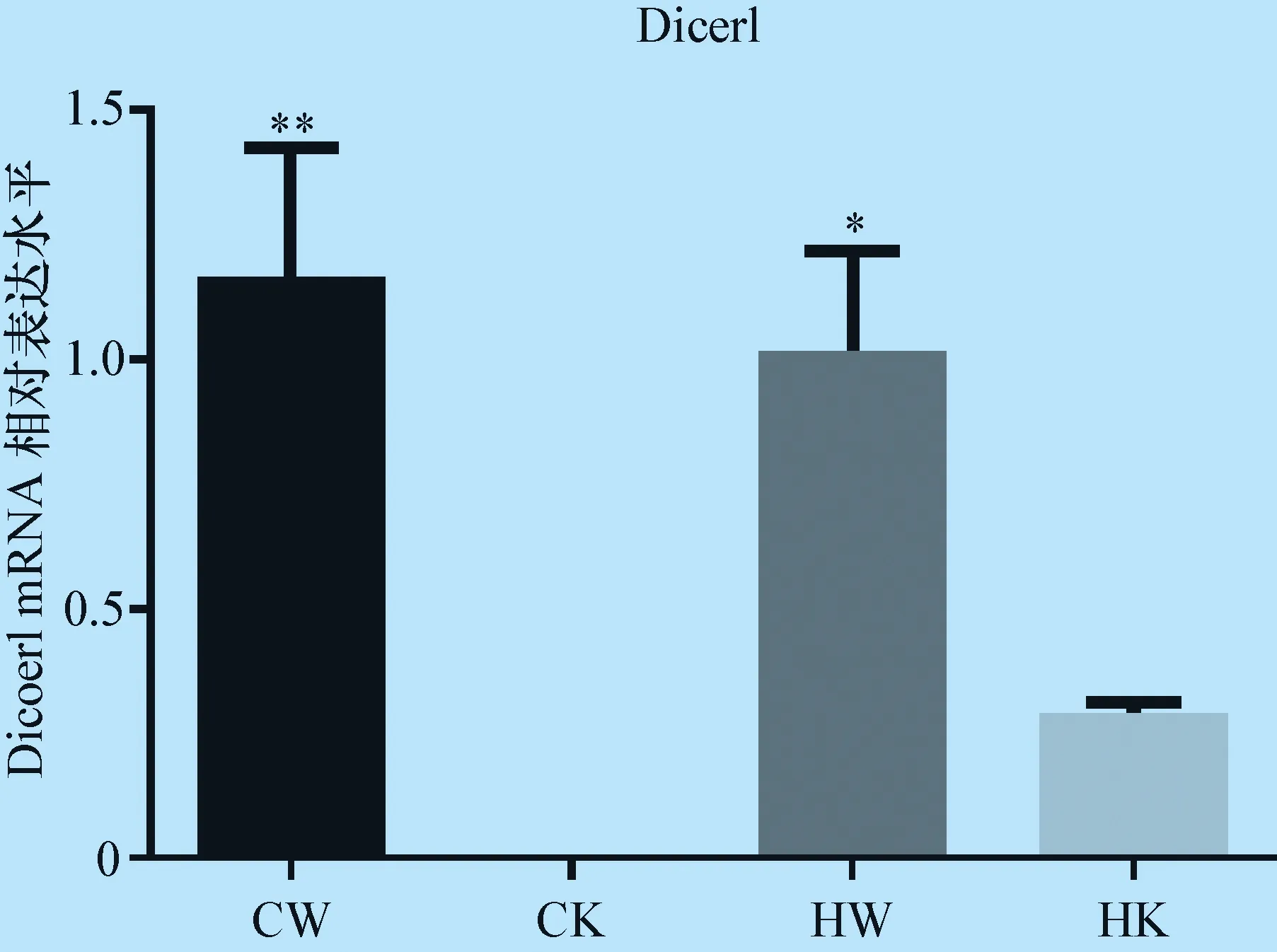
图1 各组小鼠肝脏Dicer1基因表达水平
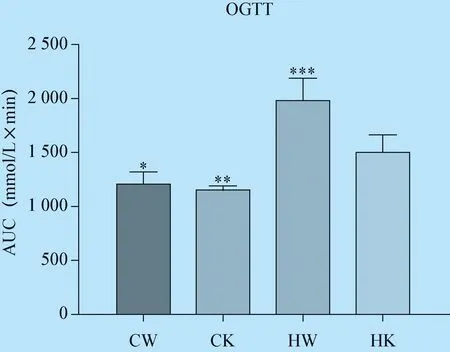
图2 各组小鼠口服葡萄糖耐受试验结果

图3 各组小鼠肝脏比重、血清ALT 、AST水平变化

图4 各组小鼠血清TG、TC、HDLC、LDLC水平变化
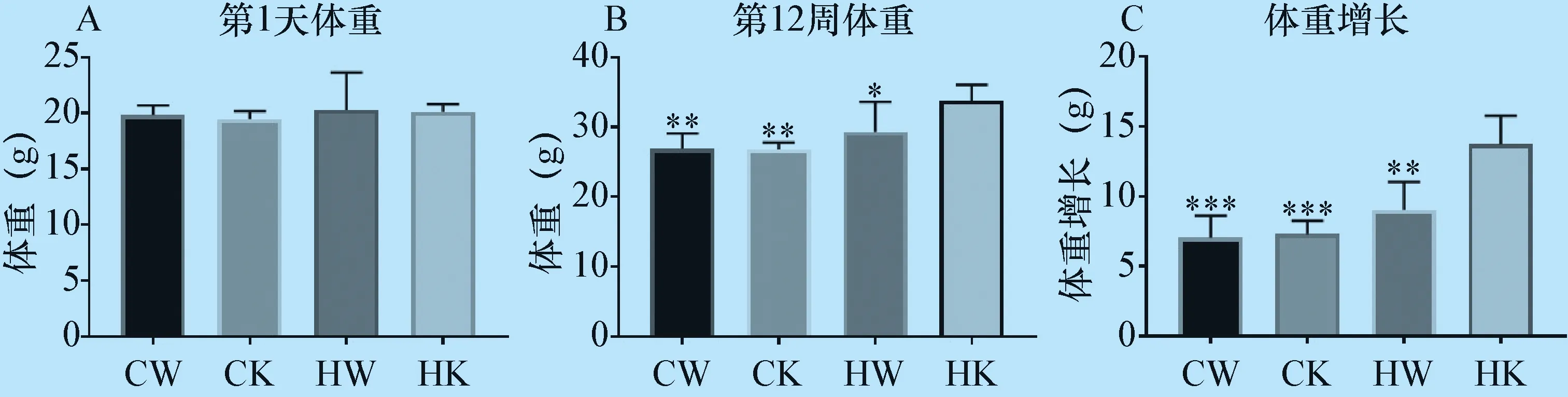
图5 各组小鼠第1天体重变化、第12周体重变化及12周内体重增长变化
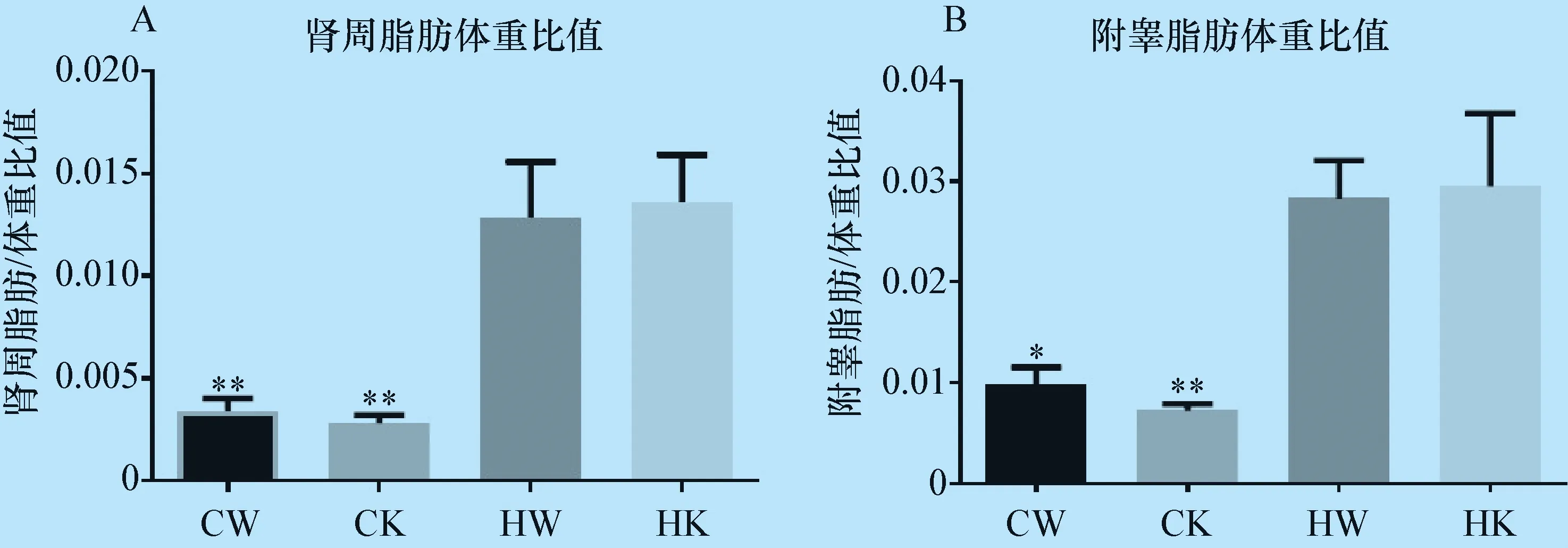
图6 各组小鼠肾周白色脂肪比重和附睾白色脂肪比重
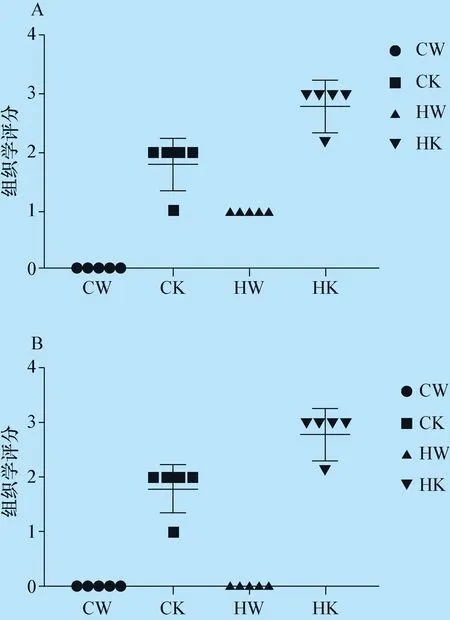

图8 各组小鼠肝脏组织病理学评分
A:各组肝细胞脂肪变性评分;B:各组肝脏小叶炎症评分;C:各组肝脏肝细胞气球样变评分;D:各组肝脏纤维化评分
4 讨论与结论
Dicer在生物体的发育形成、增殖、分化、衰老和凋亡等过程中发挥重要的作用,已有越来越多的Dicer基因敲除动物模型被运用到不同的疾病研究中。在中国科学院上海药物研究所分子毒理组团队的前期研究中发现小鼠肝脏特异性敲除Dicer1基因后会可自发地引起肝脏脂质蓄积,包括胆固醇、甘油三酯等[3]。
本研究通过用Dicer1loxp小鼠与Alb-Cre启动子驱动的Cre重组酶转基因小鼠杂交获得肝脏特异性Dicer1基因敲除小鼠,然后用高脂高糖诱导肝脏特异性Dicer1基因敲除小鼠建立NASH动物模型,并通过与正常饮食和高脂高糖饮食的WT小鼠(CW和HW组小鼠)以及正常饮食的KO小鼠(CK组小鼠)进行对比,揭示本试验模型(HK组小鼠)相比野生型小鼠以及正常饮食的KO小鼠在造模方面的特异性优势。试验结果表明,经HK组小鼠出现体重上升、附睾和肾周白色脂肪比重增高(提示肥胖)、糖耐量降低(提示胰岛素抵抗)、肝功和血脂异常,与人类NSAH相关特征相似。而CK组、HW组小鼠不能完全复制人类NASH的基本特征,或未见血脂异常或没有明显的体征变化(体重升高、肥胖)或糖耐量正常等等。在组织病理表型方面,HK组小鼠,其组织病理特征在肝脂肪变性、肝细胞气球样变、肝小叶炎症、肝纤维化、个别肝细胞胞浆内存在Mallory-Denk小体等方面与人NASH组织病理表型相似。而CK组小鼠在NASH相关病理特征方面不及高脂高糖诱导的KO小鼠明显,也未见肝细胞的气球样变和Mallory-Denk小体。HW组小鼠仅表现出肝细胞脂肪变性。CW组小鼠在生理、生化、组织病理方面均正常。
上述结果表明,该模型在体重上升、白色脂肪比重增高(肥胖)、肝功异常、血脂异常、糖耐量降低、肝脏组织病理学特征等方面与人类NSAH相似[4-5],且该模型的另一优势是诱导周期较短,仅12周就出现较为明显的非酒精性脂肪性肝炎症状,较文献报道的大多数NASH动物模型造模时间短。此外,该模型造模所用的高脂高糖饮食成分与引起人类NASH常见的饮食结构相似,其中不含有促进肝脏脂质蓄积、纤维化的化学物质。这一模型的建立将有助于NASH疾病机制以及治疗方面的研究,可进一步探索该模型在其他方面与人类NASH的相似性。
