不同生境对棕鞭藻自絮凝的影响
2020-01-07刘少卓张安龙崔梦瑶亓雪菲
张 波,刘少卓,张安龙,崔梦瑶,亓雪菲
(陕西科技大学 环境科学与工程学院,陕西 西安 710021)
0 引言
微藻因其光合效率与油脂含量高、生长周期短、占用耕地少等特点被认为是极有潜力替代化石能源的绿色、环保、可再生能源[1],但其高昂的培养与采收成本使微藻生物能源未能广泛普及[2].微藻培养过程需要消耗大量的水资源和N、P等无机营养[3],进而导致微藻培养成本可达微藻生物柴油制备总成本的40%以上[4].废水体系中含有丰富的N、P、有机物等营养物质供微藻生长[5].利用废水培养微藻可在降低微藻培养成本的同时实现废水的净化与资源化利用[6],进而实现废水由处理工艺向生产工艺的转变.
与此同时,微藻细胞形态微小(2~30μm),细胞表面带有负电荷[7],微藻细胞在培养液中形成稳定的分散体系,从而导致微藻细胞采收难度极大[8].目前大量的研究围绕微藻的采收方法、工艺及相关机理展开,建立高效率、低成本的微藻采收体系是微藻生物能源产业化应用的关键所在,具有重要的经济与实践意义[9].
微藻细胞常用的采收方法有离心法、过滤法、气浮法、直接重力沉降法和絮凝法等[10].离心法由于其极高的能耗和运行成本,目前并不具备大规模工程应用的潜力[11];使用过滤法收获微藻同样具有较高的运行成本,且收获效率较低[12];气浮法仅适用于采收部分单细胞藻类,在废水混合培养的条件下不能普遍适用;直接重力沉降法是成本最为低廉的采收方法,但其耗时长,分离效果和可靠性较差[13].
絮凝法是目前处理大量稀藻液时最为经济、可行的方法,微藻悬液经絮凝后能实现高效重力沉淀分离.絮凝法分为化学絮凝、生物絮凝、物理絮凝以及自絮凝[14].由Al3+、Fe3+为代表的化学絮凝虽然效率高,但化学试剂会吸附在藻细胞上,对下游处理工艺不利[15];生物絮凝有着较为理想的絮凝效率,但过程繁琐、成本较高,同时可能产生生物污染问题[16];物理絮凝操作相对复杂、成本高昂[17];因此,寻找一种绿色高效的絮凝收获方法对于微藻生物能源的发展十分必要.藻类细胞表面带有负电荷,在特定的pH范围下其表面电荷会减少进而发生聚集并沉淀,从而达到自絮凝采收目的[18].自絮凝可在不添加任何絮凝剂的情况下完成藻细胞的高效采收且安全性高,因此被广泛应用于微藻的采收,被认为是最具应用前景的微藻采收策略之一[19].
现阶段有关微藻细胞采收的研究主要集中于不同类型的收获方法对微藻絮凝效率的影响,而针对不同营养环境对微藻絮凝的影响研究较为缺乏,尤其在具有复杂理化环境与微生态环境的废水体系中关于微藻絮凝的研究几乎未见报道.因此,本文以棕鞭藻为对象,针对其在BG11培养基、glu BG11培养基(添加10 g/L葡萄糖BG11培养基)及生活废水三种营养环境中的自絮凝效率进行比较,从而进一步分析微藻细胞在不同营养环境中的自絮凝差异,揭示不同营养环境尤其是复杂废水环境对微藻自絮凝的影响.本研究将为系统揭示有机物及废水环境对微藻采收的影响机制提供重要依据,为进一步在废水环境中建立经济、高效的微藻采收体系提供重要指导.
1 实验部分
1.1 主要试剂和仪器
1.1.1 主要试剂
硝酸,分析纯,天津市天力化学试剂有限公司;氢氧化钠,分析纯,天津市天力化学试剂有限公司;葡萄糖,分析纯,天津市科密欧化学试剂有限公司;氯化镁,分析纯,天津科密欧化学试剂有限公司.
1.1.2 主要仪器
QGZ-500A智能光照培养箱,杭州琦胜科技有限公司;OPTIMA XPN-10型低温超速离心机,美国贝克曼库尔特公司;Cary 5000型紫外-可见-近红外分光光度计,美国安捷伦公司;PHS-25台式数显pH计,上海圣科仪器设备有限公司.
1.2 微藻藻株
所用藻株分离自陕西科技大学校园湖,经16s rDNA序列分析比对,鉴定其为棕鞭藻属Ochromonassp.(genebank查找号 MN028256).
1.3 生活废水
废水收集于陕西科技大学校污水处理厂进水口(废水水质如表1所示),使用3层纱布过滤除去其中大型浮游生物及悬浮颗粒,用自来水将废水稀释两倍后用于微藻培养.
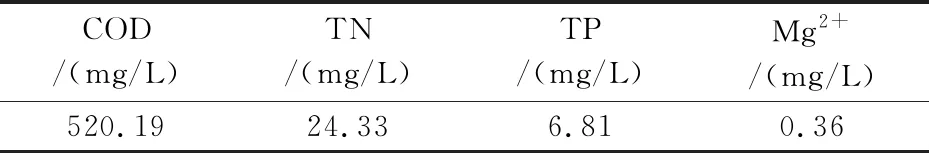
表1 生活废水主要水质指标
1.4 不同营养环境中微藻的培养
将处于生长稳定期的棕鞭藻按接种干重约为0.013 g/L分别接种于装有100 mL BG11培养基[20]、glu BG11(添加10 g/L葡萄糖的BG11培养基)及经预处理的生活废水的250 mL三角瓶中摇床震荡培养.摇床转速为150 r/min,光暗时间比为14∶10,温度与光照强度分别设定为28 ℃和3 500 lux.
1.5 不同微藻悬液体系中藻细胞自絮凝效率测定
使用1 mol /L HNO3或NaOH溶液分别将藻液pH调至1.0~12.0并充分震荡,取10 mL微藻培养液置于20 mL试管中,样品沉降10 min后在液面下2 cm处取样,使用紫外分光光度计测定样品在540 nm 处的吸光度并计算其絮凝效率,可按公式(1)进行计算.

(1)
1.6 Mg2+对生活废水中微藻自絮凝的影响
取废水环境中的微藻培养液置于20 mL试管中,使用1 mol/L NaOH溶液分别将藻液pH调整为11.0、12.0后加入MgCl2溶液,使得溶液中Mg2+含量分别为10 mg/L、15 mg/L、20 mg/L、25 mg/L,测定各培养液中微藻细胞自絮凝效率.
1.7 不同营养环境对微藻AOM产量的影响
取适量微藻样品置于50 mL离心管将其pH分别调整为2.0、8.0、11.0后用Whatman No.1滤膜进行过滤,保留清液,1 000 r/min离心10 min;取上清液,加入等体积的丙酮,在4 ℃条件下保存48 h后 10 000 r/min 离心10 min,保留沉淀,冻干24 h即得 AOM并称量其干重[21].
2 结果与讨论
2.1 棕鞭藻在不同营养环境中的生长速率比较
图1描述了棕鞭藻(Ochromonassp.)在三种营养环境中的生长状况.由图1可知,棕鞭藻在glu BG11培养基中生长速率最快,在接种第5天进入对数生长期,其生物量产率为0.252 g/Ld,培养末期生物量干重可达1.5 g/L以上.葡萄糖对微藻生长有显著的促进作用,其生长速率约为BG11中的10倍.BG11中棕鞭藻生长速率次之,生物量产率为0.026 g/Ld,培养末期干重为0.514 g/L;棕鞭藻在生活废水中生长速率最慢,生物量产率为0.017 g/Ld,培养末期生物量干重为 0.379 g/L.相较于glu BG11,棕鞭藻在生活废水中与BG11中生长速率稳定,无明显对数生长期且在生活废水中与BG11中棕鞭藻的生物量产率较为接近,故使用生活废水培养微藻可在降低培养成本的同时实现废水的资源化利用.
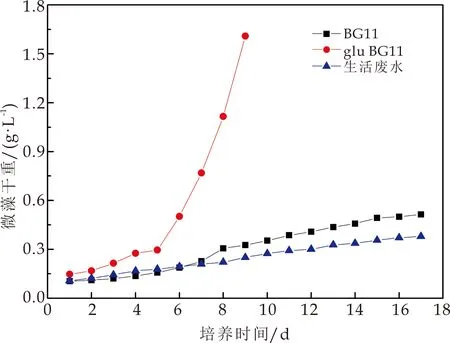
图1 棕鞭藻在不同营养环境中的生长曲线
2.2 棕鞭藻在不同营养环境中的自絮凝差异
棕鞭藻在不同营养环境中的自絮凝效率如图2所示.以低pH条件下诱导的絮凝来看,在较大pH范围(1~8)的生活废水中棕鞭藻自絮凝效率最高,pH为2时其絮凝效率达到最大(86.01%),约为BG11中絮凝效率的1.85倍,glu BG11中的3.16倍.上述结果证明,棕鞭藻更适合在低pH条件下的生活废水中絮凝.而在高pH(11~12)条件下,棕鞭藻在BG11中自絮凝效率最高,pH为12时可达72.39%,然而在生活废水中棕鞭藻的自絮凝效率仅为31.83%.高pH诱导的自发性絮凝其实质为Mg2+所生成的带正电沉淀物的电性中和作用[20],则棕鞭藻在高pH条件下的生活废水中絮凝效率较低的原因可能为废水中Mg2+含量较少.棕鞭藻在glu BG11中的絮凝效率最低且始终低于30%,葡萄糖的添加对微藻的自絮凝过程有显著的抑制作用.
2.3 生活废水对棕鞭藻自絮凝的影响
2.3.1 废水重悬体系中棕鞭藻自絮凝效率
图3描述了棕鞭藻在不同悬液体系中的自絮凝效率差异.由图3(a)可知,在低pH条件下,使用废水中微藻培养物离心后的上清液重悬BG11中的棕鞭藻细胞(E体系)其絮凝效率较BG11中显著上升,pH为2时其自絮凝效率由46.40%升至79.99%.与此同时,在相同pH条件下,使用BG11中微藻培养物离心后的上清重悬废水中的棕鞭藻细胞(D体系)其自絮凝效率较生活废水中显著下降.由此可推断相较于BG11培养基体系,经生活废水获得的微藻培养物中存在可促进棕鞭藻自絮凝的物质.刘洁霞等研究发现微藻在低pH条件下的絮凝与附着在微藻细胞上的羧酸根离子有关,羧酸根离子在pH值降低负电荷减少时接受质子中和,破坏藻细胞的分散稳定性从而导致藻细胞絮凝[20].生活废水环境更适合棕鞭藻在低pH条件下的自絮凝,其可能的原因为复杂生活废水环境中存在对棕鞭藻絮凝有显著促进的物质.
如图3(b)所示,在高pH(11~12)条件下,使用废水中微藻培养物离心后的上清液重悬BG11中的棕鞭藻细胞(E体系),棕鞭藻的自絮凝效率较BG11中显著下降,pH为12时其自絮凝效率由72.39%降至37.67%.而在相同的pH条件下,使用BG11中微藻培养物离心后的上清重悬废水中的棕鞭藻细胞时(D体系),棕鞭藻的絮凝效率则较生活废水显著升高.同时,高pH条件下棕鞭藻在生活废水中的自絮凝效率仅为30%左右,远低于其在BG11中的絮凝效率(70%左右).Vandamme等[22]研究发现增加微藻培养基的pH能引起Mg2+在培养基中水解形成Mg(OH)2沉淀,其机理主要是通过静电中和和卷扫絮凝微藻细胞.故推测棕鞭藻在高pH条件下的生活废水中絮凝效率较低的原因可能为废水中Mg2+含量较少.
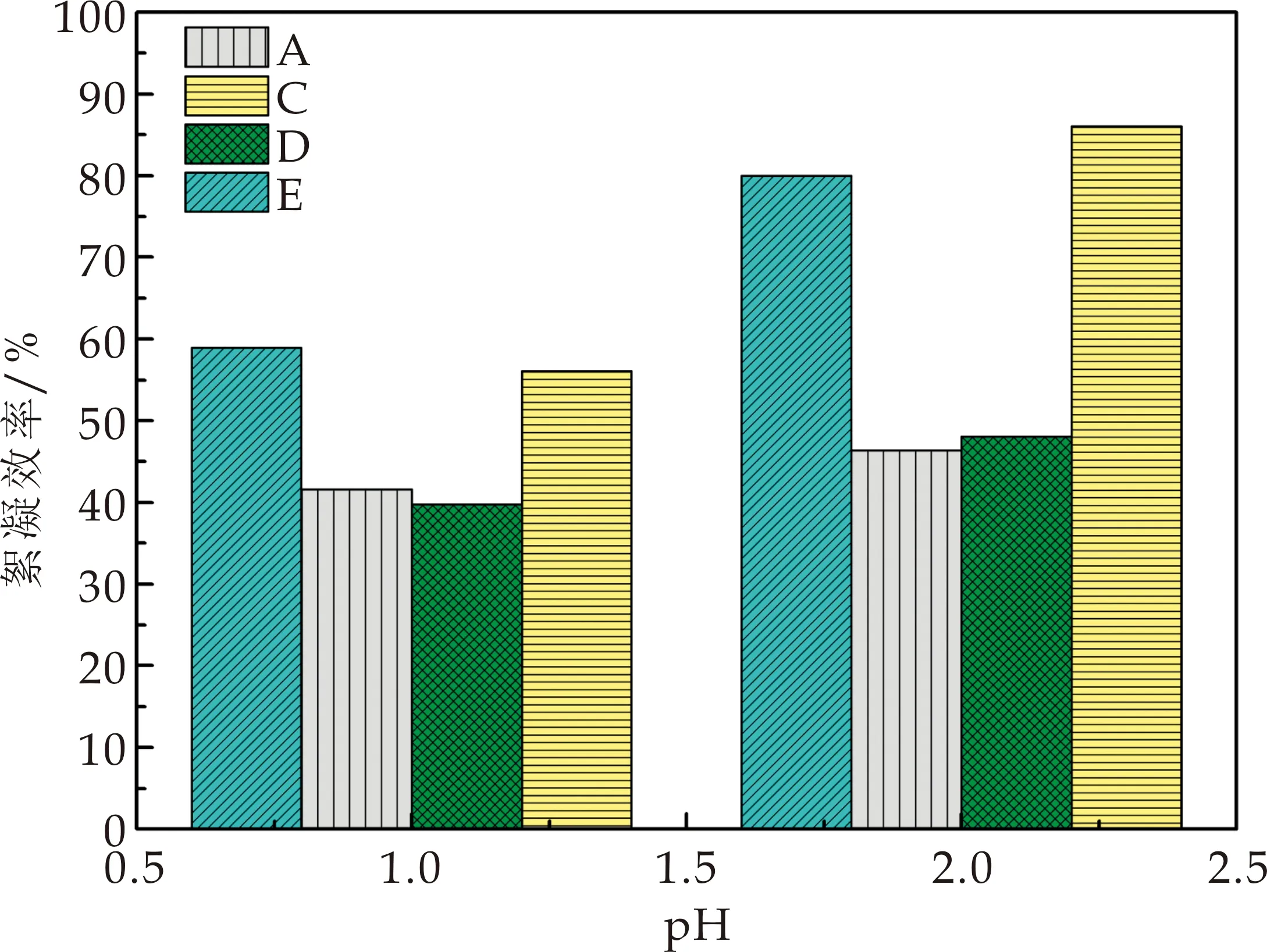
(a)低pH条件下棕鞭藻在各重悬体系中絮凝效率

(b)高pH条件下棕鞭藻在各重悬体系中絮凝效率图3 不同藻细胞悬液体系中自絮凝效率差异(A:BG11培养基中棕鞭藻培养液;C:废水环境中棕鞭藻培养液;D:使用BG11中微藻培养物离心后的上清重悬废水中的棕鞭藻细胞;E:使用废水中微藻培养物离心后的上清液重悬BG11中的棕鞭藻细胞)
2.3.2 Mg2+对生活废水中棕鞭藻自絮凝的影响
生活废水水质指标如表1所示.由于生活废水中Mg2+含量(0.36 mg/L)仅为BG11培养基中的5%,故通过Mg2+的添加以验证生活废水中Mg2+含量对棕鞭藻自絮凝的影响,自絮凝结果如图4所示.
由图4可知,在高pH(11~12)条件下,向生活废水中添加Mg2+对棕鞭藻的絮凝有显著的促进作用.pH为11时Mg2+含量对棕鞭藻自絮凝的促进作用更为显著,当Mg2+投加量为15 mg/L时棕鞭藻自絮凝效率达到最高(93.12%).该结果充分证明了棕鞭藻在高pH条件下的生活废水中絮凝效率较低是因为废水中所含Mg2+较少.

图4 Mg2+对废水环境中棕鞭藻自絮凝的影响
2.4 葡萄糖对棕鞭藻自絮凝的影响
为进一步探究glu BG11中葡萄糖的添加对棕鞭藻自絮凝的影响,故分别对酸性、中性及碱性(pH为2、8、11时)条件下F、G体系中的棕鞭藻自絮凝效率进行测定.
图5描述了棕鞭藻细胞在不同悬液体系中自絮凝效率变化.如图5所示,相较于BG11体系中(A体系),使用glu BG11中微藻培养物离心后的上清液重悬BG11中的棕鞭藻细胞(G体系)在各pH条件下(2、8、11)自絮凝效率均明显降低.当pH为11时,棕鞭藻自絮凝效率由67.02%(A体系)降至27.99%(G体系).使用BG11中微藻培养物离心后的上清液重悬glu BG11中的棕鞭藻细胞(F体系)可见其絮凝效率显著升高,pH为11时棕鞭藻的自絮凝效率由glu BG11(B体系)中的25.12%升至64.89%,BG11上清液对glu BG11中藻细胞的自絮凝过程有显著的促进作用.陈潮州[23]研究发现有机碳源促进微藻产生大量的AOM且AOM对微藻的絮凝存在抑制作用.故分别对三种pH条件下glu BG11培养基中棕鞭藻AOM产量进行测定.

图5 不同藻细胞悬液体系中自絮凝效率差异(A:BG11培养基中微藻培养液;B:glu BG11培养基中微藻培养液;F:使用BG11中微藻培养物离心后的上清液重悬glu BG11中的棕鞭藻细胞;G:使用glu BG11中微藻培养物离心后的上清液重悬BG11中的棕鞭藻细胞)
不同pH条件下棕鞭藻在BG11与glu BG11中AOM产量变化如图6所示.棕鞭藻在glu BG11中AOM产量较高,葡萄糖的添加促进棕鞭藻产生大量的AOM.当pH为11时,在BG11培养基中棕鞭藻的AOM产量仅为(0.035 g/L),而glu BG11中AOM产量则为0.557 g/L,约为BG11中棕鞭藻AOM产量的16倍,与此同时棕鞭藻在BG11中絮凝效率为67.02%也远高于其在glu BG11中的絮凝效率(25.12%).pH为8时,棕鞭藻AOM产量最低,glu BG11中AOM产量仅为0.106 g/L,约是pH为11条件下glu BG11中AOM产量的18%,BG11中AOM的产量为0.009 g/L.同时,棕鞭藻在BG11与glu BG11中絮凝效率分别为33.16%和28.78%,棕鞭藻在两种营养环境中AOM产量与絮凝效率均较接近,AOM对棕鞭藻的自絮凝过程抑制作用在pH为8时较小.
当pH为2时,棕鞭藻在BG11中絮凝效率为67.02%,而在glu BG11中其絮凝效率仅为25.12%,此时glu BG11中棕鞭藻AOM产量约为BG11中的13倍.结果表明,微藻培养过程中葡萄糖的加入可促进藻细胞产生大量的AOM,Vandamme等[24]研究发现藻类所产生的AOM中含有大量的胞外多糖,由于多糖中带负电荷的羧基可与带正电荷的离子产生电性中和作用,从而对微藻的自絮凝过程产生抑制.

图6 不同营养环境对棕鞭藻AOM产量的影响
3 结论
(1)不同营养环境对棕鞭藻的自絮凝影响差异显著.较大的pH(1~8)范围内,相较于BG11与glu BG11,生活废水中棕鞭藻自絮凝效率最高.在pH为2时其絮凝效率可达86.01%,棕鞭藻更适合在低pH条件下的生活废水中絮凝.
(2)生活废水环境中Mg2+含量较低导致了棕鞭藻在高pH(11~12)条件下自絮凝效率较低仅为30%左右.
(3)葡萄糖可促进棕鞭藻产生大量的AOM进而对其自絮凝过程产生抑制作用.
