原发肾脏原始神经外胚层肿瘤/尤文肉瘤7例临床分析
2020-01-06张林林黄吉炜陈勇辉黄翼然
张林林,蔡 文,黄吉炜,陈勇辉,张 进,黄翼然
(1.山东第一医科大学第二附属医院泌尿外科,山东泰安 271000;2.上海交通大学医学院附属仁济医院泌尿外科,上海 200120)
原始神经外胚层肿瘤(primitive neuroectodermal tumor,PNET),是原始神经管胚基细胞向原始神经分化的高度恶性小圆细胞性肿瘤。PNET常发生于中枢神经系统和胸壁、躯干、骨盆、腹膜后、四肢的软组织部分及骨骼[1]。既往多项研究认为尤文肉瘤(ewing’s sarcoma,ES)与PNET是同一肿瘤的两个不同阶段,ES为未分化型,是PNET的原始形态,而PNET则为伴有神经分化的一种类型,故将其称为尤文肉瘤/外周性原始神经外胚瘤家族[2-3]。肾脏原始神经外胚层肿瘤(renal primitive neuroectodermal tumor,rPNET)在临床上罕见,占肾脏肿瘤的比例不足1%[4]。SEEMAYER等[5]于1975年首次报道了发生于肾脏的PNET或ES。2016版世界卫生组织(World Health Organization,WHO)肾脏肿瘤分类中删除了原始神经外胚层肿瘤,新增了尤文肉瘤[6-7]。尽管有些学者试图定义一些鉴别PNET和ES的标准,但临床病例资料的不完整和病理特征的重叠使这一工作变得困难。因此结合文献及新版分类本研究将该类肾脏肿瘤称为肾脏原始神经外胚层肿瘤/尤文肉瘤(rPNET/ES)。目前,国内外有关rPNET/ES的报道较少,本文报道上海交通大学医学院附属仁济医院2003年1月至2015年7月收治的经病理学、免疫组化及荧光原位杂交基因检测(fluorescence in situ hybridization,FISH)证实的7例rPNET/ES患者的临床表现、影像学表现、治疗方式及预后,报告如下。
1 资料与方法
1.1 患者的一般资料7例患者,平均年龄为33.9岁,其中男性5例(71.4%),女性2例(28.6%)。肿瘤位置:左侧4例(57.1%),右侧3例(42.9%)。临床表现:腰腹部疼痛5例(71.4%),血尿2例(28.6%),腹部肿块5例(71.4%)。计算机断层扫描(computed tomography,CT)显示肿瘤最大直径为30.0 cm,平均直径9.2 cm。
1.2 治疗及预后评估的方法患者的术前评估包括病史、查体、血液、体液学检查、胸部及腹部CT及骨扫描等。6例患者接受根治性肾脏切除术(其中1例患者接受深低温停循环辅助下根治性肾脏切除+癌栓取出术),包括局部淋巴结清扫治疗;1例患者接受肾脏部分切除术,局部淋巴结活检为阴性。7例患者均未出现手术并发症。6例患者接受术后辅助化疗,方案为:VCA方案,即长春新碱(V)、环磷酞胺(C)、阿霉素(A)治疗。1例患者接受舒尼替尼靶向药物治疗。患者术后随访包括血常规、尿常规、肝肾功能等血液学检查,影像学检查包括肺部CT,肾脏超声、CT、磁共振成像(magnetic resonance imaging,MRI)或正电子发射计算机断层显像(positron emission tomography computed tomography,PET-CT)。
1.3 病理及免疫组化分析术后标本分别行HE染色、免疫组化(EnVision二步法)染色及FISH融合基因EWS-FLI1检测。一抗包括CD99、波形蛋白(vimentin,Vim)、神经元特异性烯醇化(neuron-specific enolase,NSE)、突触蛋白(synaptophysin,Syn)、S-100、嗜铬粒蛋白(chromogranin,CHr)、CD56、Friend白血病病毒插入位点1(friend leukemia virusintegration 1,FLI-1)。FISH判读标准:正常为两黄色信号,当镜下见一红一绿一黄信号,且比率>10%,则判读为EWSRl基因断裂,EWS-FLI1融合基因。
2 结 果
2.1 7例患者的临床特征术后病理示2例(28.6%)患者肿瘤局限在肾脏内,4例(57.1%)患者为局部进展性肿瘤,5例(71.4%)患者存在肾静脉癌栓,其中3例(42.9%)患者存在下腔静脉癌栓。2例(28.6%)患者出现转移(2例淋巴转移,其中1例同时存在肝脏转移;根据术前影像学以及术后病理均证实)。患者的影像学表现,临床特征及肿瘤特点见图1和表1、2。
2.2 随访期间7例患者的病情转归2例患者接受手术治疗后分别在1个月,3个月后死亡。1例患者接受手术治疗后12个月出现肿瘤复发,24个月后死亡。1例患者随访78个月,无复发迹象。1例患者接受治疗后在26个月后出现肺部转移,行肺叶切除后病情稳定,在77个月时出现静脉癌栓(下腔、肝静脉、奇静脉),79个月后死亡。1例患者接受肾部分切术,目前随访46个月,无肿瘤复发迹象。随访截止2019年4月30日(表1)。
表1 7例患者的临床特征、治疗方式及病情转归
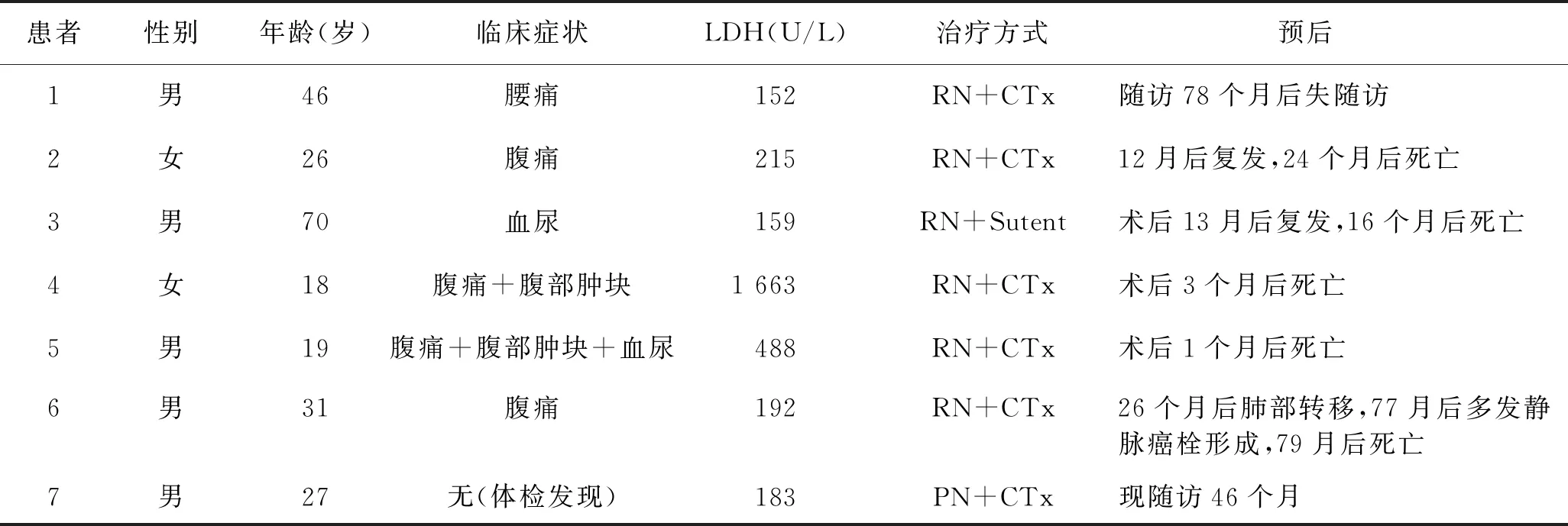
患者性别年龄(岁)临床症状LDH(U/L)治疗方式预后 1男46腰痛152RN+CTx随访78个月后失随访2女26腹痛215RN+CTx12月后复发,24个月后死亡3男70血尿159RN+Sutent术后13月后复发,16个月后死亡4女18腹痛+腹部肿块1 663RN+CTx术后3个月后死亡5男19腹痛+腹部肿块+血尿488RN+CTx术后1个月后死亡6男31腹痛192RN+CTx26个月后肺部转移,77月后多发静脉癌栓形成,79月后死亡7男27无(体检发现)183PN+CTx现随访46个月
CTx:化疗;RN:根治性肾脏切除术;PN:肾部分切除术;LDH:乳酸脱氢酶。
表2 7例患者的肿瘤学特征
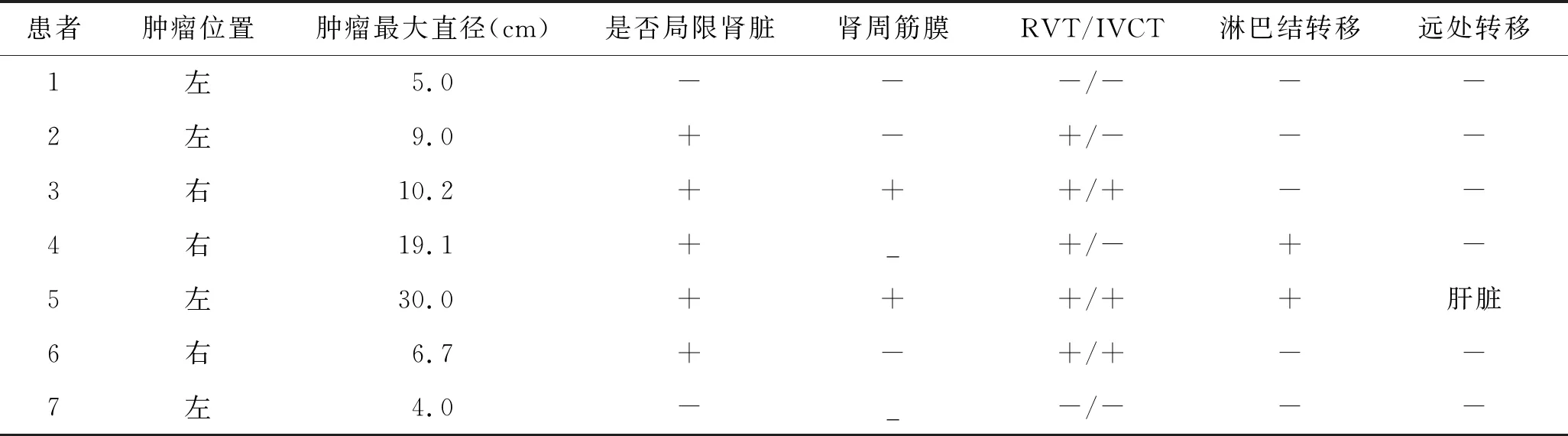
患者肿瘤位置肿瘤最大直径(cm)是否局限肾脏肾周筋膜RVT/IVCT淋巴结转移远处转移1左5.0---/---2左9.0+-+/---3右10.2+++/+--4右19.1+_+/-+-5左30.0+++/++肝脏6右6.7+-+/+--7左4.0-_-/---
RVT:肾静脉;IVCT:下腔静脉。
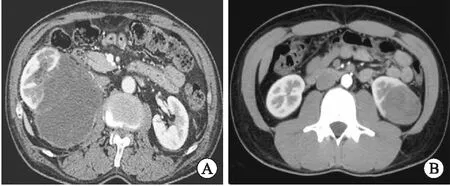
图1 患者术前CT图像
A:患者3右肾中部不规则团块状软组织密度影,肿瘤侵及肾静脉、下腔静脉。B:患者7左肾下极不规则团块状软组织密度影,其内密度不均,中央可见低密度灶,与正常肾脏组织无明显分界,增强扫描皮质期,肿块轻度不均匀性强化,分隔样结构、液性成分,分隔呈强化。
2.3 7例患者肿瘤的免疫组织学特点HE染色示肿瘤组织由致密的形态单一的小圆细胞组成,细胞核深染,核质比例高,肿瘤组织被纤维分割成癌巢,肿瘤细胞包绕血管排列形成Homer-Wright假菊形团状结构(图2)。免疫组化示所有患者CD99、FLI-1弥漫性表达(图2、表3),其余标志不同程度表达(表3)。7例患者EWSR1(22q12)试剂检测存在t(11;22)染色体易位而产生的EWS-FLI1融合基因(图2)。
表3 7例患者肿瘤的免疫组织学特点

患者CD99NSEVimSynS-100CHrCD56ESW-FLI11++-+---+2+++-+--+3+++---++4+-+-+-++5++++-+++6+-+-+-++7+/-++--+-+
NSE:神经元特异性烯醇化;Vim:波形蛋白;Syn:突触蛋白;CHr:嗜铬粒蛋白。

图2 患者3的病理及免疫组化图
A:肿瘤细胞围绕血管排列形成Homer-Wright假菊形团状结构(HE,×400);B:肿瘤细胞细胞膜CD99阳性(EnVision,×400);C:肿瘤细胞细胞膜FLI-1阳性(EnVision,×400);D:肿瘤细胞在EWSR1区域显示,一红色跟一绿色信号融合,形成一个EWS-FLI1 融合基因。
3 讨 论
从胚胎发育角度看神经系统是由具有多向潜能分化的干细胞原始神经外胚层细胞分化而来,这些原始的幼稚细胞经过高度的协调分化,形成神经元和神经胶质。经过一系列细胞增生、移动、分化和凋亡,逐渐发育成成熟的神经系统。如果这一分化过程出现异常,则有可能形成神经系统肿瘤[8]。当大多数肿瘤细胞处于原始未分化阶段,则形成具有多向潜能分化的小细胞肿瘤。PNET是起源于原始神经管胚基细胞未分化的高度恶性肿瘤,具有向神经元、神经胶质和间叶组织多向分化的潜能,极易出现局部复发和远处转移。PNET也可发生于胰腺、胆管、子宫、小肠、卵巢、皮肤。rPNET在临床上罕见,该类肿瘤起源于肾脏较起源于其他部位的恶性程度更高[9]。
ELLINGER等[10]报道了52例肾脏PNET,发病年龄4~66岁,平均年龄26岁,男性多于女性。有文献报道[11-12]该病平均发病年龄为28岁,男女比例为3∶1。本组7例患者男性发病率较高,平均年龄为33.9岁,其中有1例70岁患者,其余6例主要为青少年和年轻成年人。有报道提示这种肿瘤左肾发病率稍高,但未解释原因[13]。郑玉龙等[14]对既往文献报道的142例患者分析,其中59例病灶位于左侧,77例位于右侧,左右侧发病并无明显规律。本组7例患者左右侧比例为4∶3。结合文献及本研究提示,该病主要为青少年和年轻成年人,男性发病率高于女性,肾脏左右侧发病无明显规律。
该病临床症状不典型,有报道rPNET/ES临床表现与一般肾肿瘤类似,主要表现为腰痛或腹痛、血尿以及腹部包块等[15]。本组7例患者腰腹部疼痛5例、腹部肿块2例、血尿2例,查体发现1例。临床表现均为一般肾脏肿瘤特征,未有特异性临床表现,考虑到因肿块生长迅速该肿瘤发现时体积较大可能出现腰痛。ELLINGER等[10]发现57.6%的rPNET/ES患者在诊断时处于临床进展期,25%的患者伴有淋巴结转移,20%伴有肺转移,14%伴有肝脏转移。也有文献报道1/3的患者在发现时存在肾静脉或下腔静脉瘤栓,转移的最常见部位是肺,其次是肝、骨、淋巴结[16]。本组7例患者淋巴转移2例(28.6%),肝脏转移1例(14.3%)(该患者肿瘤侵犯脾脏、结肠、胰腺)。侵犯肾静脉5例(71.43%),其中合并下腔静脉癌栓3例(42.86%)。本组病例显示该类肿瘤临床表现无特异性,发现时较一般肾肿瘤大,处于进展期(最常见的即为侵犯肾静脉或下腔静脉)。有报道rPNET/ES患者出现乳酸脱氢酶(lactate dehydrogenase,LDH)升高,并且预后不良[10]。本组7例患者中有2例患者LDH升高,考虑没有特异性。
余洪等[17]总结了国内外文献对rPNET/ES在影像学方面的报道:①超声表现为肾脏结构破坏、肾脏内肿块呈不均质等、低回声团块,肿瘤坏死时可见无回声区,边界多不清楚,血流信号丰富,肾静脉、下腔静脉血栓形成时静脉增宽,其内可见实质性回声。超声无特异性表现;②CT表现为肾脏内孤立的、体积较大的、边界不清的、不规则状软组织肿块,肿块多浸润性生长,肿块密度不均,坏死、囊变多见,肿块实性部分呈等、稍低密度,坏死囊变呈低密度,偶可见出血,呈高密度,钙化少见;增强扫描实质部分强化程度不一,多呈轻中度强化,以分隔样、花环状、蜂窝状强化为主,肿块坏死、囊变区无强化,其强化方式具有一定特征性,有时肾静脉、下腔静脉内可见癌栓形成;③MRI示病灶T1WI呈等或稍低信号,T2WI呈稍高或等信号改变,坏死、囊变呈T1WI低信号,T2WI高信号,肿块伴出血时随出血时间变化信号表现复杂。肿瘤及转移灶在DWI上表现为高信号。AKKAYA等[4]指出rPNET/ES的表观扩展系数值(ADC)低于肾细胞癌,但还有待进一步研究。在诊断方面CT检查rPNET/ES的准确率与MRI的结果不存在显著差异[18]。本组7例患者行CT检查符合文献报道。其中1例患者因查体发现,肿瘤体积较小,没有发生淋巴转移及癌栓形成,平扫左肾下极不规则团块状软组织密度影,密度不均,与正常肾脏组织无明显分界,增强扫描皮质期,肿块轻度不均匀性强化,分隔样结构、液性成分,分隔呈强化。髓质期强化程度稍增加,呈中度强化。我们分析年轻肾脏肿瘤患者术前如果发现肿瘤体积较大,CT强化不明显,并延迟强化,隔样结构、液性成分,分隔呈强化等特征,要考虑rPNET/ES的可能。
rPNET/ES病理学特点为光镜下可见肿瘤组织由致密的形态单一的小圆细胞构成,瘤细胞无明显胞质,部分区域可见透亮胞质,细胞核呈圆形、卵圆形,核染色深,核分裂象易见,细胞围绕血管形成典型的Homer-Wright菊形团更具有诊断意义[19]。而此征象同样也可出现在其他肾脏肿瘤中,如成神经细胞瘤、肾脏透明细胞肉瘤,因此菊形团在这些疾病的鉴别诊断上,价值是有限的,需要进一步行免疫组织化学及细胞遗传学确诊。免疫组化示神经内分泌抗体标志物表达阳性,如CD99、S-100、NSE等,但均缺乏特异性。有文献报道临床常用的诊断标准为CD99阳性,并有2种以上不同神经标志物的表达,淋巴细胞共同抗原阴性及肌源性肿瘤的免疫组化检查阴性可排除淋巴瘤及小圆细胞肌源性肿瘤,可以诊断为PNET/ES[20]。FLI-1蛋白的免疫组化分析对PNET/ES诊断有较高的应用价值[21]。有文献报道FLI-1在PNET中的表达约为80%,因此联合应用CD99和FLI-1可提高对PNET诊断的灵敏度[22]。我们对7例肿瘤组织进行免疫组化染色,肿瘤细胞CD99、FLI-1均阳性,其他SMA、MyoD1、CK和LCA等不同表达。即使免疫组化基本可以确诊,但仍存在有些容易混淆免疫组织化学特点的肿瘤,这就需要细胞遗传学的帮助。近来有研究发现90%~95%的ES/PNET存在11号和22号染色体易位t(11;22)(q24;q12),导致22q12的EWS基因5′氨基端与11q24的转录因子基因FLI-1的3′羟基端融合,EWS基因的RNA结合域缺失并由FLI-1的DNA结合域取代,形成EWS-FLI1融合基因[23]。鉴于ES/PNET的肿瘤细胞有上述特点,我们对7例肿瘤组织采用FISH基因检测方法检测EWS-FLI1融合基因。7例患者均检测到EWS-FLI1基因。因此,用FISH法检测EWS-FLI1融合基因是诊断rPNET/ES的一种简单准确的方法,该法操作简便,不需要新鲜组织及细胞,采用石蜡固定的组织即可。
目前尚无原发性rPNET/ES的标准治疗方案,根治性肾切除术仍是首选的治疗方法,但是仅单纯的手术切除治疗复发率极高,所以大多数患者采取手术联合化疗的综合治疗方法[24]。早期发现并行手术切除是综合治疗中最重要的部分[25]。REDDY等[26]认为完全手术切除的患者与部分切除的患者相比预后较好。但本组1例部分切除患者行46个月密切随访,未见有肿瘤复发及转移。化疗通常采用尤文氏肉瘤化疗方案选用长春新碱、阿霉素和环磷酰胺等治疗[13]。有文献报道放疗对该类肿瘤的作用尚不明确,在晚期和侵犯肾周筋膜时可考虑[27]。余万钧[28]尝试使用索拉非尼作为后续治疗,随访17个月后复查,显示残余肿瘤生长较慢,并且未出现远处转移。本组1例患者应用靶向药物治疗并没有出现理想效果,6例患者接受肾脏切除术,其中1例接受肾脏部分切除术。6例患者术后接受VAC化疗方案,手术联合化疗,但效果没有明显规律性。总体上,肿瘤体积越小,肾静脉浸润及淋巴转移,行手术治疗同时术后加化疗相对预后较好。目前该类肿瘤采用肾脏部分切除手术方式的病例报道较少,但随着人们体检意识的增强,越来越多的肾脏肿瘤可以被早期发现,采用肾脏部分切除治疗肾肿瘤的患者越来越多。结合其他部位、器官的PNET,对于rPNET/ES,我们认为:如果患者肿瘤体积小,未有淋巴及血管浸润,采用肾脏部分切除术后经病理证实为该类肿瘤,要常规行辅助化疗,然后定期复查,密切随访。对于肿瘤体积较大,或术前存在淋巴及血管浸润,采用根治性肾脏切除术及淋巴结清扫术,术后要常规行辅助化疗,术后定期复查,密切随访。对于化疗方案的选择我们建议参照尤文氏家族肉瘤的化疗方案。
郑玉龙等[14]认为患者的年龄、性别、肿瘤位置、肿瘤大小、染色体易位、是否有血栓及免疫组化等各种标记的表达对预后的影响并无统计学意义,而可触及肿块和有远处转移是患者预后的独立因素。AGHILI等[29]认为儿童和年轻成人rPNET/ES如果未出现转移,则预后相对较好。THYAVIHALLY等[13]报道rPNET/ES患者3年和5年生存率分别为60%和42%。另有报道rPNET/ES患者接受术后化疗的3年生存率约30%,5年生存率为42%~50%[30-31]。本组1例患者在随访78个月后失随访,对总的治疗效果评价及疾病的生存率有影响。本组7例患者,3年生存率为42.9%,2例发现较早的病例,如果没有肾静脉浸润及淋巴转移,行手术治疗同时术后加化疗相对预后可能较好。我们认为该类肿瘤如果没有出现转移,相对预后较好。鉴于肾肿瘤在早期阶段发生转移的几率是很高的,常见的转移部位有静脉、区域淋巴结、肺、肝、骨、骨髓等,故建议术后常规行PEC-CT检查以免漏诊。
综上所述,rPNET/ES好发于青少年和年轻成年人,临床表现无特异性。青少年及年轻成人中如果发现肾脏肿瘤,且肿瘤体积较大存在静脉癌栓或淋巴结转移应考虑rPNET/ES。采用FISH检测EWS-FLI1融合基因联合免疫组化有助于诊断该类肿瘤。rPNET/ES恶性程度高,建议一旦发现,尽早行外科手术治疗,术后常规辅助化疗并密切随访,以提高患者生存率。
