基于网络药理学探讨人参的免疫调节机制Δ
2020-01-06郑厚胜王英平郑斯文白玉洁1唐玲玲
郑厚胜,王英平,郑斯文,白玉洁1,,唐玲玲
(1.吉林农业大学中药材学院,吉林 长春 130118; 2.中国农业科学院特产研究所药用植物资源与育种科技创新团队,吉林 长春 130112; 3.吉林省电力医院体验科,吉林 长春 130021)
人参是世界上使用广泛的草药之一,自古以来,其在东亚地区都有广泛的应用,我国从唐朝开始就有种植人参以作药用的记载,因此积累了大量的人参药用经验。在《神农本草经》《伤寒论》和《本草纲目》等诸多著作中均有人参药用记载,本草纲目认为人参“治男、妇一切虚症”。人参的化学成分包括人参皂苷、多糖、黄酮类及挥发油等,其主要的药理活性成分为人参皂苷和多糖,具有抗炎、提高机体免疫功能[1-3]、抗肿瘤[4-5]和抗病毒[6]等作用。尽管大量学者已经努力研究了人参的分子机制,但仍不清楚人参多种成分组合如何发挥协同作用而产生临床效果。运用传统的西方药理学研究方法难以对拥有复杂化学成分的系统性机制进行研究。因此,需要新颖的方法。近年来,网络药物学的出现填补了系统性阐明草药机制的空白。网络药理学在分析草药在人体内的作用时,侧重于多种组分共同作用,多途径、多靶点发挥作用[7]。本研究基于网络药理学方法,探讨了人参调节免疫的靶点和信号通路等。
1 资料与方法
1.1 人参有效成分、靶点的查询与筛选
将人参输入中药系统药理学数据库和分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP),以TCMSP的默认阈值口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-likeness,DL)≥0.18作为有效成分的筛选条件,查询并筛选该数据库中所包含的人参有效活性成分及作用靶点,删除无靶点蛋白的成分、重复靶点,制作成Excel表格。在Uniprot数据库(http://www.Uniprot.org/)中将筛选所得靶点转化为基因名,种属为:Homo sapiens(Human),制作人参“成分-靶点”基因数据表格。
1.2 人参“成分-靶点”网络的构建
将人参“成分-靶点”基因数据导入Cytoscape 3.6.1软件,对数据进行分析,并将数据图形化以网络图形式进行展示,以不同的节点表示数据类型,以连线表示相互作用关系。并通过该软件插件CytoNCA[8]进行拓扑分析,根据节点度值(Degree),筛选出人参的核心靶点。Degree越高,表示节点在该网络中的作用越重要[9]。
1.3 疾病靶点的确定
通过Uniprot数据库(https://www.uniprot.org/)、治疗靶点数据库(therapeutic target database,TTD)(https://db.idrblab.org/ttd/)以及遗传关联数据库(genetic association database,GAD)(http://geneticassociationdb.nih.gov/),检索免疫相关靶点,删除重复靶点,将获取信息录入Excel软件中。将人参有效成分作用靶点与免疫相关靶点进行交集对比,最终获得人参调节免疫的潜在作用靶点[10]。
1.4 基因通路与功能分析
采用DAVID数据库(https://david.ncifcrf.gov/),对人参调节免疫的潜在作用靶点进行基因本体(gene ontology,GO)功能和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,Select Identifier设置为“()OFFICIAL_GENE_ SYMBOL”,List设置为“Homo sapiens”,确定“Current Background”为“Homo sapiens”,上传数据,保存“Gene_Ontology”中的“GOTERM_ BP_DIRECT”(生物学过程)、“GOTERM_CC_DIRECT”(细胞组分)、“GOTERM_ MF_ DIRECT”(分子功能);保存“Pathways”中的“KEGG_ PATH-WAY”[11]。
2 结果
2.1 人参有效成分及对应靶点
在OB≥30%、DL≥0.18的筛选条件下,获得人参有效成分22种,见表1。22种有效成分中,有5种未找到对应靶点,去除非人基因,其余17种成分获得潜在靶点118个。

表1 人参有效成分的基本信息(OB≥30%,DL≥0.18)Tab 1 Main active ingredients of ginseng(OB≥30%,DL≥0.18)
2.2 人参“成分-靶点”网络
人参“成分-靶点”网络图见图1。该图包含节点135个(右侧菱形节点为成分,左侧圆形节点为靶点),边线252条;其中,成分Degree平均值为3.306,Degree>平均值的成分有11个,Degree最高者为“Kaempferol”,其余依次为“Beta-sitosterol”“Stigmasterol”“Fumarine”“Inermin”“Frutinone A”“Suchilactone”“Ginsenoside rh2”“Girinimbin”“Aposiopolamine”和“Arachidonate”。
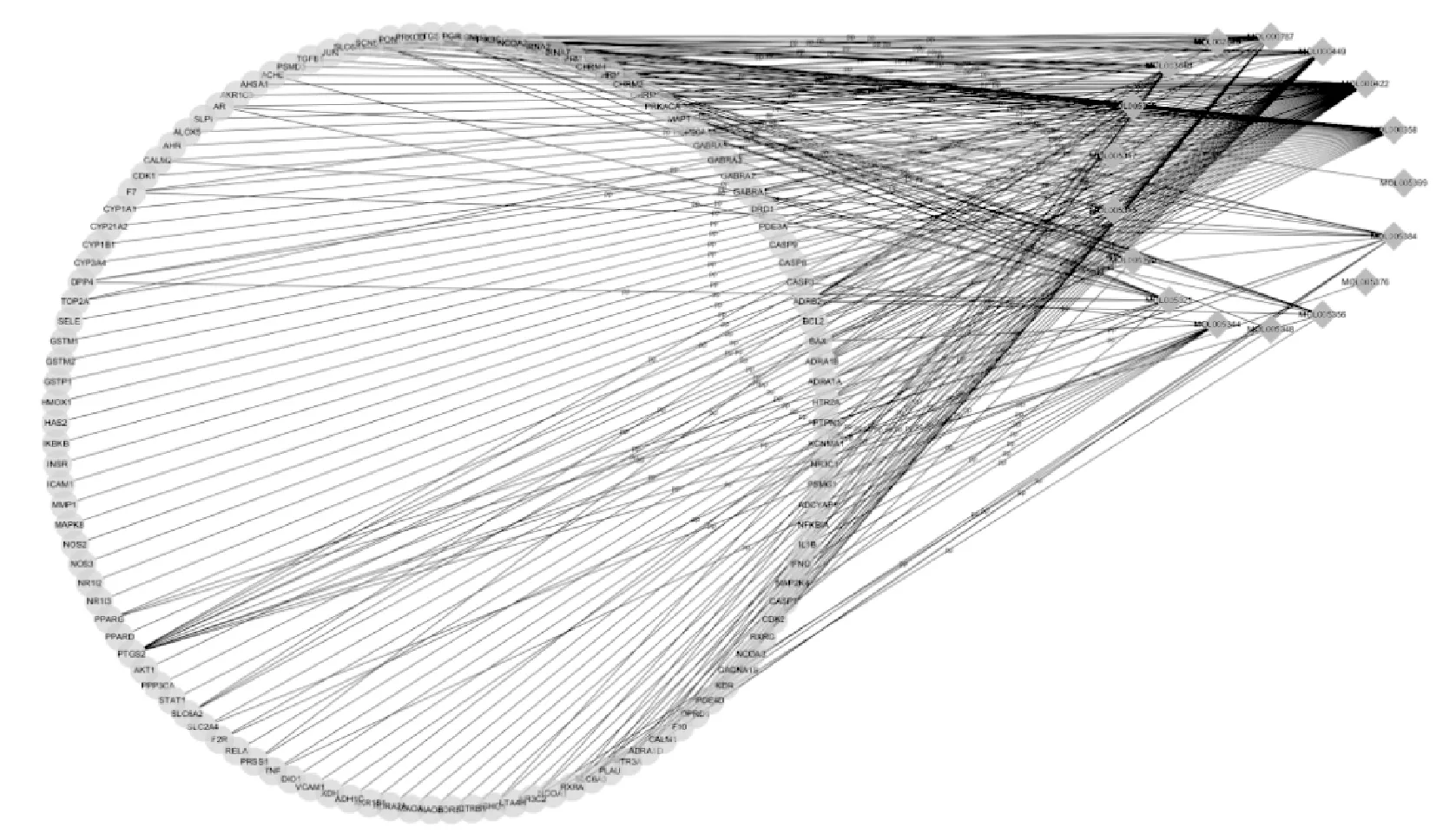
图1 人参“成分-靶点”网络图Fig 1 Composition-Target network of ginseng
2.3 免疫相关靶点数据构建及比对分析
在Uniprot、TTD和GAD数据库共筛选出2 083个基因组建免疫相关靶点数据库。对人参有效成分作用靶点与免疫相关靶点进行核查比对,共得出24个核心作用靶点基因,包括“IL1B”、“IFNG”、“TNF”、“CYP1A1”和“TGFB1”等,其中“IGHG1”在多个数据库中没有记录,因此不对其进行分析。人参有效成分作用靶点与免疫相关靶点韦恩图见图2。人参有效成分作用靶点与免疫相关靶点的蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络关系见图3。人参有效成分对免疫作用靶点的拓扑学分析见表2。经Network Analyzer分析网络拓扑学属性发现,该PPI网络中,聚类系数为0.644,平均节点Degree为9.04,平均最短路径为1.78,中介中心性为0 ~0.027,接近中心性为0~0.77,其中22个重叠靶点在关系网络中体现了较好的连通特性,是人参发挥免疫调节作用的关键靶点。

图2 人参有效成分作用靶点与免疫相关靶点韦恩图Fig 2 Venn diagram of active ingredients in ginseng and immune-related targets
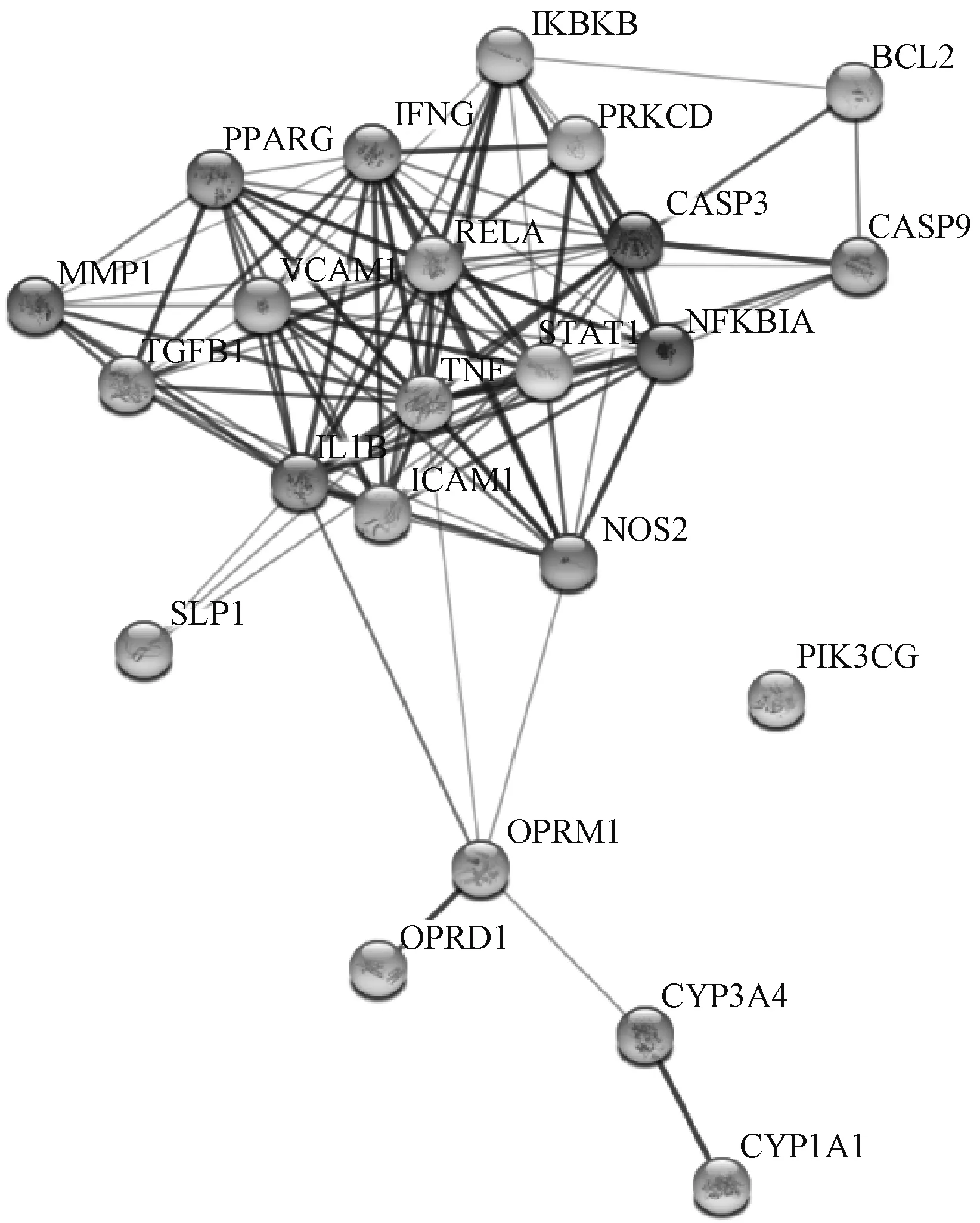
图3 人参有效成分作用靶点与免疫相关靶点的PPI网络关系Fig 3 PPI network relationship between active components and immune related targets of Panax ginseng

表2 人参有效成分对免疫作用靶点的拓扑学分析Tab 2 Topological analysis of active ingredients of ginseng on immune-related targets

A.生物学过程;B.细胞组分;C.分子功能A.biological process; B.cell component; C.molecular function图4 PPI网络中的GO条目(FDR<0.05的前20个)Fig 4 GO items in PPI network (Top 20 of FDR<0.05)
2.4 GO功能富集分析
利用DAVID平台对核心靶点进行GO功能富集分析,共确定了226个GO条目,根据错误发现率(false discovery rate,FDR)<0.05筛选,根据各功能的FDR列出前20个GO条目,见图4。其中,生物学过程相关条目178个,主要涉及细胞对有机环状化合物的反应、对药物的反应、核因子κB转录因子活性的正调节、γ干扰素介导的信号通路、细胞凋亡过程、基因表达的负调控及趋化因子生物合成过程的积极调节等方面;分子功能相关条目31个,主要涉及细胞因子活性、各类蛋白结合、酶类结合、转录因子结合及DNA结合等方面;细胞组分相关条目17个,主要涉及膜筏、核因子κB抑制蛋白/核因子κB复合物、细胞质膜、神经元投射及内质网等方面。
2.5 KEGG通路富集分析
利用DAVID数据库对筛选出的核心靶点进行KEGG通路富集分析,对人参有效成分PPI网络中涉及的24个蛋白在信号通路中的作用进行通路富集分析,得到66条信号通路。以P<0.01、FDR<0.05进行筛选,其中前20条通路包括弓形体病通路、破骨细胞分化通路、乙型肝炎通路、细胞凋亡通路、南美锥虫病(美洲锥虫病)通路、肿瘤坏死因子信号通路、甲型流感通路、肺结核通路、利什曼病通路、恶性肿瘤的途径通路、核因子κB信号通路、阿米巴病通路、小细胞肺癌通路、疟疾通路、军团病通路、Toll样受体信号通路、单纯疱疹感染通路、炎症性肠病通路、胰腺癌通路及非洲锥虫病通路,表明人参的有效成分可能通过作用于上述信号通路来发挥药理活性。运用Omicshare平台(http://www.omicshare.com/tools/index.php/)对富集分析结果进行可视化处理,结果见图5。
3 讨论
中草药使用历史悠久,积累了大量的人体应用经验,理论体系丰富,但其复杂的物质组分导致其作用机制难以明确。网络药理学运用中药药剂学、药理学、蛋白组学、代谢组学及基因组学等学科的大数据,将中药复杂的作用机制通过网络学科语言呈现出来,不再局限于以往单成分、单靶点的研究方式,从整体的角度去研究药物与疾病间的关联性,明确中药的多种成分通过作用于不同的蛋白靶标,协同性地调控机体的生物功能及信号通路,从而发挥其独特的疗效。网络药理学是中医药科学发展的有力工具,为中药的研究方向提供了指导。
根据网络药理学的研究方法,本研究筛选了17种在TCMSP数据库中有对应靶点的化学成分,构建人参“成分-靶点”网络,分析成分与靶点的相互作用关系。人参“成分-靶点”网络中的关键化合物为β-谷甾醇、豆甾醇和富马碱等。β-谷甾醇与豆甾醇同属植物甾醇类化合物,药理活性大多相似[12-13],具有抗氧化[14]、降低胆固醇[15]、抗炎[16]和抗肿瘤[17]等功效。人参皂苷rh2具有抗肿瘤[18]、提高免疫功能[19]等功效。吉九里香碱可以通过磷脂酰肌醇-3-激酶(PI3K)/Akt和Wnt/β连环蛋白信号通路抑制人体卵巢癌细胞的体外增殖[20];还通过阻滞细胞G0/G1期诱导细胞凋亡来抑制HepG2细胞的增殖[21]。
将人参有效成分作用靶点与免疫靶点进行交集,得到共同作用靶点24个,其中“TNF”和“IL1B”是最接近中心的靶点,“CASP3”次之。目前,关于人参通过对“TNF”和“IL1B”调控影响免疫功能的研究很多,因此本研究结果具有极高的可信度。肿瘤坏死因子(tumor necrosis factor,TNF)是迄今为止所发现的可直接杀伤肿瘤细胞而对正常细胞无明显毒性的细胞因子之一,主要为TNF-α、TNF-β。TNF是一种多效因子,参与多种生理活动。TNF可直接作用于T细胞、B细胞及自然杀伤细胞等效应细胞,促进T细胞MHC-Ⅰ类抗原表达,增强依赖IL-2的胸腺细胞、T细胞增殖能力,促进IL-2、巨噬细胞集落刺激因子等淋巴因子产生,TNF与γ干扰素联合作用直接诱导肿瘤细胞的永久性生长停滞,这可能是生物体阻止恶性肿瘤的机制[22]。持续存在TNF-α是保持兴奋性突触的突触强度所必需的。通过对AMPA受体运输的影响,TNF-α可能在突触可塑性和调节对神经损伤的反应中起作用[23]。IL-1β由活化的巨噬细胞产生,通过诱导IL-2释放、B细胞成熟和增殖以及成纤维细胞生长因子活性来刺激胸腺细胞增殖。IL-1蛋白参与炎症反应,被鉴定为内源性热原,据报道,西洋参茎叶总皂苷可通过降低IL-1β的表达,降低炎症反应,减轻大鼠脑神经功能损伤程度,减轻脑水肿,从而对局灶性脑缺血损伤起到保护作用[24]。含半胱氨酸的天冬氨酸蛋白水解酶3(Caspase-3)是细胞内半胱氨酸蛋白酶,在损伤细胞的细胞凋亡反应中被激活。人类原代细胞在TNF或化疗药激活Caspase-3后表现出Gasdermin E(GSDME)蛋白依赖性的细胞凋亡,这有助于缓解化疗的毒性[25]。
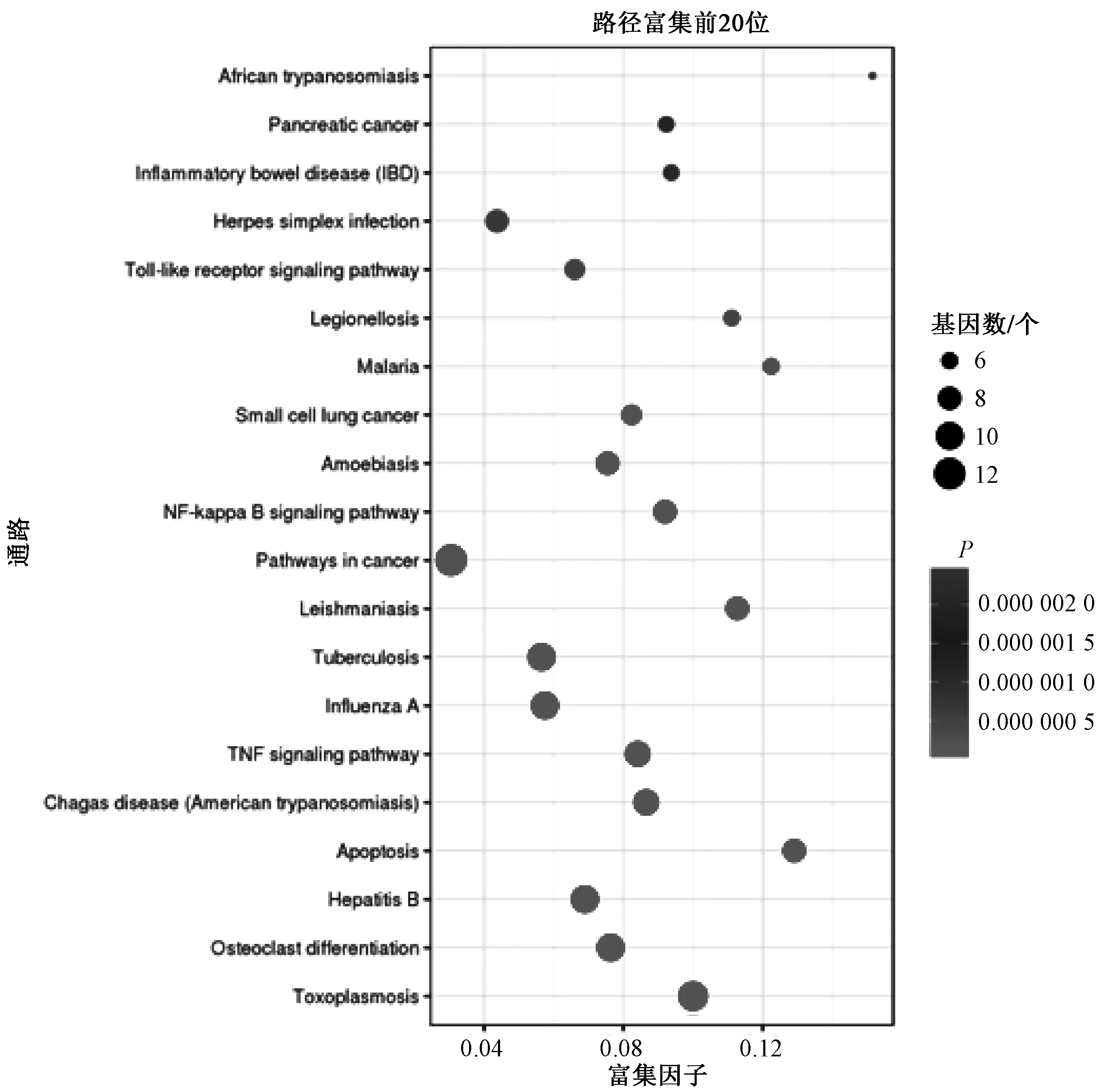
图5 KEGG机制分析Fig 5 KEGG mechanism analysis
为了进一步了解24个共同作用靶点的功能和作用通路,对其进行了GO功能富集和KEGG通路富集分析。发现人参在免疫方面主要能够调控核因子κB转录因子活性的正调节、γ干扰素介导的信号通路、细胞凋亡过程、基因表达的负调控、趋化因子生物合成过程的积极调节及细胞因子活性等方面;涉及多条与恶性肿瘤有直接关系的通路,包括恶性肿瘤的途径、小细胞肺癌、胰腺癌、前列腺癌及结直肠癌等;与免疫有直接关系的通路包括TNF信号通路、核因子κB信号通路、Toll样受体信号通路、T细胞受体信号通路、趋化因子信号通路、自然杀伤细胞介导的细胞毒性及B细胞受体信号通路等。目前,已有多项研究结果表明,人参可以增强人体免疫功能,减轻化疗引起的免疫抑制,提高疾病控制率[26-28]。但其活性成分复杂,作用机制难以分析,希望通过本研究能为以后的实验提供一定帮助。
综上所述,本研究应用网络药理学方法,分析了人参在人体内多种组分的共同作用,多途径、多靶点发挥作用,对进一步了解人参的作用机制提供了一定参考,为后续从人参中选取有效药物成分、选取研究靶点提供了依据。在大数据时代,随着各种研究数据的不断丰富,网络药理学的分析结果也将越来越科学,越来越接近真实,这将是未来中医药理论发展的一个方向。
