猪瘟病毒贵州株 E2基因序列分析
2020-01-033
3
(1.贵州省动物疫病预防控制中心,贵州 贵阳 550008;2.贵州大学动物科学学院,贵州 贵阳 550025;3.贵州省动物疫病与兽医公共卫生重点实验室,贵州 贵阳 550025)
猪瘟(Classical swine fever,CSF)是1种急性、高度传染性疫病,是猪的主要传染病之一,临床表现为实质器官出血、坏死和梗死。慢性病例呈纤维素性坏死性肠炎,后期常伴有副伤寒、巴氏杆菌病等继发感染[1~4]。目前猪瘟的急性暴发式流行已得到控制,但仍不断有散发猪瘟的报道,有的猪瘟病例呈现非典型性症状,甚至通过胎盘感染而引起繁殖障碍[5~7]。猪瘟病毒(CSFV)是具有囊膜的单股正链RNA病毒,长度为12.3 kb,仅含有1个大的开放阅读框架(ORF),编码1个含3 898个氨基酸残基的多聚前体蛋白,其前体蛋白被加工成CSFV蛋白的顺序依次为NPRO、C、E0、E1、E2、P7、NS2、NS3、NS4A、NS4B、NS5A、NS5B[8~11]。其中C、E0、E1、E2为其结构蛋白,但只有EO和E2囊膜糖蛋白能够诱导机体产生中和抗体。E2囊膜糖蛋白是猪瘟病毒的主要结构蛋白,是抗猪瘟病毒感染的主要保护性抗原。因此,E2基因的研究能较好地反映猪瘟病毒的进化与疫苗免疫效果相关关系。本研究通过扩增猪瘟病毒贵州株E2基因片段,通过克隆、测序和序列分析,了解其基因变异性和进化关系,旨在掌握贵州省猪瘟散发病例病原进化信息,为疫苗选择与防控提供参考。
1 材料与方法
1.1 材料(1)猪瘟病料组织样本,采自贵州省某养殖场临床病例。(2)阳性对照样本为猪瘟弱毒疫苗,由贵州瑞特新科农牧有限公司提供。
1.2 试剂RT-PCR扩增试剂、RNA提取试剂盒、胶回收试剂盒、限制性内切酶Hind Ⅲ和BamH Ⅰ、200 bp Marker、pMD19-T载体等均购自宝生物工程(大连)有限公司。
1.3 引物设计与合成针对CSFVE2基因序列信息,设计CSFVE2基因特异性引物1对,引物序列见表1,引物由宝生物工程(大连)有限公司合成。

表1 引物序列信息
1.4 CSFVE2基因的RT-PCR扩增按照RNA提取试剂盒说明书方法提取组织样本和猪瘟疫苗的总RNA,将提取的总RNA反转录为cDNA。以cDNA为模板,建立PCR反应体系50 μL:2×TaqMasterMix 25.0 μL,引物P1、P2各2.0 μL,DNA模板4.0 μL,灭菌ddH2O 17.0 μL。反应条件:94 ℃预变性3 min;94 ℃变性40 s,56 ℃退火30 s,72 ℃延伸40 s,共35个循环;最后72 ℃延伸 10 min。PCR产物经电泳观察结果。
1.5 CSFVE2基因克隆与测序将目的基因进行胶回收,目的基因与pMD19-T载体连接转化感受态细胞,应用PCR和双酶切技术对重组质粒进行筛选,阳性质粒由大连宝生物有限公司进行测序。
1.6 目的基因序列分析采用DNAStar和Mega 5.0软件对CSFVE2基因变异、核苷酸同源性和系统进化分析。
2 结果
2.1 CSFVE2基因的RT-PCR扩增结果由图1可见,组织样本中扩增获得大小约1 343 bp的基因片段,与预期扩增大小相符。
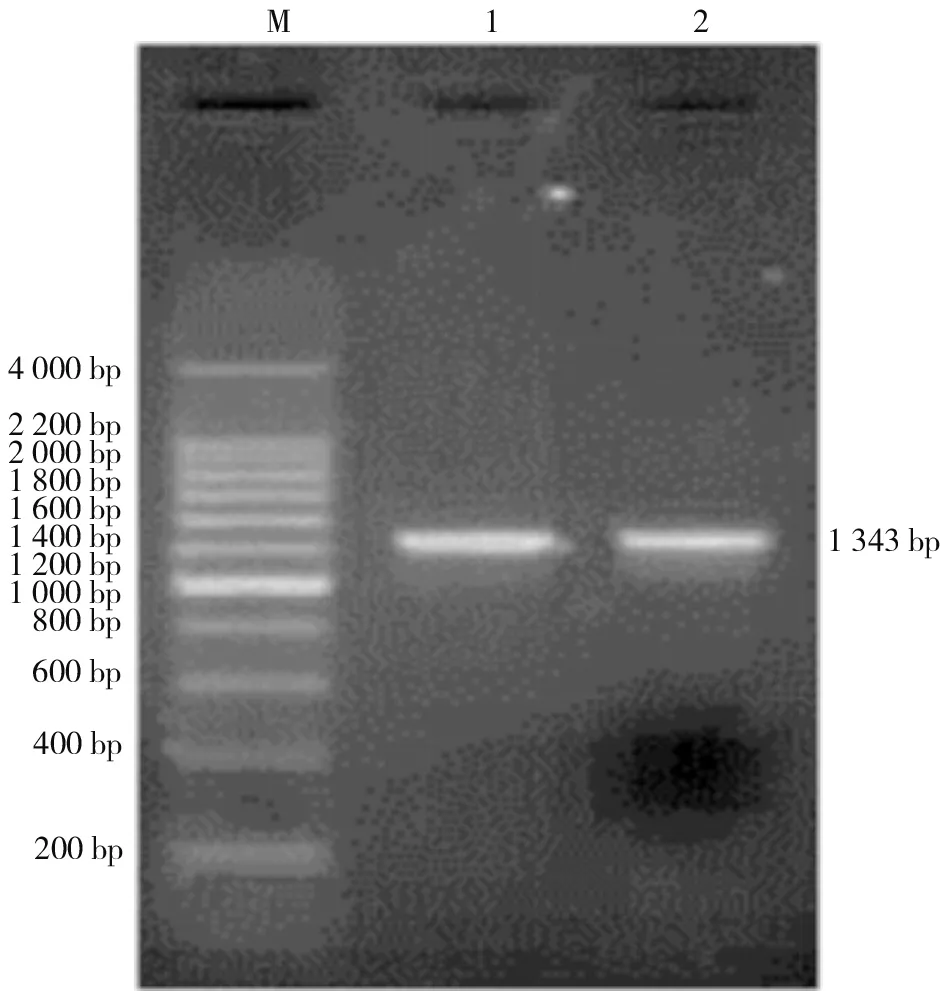
图1 CSFV E2基因RT-PCR检测结果M:200 bp Marker;1:阳性对照;2:临床病料样本
2.2 CSFVE2基因克隆与筛选由图2可见,重组质粒PCR检测显示扩增出约1 343 bp的目的基因,与预期大小相符。由图3可见,重组质粒DNA经Hind Ⅲ和BamH Ⅰ双酶切可见约2 600 bp的载体条带和1 343 bp的目的基因条带。PCR和双酶切鉴定结果均说明目的基因已成功克隆。

图2 CSFV E2重组质粒PCR鉴定M:200 bp Marker;1、2:重组质粒

图3 重组质粒双酶切鉴定M:200 bp Marker;1:空载体对照;2:PCR产物对照;3:重组质粒
2.3 CSFVE2基因序列测定与分析
2.3.1CSFVE2基因测序与变异分析:将经PCR鉴定为阳性重组质粒的E2基因克隆菌送至宝生物工程(大连)有限公司进行基因序列测定,并应用DNAStar生物软件对测得的序列与国内猪瘟经典毒株进行相应比较。结果:测序获得1 343 bp的CSFVE2基因片段,大小与预期扩增结果完全一致,命名为:CSFV贵州株GZPD。其碱基相对于shimen株发生了53个碱基突变,占总核苷酸数的3.9%(53/1 343);相对于HCLV株发生了8个碱基突变,占总核苷酸数的0.6%(8/1 343);与shimen、HCLV 2种经典毒株核苷酸序列相比较,20个碱基同时发生突变,占总核苷酸数的1.5%(20/1 343)。
2.3.2CSFVE2基因核苷酸同源性分析:将CSFV贵州株GZPDE2基因的核苷酸测序结果与国内外的CSFV-GZ-2009、C-strain、C-ZJ-2008、GPE、HCLV、HuBei、Koslov、Shimen经典毒株进行核苷酸同源性分析,结果见表2:CSFV贵州株GZPDE2基因的核苷酸与国内毒株CSFV-GZ-2009、C-ZJ-2008、HuBei等毒株E2基因之间存在较高的同源性,为94.9%~99.9%;与国外毒株GPE、Koslov的核苷酸同源性为95.1%~95.3%。
图4 猪瘟病毒贵州株GZPD与参考毒株 E2基因核苷酸序列的同源性
2.3.3CSFVE2基因进化树分析:将CSFV贵州株GZPDE2基因的核苷酸测序结果与国内外CSFV参考株E2基因进行系统进化分析,结果见图5:CSFV贵州株GZPDE2基因与参考毒株HuBei、C-ZJ-2008、C-strain、HCLV处于同一进化分支,而与shimen、CSFV-GZ-2009、Koslov、GPE处于不同进化分支。

图5 CSFV E2核苷酸分子进化树
3 结论
本试验通过对猪瘟病毒贵州株GZPD的E2基因进行序列测定,与现有疫苗株序列同源性及进化树分析,表明其E2基因存在一定变异。研究结果可为贵州猪瘟疫苗的选择及免疫防控提供参考依据。
4 讨论
近年来,各地报道猪瘟病例临床症状呈现不典型性,且现有疫苗免疫后保护率也参差不齐。岳宗吉等[12]对16个省市48个发病猪场进行调查,表明规模猪场主要发生临床症状不典型的猪瘟,发病多见于3月龄以下的仔猪,发病率和死亡率普遍较高。猪瘟在同一猪场中育肥猪和种猪发病率较低,母猪多为隐性感染,部分表现出繁殖障碍,隐性感染母猪是仔猪的重要传染源。王在时[13]对8个省19个猪场采集样品15 736份调查表明,猪瘟平均带毒率为11.58%,湖南、浙江、甘肃、新疆、湖北、山东等地带毒率颇为相似。庞金兰等[14]对贵州省黔西县猪瘟免疫抗体进行监测,结果发现免疫期最长的为5个月,最短为1个月。这些研究结果均提示可能存在猪瘟病毒变异,现有疫苗免疫效果不佳的现象。本研究结果也显示猪瘟病毒贵州流行株存在一定变异,但这是否是导致疫病发生和免疫效果差的主要原因,还需进一步研究确定。
