铜、铁席夫碱配合物的合成、晶体结构和性质
2020-01-03王会生于灵燕潘志权
王会生,张 柯,于灵燕,陈 勇,潘志权
武汉工程大学化学与环境工程学院,湖北 武汉 430205
席夫碱(Schiff base)是含亚胺或具有亚胺特性的官能团的一类化合物,通常是由醛基或者酮基基团和氨基缩合而成[1],其分子结构灵活可变,配位模式多种多样,且大多都具有抗菌[2]、抗炎[3]和抗癌[4]的生物特性,所以在配位化学领域中,由席夫碱配体合成的金属配合物在磁学[5-7]、光学[8]和生物医药[9]领域都有着广阔的前景。席夫碱配体中所包含的N、O原子可以通过其孤对电子来和金属离子形成配位键[10],且可以通过微调发生反应的条件来得到不同结构的配位化合物。在二胺与邻香兰素缩合得到的席夫碱配体中,亚胺上的N原子与烯醇化的O原子可以选择性地和不同的金属发生配位,合成的 3d、3d-3d、3d-4f、4f配合物不仅拥有多变新颖的结构,且由于亚胺键具有的刚性和较强的极性,及席夫碱类化合物具有的抑制肿瘤的生物特性还在很多研究领域显示了不同寻常的性质[11],从而在配位化学中广受欢迎。铁、铜作为过渡金属,具有较大的离子半径和与有机配体之间多样的配位模式,且是人体必要的、毒性较低的元素,被认为是可以用来承担膜运输,克服耐药性和毒性的元素[12],所以得到结构新颖的含Fe、Cu原子的席夫碱配体配合物一直是无机化学和医药学领域的一个具有挑战性的课题。如近些年来,Abu-Dief等[13]合成了多例铜(II)席夫碱配合物,并证明其具有抗菌活性和在核酸分子探针与新的疾病治疗试剂开发方面的潜在应用;2017年,刘玉婷等[14]报道了包括 Fe(II)和 Cu(II)在内的 10例3d-席夫碱配合物,并证明他们均比相应的配体拥有更高的抗菌活性,这说明了加入金属可以提高配合物的生物性能。
基于上述理由,我们合成了由邻苯二胺和邻香兰素为原料缩合而成的双臂席夫碱配体双2-羟基3-甲氧基苯甲醛缩邻苯二胺[15],并分别将其与CuCl2和FeCl3进行配位反应,各得到了单核的铜与铁的席夫碱配位化合物,并对它们进行了红外表征,研究了它们的热稳定性,为今后使用该席夫碱配体合成其他配位化合物提供了一定的参考。
1 实验部分
1.1 仪器与试剂
FA2104(型号)电子天平;IKAC-MAG HS7(型号)搅拌器;邻苯二胺(北京百灵威科技有限公司);2-羟基-3-甲氧基苯甲醛(河北百灵威超精细材料有限公司);叠氮化钠(NaN3,武汉格奥化学技术有限公司);二水合氯化铜(国药集团化学试剂有限公司);氯化铁(国药集团化学试剂有限公司);四甲基氢氧化铵五水化合物(北京百灵威科技有限公司),四甲基氢氧化铵五水化合物乙腈溶液(质量浓度为0.100 42 g/mL)(北京百灵威科技有限公司);氢氧化钠(粒)(天津福晨化学试剂有限公司);甲醇溶液(国药集团化学试剂有限公司);乙酸乙酯溶液(国药集团化学试剂有限公司)。
1.2 配体L的合成
在天平上分别称取1.080 7 g(0.01 mol)邻苯二胺和 3.807 0 g(0.025 mol)2-羟基-3-甲氧基苯甲醛于250 mL圆底烧瓶中,加入100 mL甲醇,在82℃下加热回流5 h,有大量橘黄色固体析出,冷却至室温,过滤收集沉淀,用氯仿重结晶,得产物配体L,在真空下干燥称量其质量为2.67 g,产率则为81.4%。
1.3 配合物的合成
1.3.1 配合物1的合成 在分析天平上依次称取0.035 8 g(0.2 mmol)二水合氯化铜、0.065 6 g(0.2 mmol)配体 L、0.012 8 g(0.2 mmol)叠氮化钠于25 mL烧杯中,再向其中加入DMF溶液5 mL和甲醇溶液25 mL,并用移液管移取并滴加1 mL质量浓度为0.1 g/mL(0.6 mmol)的四甲基氢氧化铵乙腈溶液,加入磁子在室温下搅拌2 h,过滤沉淀,滤液在室温下静置1月,得到深绿色针状晶体[Cu(L)(H2O)]·CH3OH。
1.3.2 配合物2的合成 在分析天平上依次称取0.035 4 g(0.22 mmol)无水三氯化铁、0.066 3 g(0.2 mmol)配体 L、0.013 3 g(0.2 mmol)叠氮化钠和0.024 0 g(0.6 mmol)粒状氢氧化钠于25 mL小烧杯中,再向其中加入20 mL乙酸乙酯溶液,加入磁子在室温下搅拌2 h,过滤沉淀,滤液在室温下静置两周,得到黑色棒状晶体[Fe(L)(N3)(H2O)]·CH3COOC2H5。
1.3 单晶结构测定
选外观完好,大小合适的晶体在SMART APEX CCD单晶衍射仪上收集数据,λ=0.710 73 nm的MoKα辐射及ω/2θ扫描方式进行,并用SAINT程序还原数据和用SADABS对数据进行经验吸收校正[16-17]。晶体结构用直接法解析[18],基于 F2对结构进行全矩阵最小二乘法精修,氢原子采用理论加氢,然后进行各向同性热参数修正。化合物1和2的晶体学数据列于表1,它们的cif格式的晶体数据已上传到剑桥晶体学数据中心(CCDC)。化合物1和2的CCDC号分别为1923093和1923094。化合物1和2的部分键长键角分别列于表2和表3。

表1 化合物1和化合物2的晶体学数据和结构精修参数表Tab.1 Crystal data and structure refinement parameters for complexes 1 and 2
2 结果与讨论
2.1 配合物的晶体结构分析
根据单晶衍射得到的化合物1和2的的晶体结构数据如表1所示,部分键长和键角分别在表2和表3中列出。

表2 化合物1的部分键长与键角Tab.2 Selected bond lengths and angles for 1
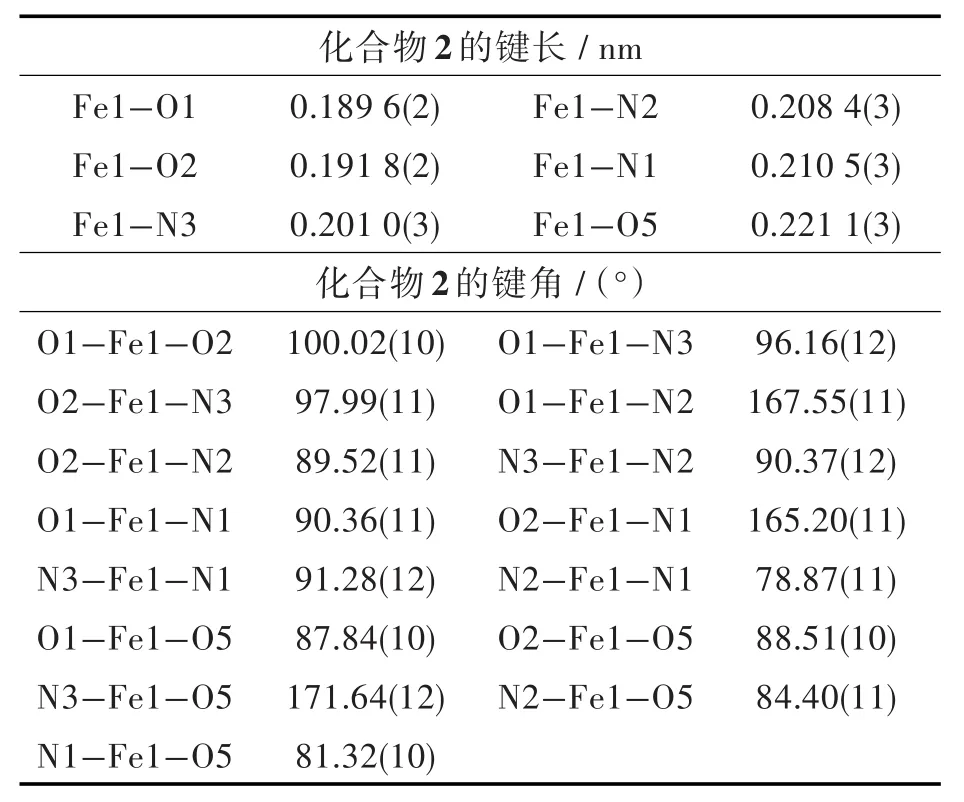
表3 化合物2的部分键长与键角Tab.3 Selected bond lengths and angles for 2
化合物1由1个电中性的[Cu(L)(H2O)]和1个甲醇溶剂分子构成,Cu(Ⅱ)离子的配位情况如图1(a)所示,该配合物属于单斜晶系P21空间群。化合物1中Cu(Ⅱ)离子与3个氧原子和2个氮原子配位,其中2个氮原子和2个氧原子来自于文中合成的双2-羟基3-甲氧基苯甲醛缩邻苯二胺配体,形成了一个近似于CuO2N2平面型结构,配体中的甲氧基上的氧原子未参与配位。配位原子与Cu2+形成四角锥构型,赤道面由 O1、O2、N1、N2原子组成,轴向位置为配位水中的氧原子(O6)。其中Cu1-O2、Cu1-O1、Cu1-N1、Cu1-N2的键长分别为 0.191 9(4)nm、0.192 4(3)nm、0.196 3(5)nm、0.196 5(4)nm,它们的键长与文献报道的相比较,均在正常的Cu-O、Cu-N键长范围内[12,19]。
化合物2由1个电中性[Fe(L)(N3)(H2O)]和1个乙酸乙酯溶剂分子构成,其中Fe(Ⅲ)离子的配位情况如图1(b)所示,它属于单斜晶系P21/c空间群。化合物2中Fe(Ⅲ)离子与3个氮原子和3个氧原子配位,其中2个氮原子和2个氧原子来自于文中合成的双2-羟基3-甲氧基苯甲醛缩邻苯二胺配体,形成了一个近似于FeN2O2平面型结构,一个氧原子来自于配位的水分子,另一个氮原子来自于参与配位的叠氮根负离子,配体中的甲氧基上的氧原子未参与配位。配位原子整体上形成一个八面体的结构,N1、N2、O1、O2组成八面体的赤道平面,轴向位置分别被配位水中的O5和叠氮根离子中的N3所占据。其中 Fe1-O1、Fe1-O2、Fe1-N3、Fe1-N2、Fe1-N1的键长分别为0.1896(2)、0.191 8(2)、0.201 0(3)、0.208 4(3)、0.210 5(3)nm,他们的键长与文献报道的相比较,均在正常的Fe-O、Fe-N键长范围内[20-21]。值得一提的是,轴向位置上的Fe1-O5键的键长为0.221 1(3)nm,比其他相关化合物的轴向位置Fe-O键稍长[22]。

图1(a)化合物1中铜原子的配位情况图(为了便于观察,甲醇溶剂分子已删除,图中灰色原子为碳原子);(b)化合物2中铁原子的配位情况图(为了观察方便,乙酸乙酯溶剂分子已删除,图中灰色原子为碳原子)
2.2 配合物的红外分析
本实验得到的化合物1和2的晶体分别用于红外光谱测试,其谱图如图2所示。
化合物1的红外光谱如图2(a)所示,主要的吸收峰有3 504(w)、3 462(m)、2 921(w)、1 640(w)、1 609(s)、735(s)。从谱图知,3 504 cm-1与 3 246 cm-1为O-H或H2O的伸缩振动吸收峰,2 921 cm-1为甲氧基中的C-H伸缩振动吸收峰,1 640 cm-1为C=N双键的伸缩振动吸收峰,1 244、1 438、1 609 cm-1为苯环的C=C双键的面内变形振动吸收峰,735 cm-1处是苯环1,2,3-三取代的弯曲振动吸收峰。
化合物2的红外光谱图如图2(b)所示,主要吸收峰有 3 387(m)、2 958(w)、2 051(s)、1 654(w)、1 600(s)、733(s)、573(m)。从谱图可知,3 387 cm-1是O-H或者H2O的伸缩振动吸收峰,2 958 cm-1为甲氧基的C-H伸缩振动吸收峰,2 051(s)是N=N双键的伸缩振动吸收峰,1 654 cm-1为C=N双键的伸缩振动吸收峰,1 244、1 438、1 600 cm-1为苯环的C=C双键的面内振动吸收峰,733 cm-1处是苯环1,2,3-三取代的弯曲振动吸收峰。
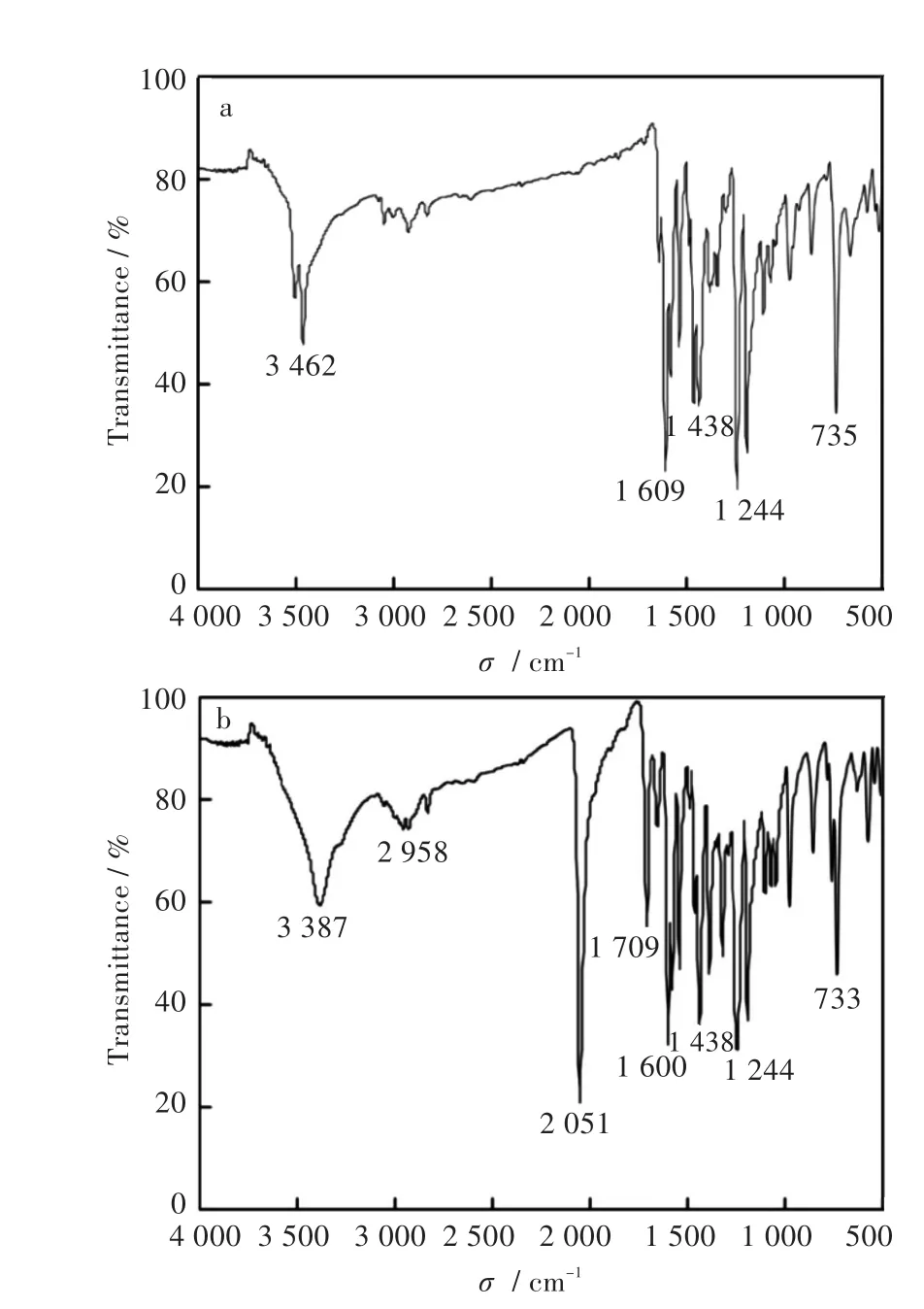
图2 红外光谱图:(a)化合物1,(b)化合物2Fig.2 Infrared spectra:(a)complex 1,(b)complex 2
2.3 配合物的热稳定性分析
在升温速度5℃/min,氮气保护下,用差热天平测得化合物1和化合物2的热稳定性在室温至700℃氛围内的热重曲线,图3是化合物1和化合物2的热重曲线图。如图所示,化合物1在温度达到150℃之前,热重曲线几乎无变化,显示化合物非常稳定,尽管含有甲醇溶剂分子。随着温度升高,温度达到350℃时,热重曲线降到94.21%,意味着甲醇溶剂分子完全失去(理论值:93.43%)。在340~380℃之间失重率为26%,可能是配合物中的配体分解所致。而化合物2的晶体在温度达到65℃之后就变得不稳定,显示其稳定性没有化合物1好。当温度升高104℃时,热重曲线下降到84.38%,意味着一个乙酸乙酯溶剂分子失去(理论值:84.77%)。当温度继续升高到285℃时,热重曲线降到74.68%(理论值:74.39%),意味着配位水分子和N3-失去;继续升高温度,配体发生分解。

图3 配合物1和配合物2的热重曲线Fig.3 TGA curves of complexes 1 and 2
3 结 语
以席夫碱配体双2-羟基-3-甲氧基苯甲醛缩邻苯二胺为配体,在室温下分别与Fe(Ⅲ)与Cu(Ⅱ)的氯化盐形成了两种新的单核配合物[Cu(L)(H2O)]·CH3OH与[Fe(L)(N3)(H2O)]·CH3COO-C2H5,并用单晶衍射仪对它们的单晶结构进行了测定,随后用红外光谱、热重进行了表征。这两个配合物的合成方法、结构与性质表征为今后使用该席夫碱合成其他配合物提供了一定的参考。
