PERK在肝癌中的表达及其对肝癌细胞侵袭和索拉菲尼抵抗的影响
2020-01-01鲁倩倩范璐璐孙国平
周 琲,鲁倩倩,范璐璐,孙国平
肝细胞癌是消化系统常见的恶性肿瘤之一,其发病率在所有肿瘤中排第六位,但在肿瘤所致死亡原因中高居第二位,肝癌患者5年生存率极低,预后相比于其他肿瘤较差[1]。肝癌细胞的高侵袭性和高频率发生的药物抵抗可能是肝细胞癌呈高度恶性的原因。基质金属蛋白酶介导的细胞外基质和基底膜降解参与肿瘤细胞侵袭的过程,肿瘤细胞借助降解的屏障发生侵袭、转移等[2]。另外,肿瘤细胞可以通过细胞内一系列适应性机制应对缺氧、药物等不良刺激减少凋亡的发生以介导化疗抵抗。因此,对肝癌细胞侵袭能力和化疗抵抗的相关机制研究将有益于提高肝细胞癌患者的预后和疗效[3]。蛋白激酶RNA样内质网激酶(protein kinase RNA-like endoplasmic reticulum kinase,PERK)是一种内质网跨膜蛋白,细胞内外各种病理因素所诱导的内质网应激可以激活PERK的表达。PERK广泛参与到肿瘤细胞凋亡和增殖、细胞存活、肿瘤微血管形成和肿瘤细胞的浸润、转移等生物事件中[4]。 因此,分析PERK在肝癌中的表达及其与肿瘤生物学特征的关系对探讨肝细胞癌恶性倾向的机制以及寻找肝癌个体化治疗的新靶点具有重要的科研和临床价值。
1 材料与方法
1.1 肝细胞癌组织标本本研究肝癌和癌旁组织标本来源于2007~2012年在安徽医科大学第一附属医院接受肝癌切除手术的患者,制备成肝癌组织切片。通过回顾病理报告和苏木精-伊红(HE)染色切片获得临床病理学信息,并同步收集患者的临床和病理参数。临床病理分期依照中国抗癌协会肝癌专业委员会2001年修订标准,肿瘤分化程度依照埃德蒙森分级法。在收集所有临床组织标本之前获得患者书面知情同意书,且本研究和临床样本数据经安徽医科大学伦理委员会批准。
1.2 肝癌细胞株人肝癌细胞株HepG2购自中国科学院上海细胞库。
1.3 主要试剂索拉菲尼(SC220125)、MMP2(SC13594)、MMP9(SC21733)抗体购自美国Santa Cruz公司;脂质体Lipofectamine® 2000购自美国Gibco公司;凋亡检测试剂盒(Annexin V-FITC/PI)购自美国BD Biosciences公司;PERK干扰同源序列购自上海吉码公司。
1.4 实验方法
1.4.1免疫组织化学染色检测PERK的表达 组织切片放入烘箱脱蜡,随后依次放入二甲苯和梯度浓度乙醇中水化;将切片置于3%过氧化氢的甲醇溶液中封闭;将切片于柠檬酸钠缓冲液中并加热10 min进行抗原修复;将PERK抗体(1 ∶100)滴加到切片组织上4 ℃潮湿环境中过夜孵育;滴加二抗孵育肝癌组织。用适量新鲜配制的DAB工作液滴加到切片组织上,染色10 min,苏木精复染1 min后冲洗切片,梯度浓度乙醇脱水、二甲苯透明、滤纸吸干后树脂封片。镜下观察染色强度并统计阳性细胞率。
1.4.2细胞培养 人肝细胞癌HepG2细胞培养于含10%FBS和1%Streptomycin-Penicillin的DMEM培养基中,将细胞孵育箱环境设定为37 ℃、5% CO2,细胞贴壁生长,待细胞汇合度达约70%~80%时,用0.25%胰蛋白酶进行消化和传代。
1.4.3细胞转染干扰RNA序列 接种HepG2细胞在6孔板中并培养至在转染当天融合度达到约50%。根据制造商的说明,使用Lipofectamine®2000,用50 nmol/L靶向PERK的小siRNA(5′-GUGGAAAGGUGAGGUAUAUTT-3′, 5′-AUAUACCUCACCUUUCCACTT-3′)或对照非特异性siRNA(5′-UUCUCCGAACGUGUCACGUTT-3′, 5′-ACGUGACACG UUCGGGAATT-3′)转染HepG2细胞。6 h后替换为有血清的新鲜培养基,总时间孵育24 h后,将siRNA/HepG2细胞用于后续实验。
1.4.4Western blot法检测MMP2和MMP9的表达 实验分为3组:对照组、si-NC转染组、si-PERK转染组。细胞在冰上裂解30 min,裂解物在4 ℃下以14 000 r/min离心10 min。将裂解物与蛋白上样缓冲液混匀加热10 min。提取的蛋白质样品在SDS-PAGE凝胶中电泳,电泳后将蛋白质电转移到0.45 mm的PVDF膜上。5%脱脂奶粉封闭膜2 h,置于MMP2抗体或MMP9抗体(1 ∶500)中4 ℃孵育过夜,辣根过氧化物酶标记的二抗(1 ∶50 000)孵育2 h。化学发光试剂使蛋白条带可视化,曝光拍照,应用ImageJ软件获得每个蛋白质条带的灰度值用于半定量分析。
1.4.5Transwell小室法检查肝癌细胞在体外的侵袭性能 实验分组同上,Matrigel基质胶冰面上液体化后,与DMEM培养基按1:3稀释后在膜下室侧涂抹。将铺基质胶的小室置于37 ℃孵育箱30 min使基质胶凝固。胰酶消化下处理过的HepG2细胞制成单细胞悬液,细胞密度用DMEM培基调至约2.5×104个/ml,下室加600 μl含10%FBS的DMEM培基,吸取200 μl细胞悬液均匀加入上室。12 h后,取出小室PBS洗涤,4%多聚甲醛溶液固定30 min。将小室置于0.1%结晶紫甲醇溶液中染色10 min,光学显微镜下(×200)计数每孔5个高倍视野下穿过基底膜的细胞数目并拍照。
1.4.6流式细胞术检测凋亡细胞比率 干扰序列转染HepG2细胞24 h后,再加索拉非尼作用24 h,实验分为4组:对照组、索拉菲尼组、索拉菲尼+si-NC转染组、索拉菲尼+si-PERK转染组。胰酶消化下贴壁细胞,1 500 r/min离心5 min,PBS洗涤细胞,400 μl结合液重悬细胞并转移至流式管内,避光环境下用5 μl AnnexinV-FITC和5 μl PI孵育15 min。上机检测获取数据,并使用CytExpert软件分析。
2 结果
2.1 免疫组织化学染色检测肝细胞癌组织中PERK的表达收集72例肝细胞癌标本并制成组织切片,免疫组化染色分析肝癌组织和癌旁组织标本中PERK的表达,结果显示,PERK在肿瘤细胞的细胞质中被染成棕色,见图1。统计结果表明,PERK在肝癌组织(38/72)中高表达,在癌旁组织(0/72)几乎无高表达。PERK高表达与肿瘤血管侵犯有关,而与性别、年龄、肝炎病史、肝硬化病史、血清AFP、肿瘤大小、临床分期、分化程度无明确关系。见表1。
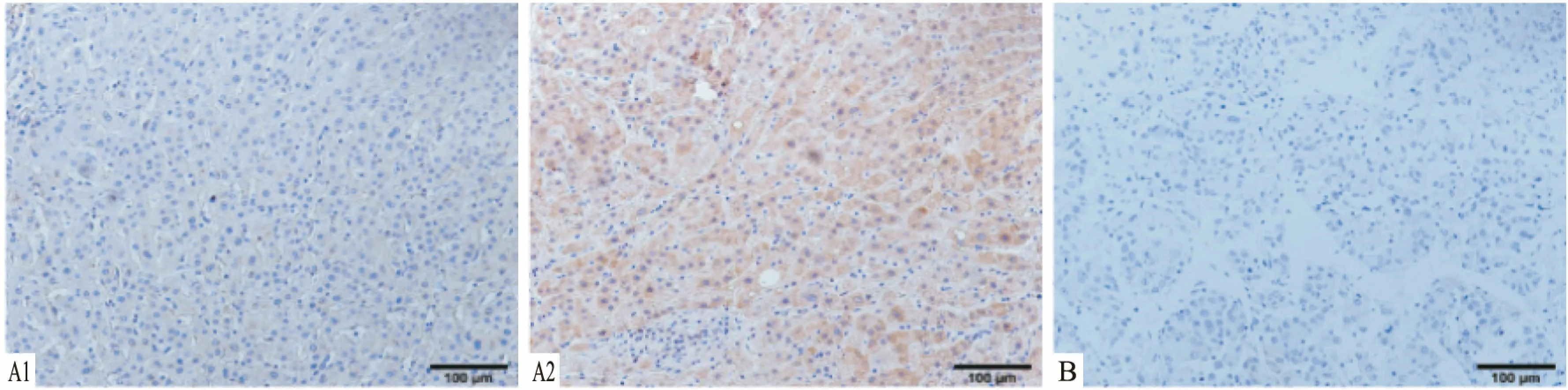
图1 免疫组化法检测PERK在肝癌和癌旁组织中的表达 ×100 A: 肝癌组织; B: 癌旁组织; 1: 低表达; 2: 高表达
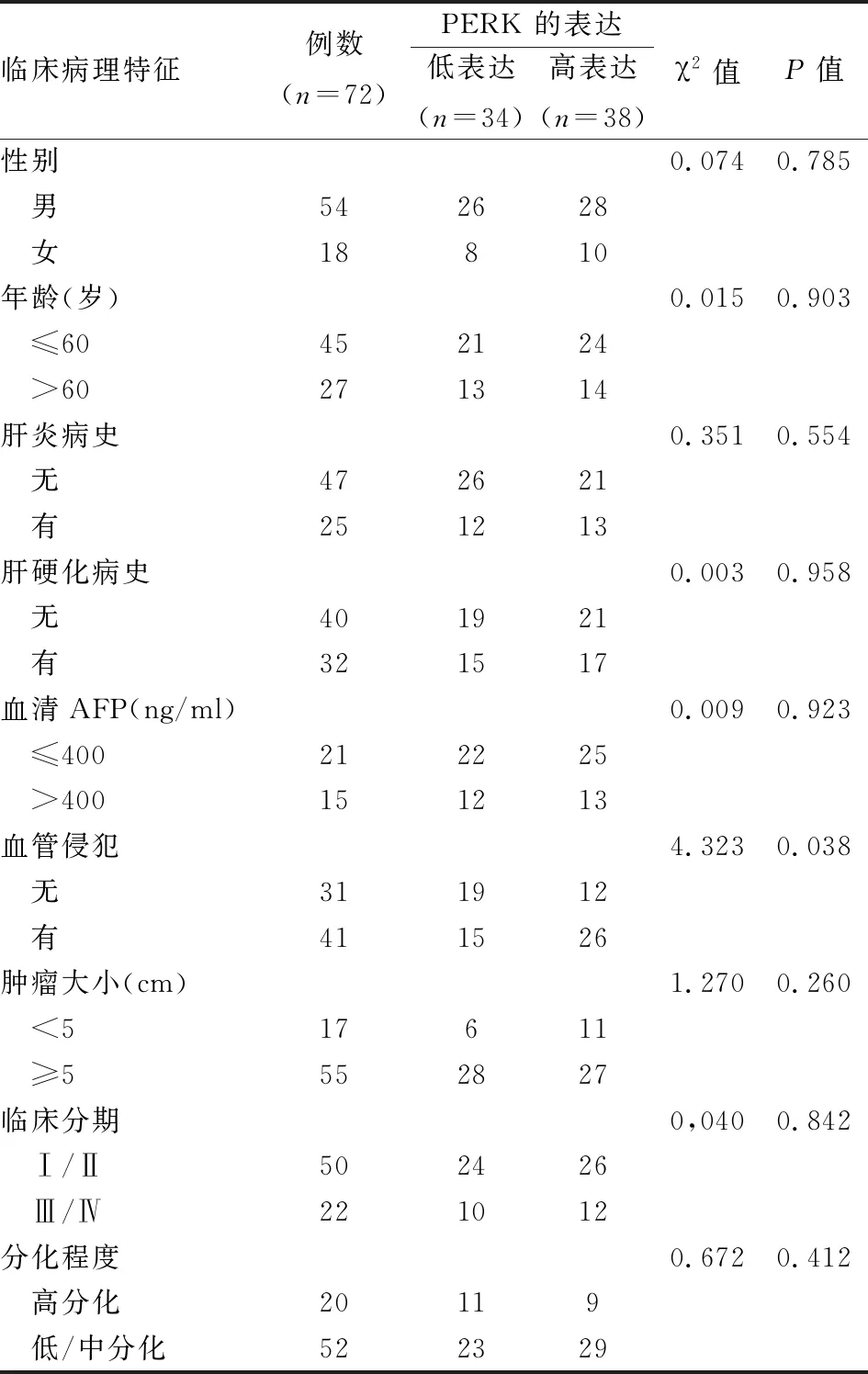
表1 PERK在肝癌组织中的表达及和临床病理特征之间的关系
2.2 Western blot检测干扰PERK的表达对HepG2细胞MMP2、MMP9的蛋白表达的影响通过siRNA沉默PERK观察MMP2和MMP9表达。Western blot结果显示,干扰序列对PERK的干扰有效可以明显抑制PERK的表达(F=48.731,P<0.01)。与对照组和si-NC转染组相比,si-PERK转染组的HepG2细胞MMP2和MMP9的蛋白表达明显降低,差异有统计学意义(F分别是23.749、38.474,P<0.01)。见图2。
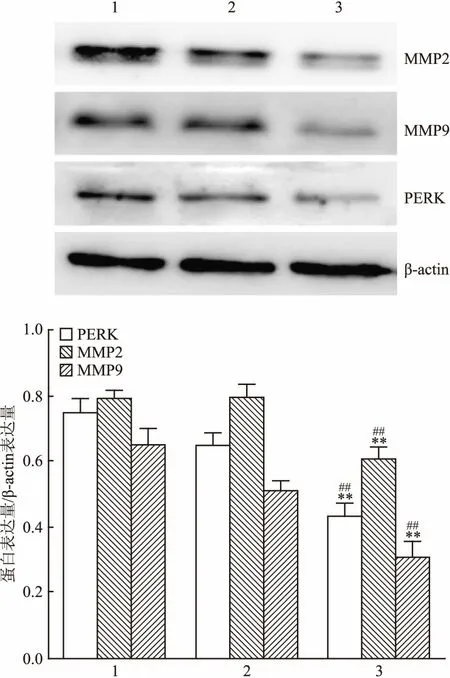
图2 PERK的干扰对PERK、MMP2、MMP9蛋白表达的影响
1:对照组;2:si-NC转染组;3: si-PERK转染组;与对照组比较:**P<0.01;与si-NC转染组比较:##P<0.01
2.3 Transwell小室体外检测PERK沉默对细胞侵袭能力的影响实验过程中在高倍镜下计数滤孔膜下室面5个视野的细胞数反应肝癌细胞的侵袭能力。对照组、si-NC转染组、si-PERK转染组穿过小室底部基质胶的细胞数目分别是(93.00±7.79)、(90.33±6.60)、(57.33±6.24)。与对照组和si-NC转染组相比,转染PERK后的HepG2细胞侵袭数目明显降低,差异有统计学意义(F=16.548,P<0.01)。见图3。
2.4 流式细胞术检测PERK影响HepG2细胞对索拉菲尼的敏感性为了明确PERK是否影响肝细胞癌对索拉菲尼的敏感性,siRNA沉默PERK的表达后,用PI/annexin V双标的凋亡试剂盒检测肝癌细胞的凋亡率。结果显示,对照组、索拉菲尼组、索拉菲尼+siNC组、索拉菲尼+siPERK组的细胞凋亡率分别是(14.16±1.26)%、(41.51±1.32)%、(57.38±2.86)%和(76.15±2.96)%。与单用索拉菲尼相比,干扰PERK表达后再用索拉菲尼可以明显增加肝癌细胞的凋亡率,差异有统计学意义(F=271.955,P<0.01)。见图4。
3 讨论
肝细胞癌是世界范围内发病率和死亡率均较高的人类恶性肿瘤之一。虽然目前有包括索拉菲尼等多种新型分子靶向药应用于进展期肝细胞癌,但由于肝癌细胞的高度侵袭性和对药物迅速产生的抵抗性等因素,肝细胞癌患者的预期后果仍然较其他类型肿瘤差[5]。因此,找寻肝癌细胞高耐药性和高侵袭性的分子机制具有重要的临床意义。
PERK是一种内质网应激传感器,在各种细胞内外应激刺激下导致内质网腔中未折叠和/或紊乱折叠的蛋白质的积聚和累积引起的内质网应激可以诱导PERK的活化。肝癌细胞长期处于缺血缺氧、炎症、病毒感染等不良刺激下,致使肝癌细胞容易发生内质网应激和PERK的激活[6]。本研究通过肝癌组织切片证实PERK在肝癌组织中高表达。
基质金属蛋白酶(MMPs)可以降解血管基底膜网状结构主要成分Ⅳ型胶原和细胞外基质的其他成分,如纤连蛋白、层黏连蛋白、蛋白聚糖、弹性蛋白等,在20多种MMPs中,MMP2和MMP9与癌症的侵袭性密切相关。高表达MMP2和MMP9的癌细胞通过分解和突破肿瘤毛细血管基底膜和细胞外基质等屏障促进肿瘤的迁移、侵袭[7]。据研究[8-9]报道,在乳腺癌中PERK的激活通过选择性增加转录因子ATF4和CREB3L1的翻译介导肿瘤血管的生成和肿瘤的转移。同时,PERK的激活是上皮-间质转化细胞发生侵袭和转移所必需的[10]。本研究表明PERK在肝癌组织中的表达和肿瘤的血管侵犯有相关性,在细胞体外水平上,PERK的沉默可以抑制使细胞外基质降解的MMP2和MMP9的表达,同时减少发生侵袭的细胞数目。这些结论表明PERK可能将作为肝癌的一种非特异性生物标志物,PERK可能通过调控MMP2和MMP9的表达促进肝癌细胞的血管侵犯和侵袭性能,这同时为肝细胞癌恶性程度的判断和预后评估提供新的思路。
图3 PERK的干扰对HepG2侵袭能力的影响×100
A:对照组;B:si-NC转染组;C: si-PERK转染组;D:每高倍镜视野下各组侵袭细胞的数目比较;与对照组比较:**P<0.01;与si-NC转染组比较:##P<0.01
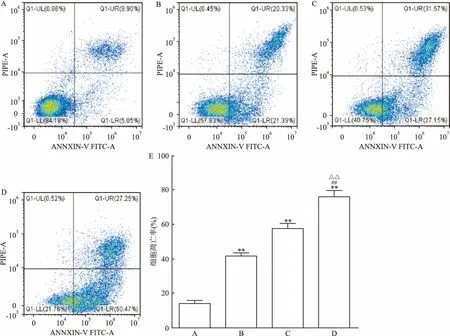
图4 PERK关于HepG2细胞对索拉菲尼敏感性的影响
A: 对照组;B:索拉菲尼组;C: 索拉菲尼+si-NC组;D:索拉菲尼+si-PERK组;E:各组细胞凋亡率比较;与对照组比较:**P<0.01;与索拉菲尼组比较:##P<0.01;与索拉菲尼+siNC组比较:△△P<0.01
索拉菲尼目前为止是FDA批准的唯一用于晚期HCC患者的用药方案,索拉菲尼通过抑制丝/苏氨酸激酶、受体酪氨酸激酶等多种激酶活性抑制肿瘤活性包括增殖、侵袭和迁移和肿瘤血管生成等。然而,仅有约30%的患者对索拉菲尼初始治疗有效,并且治疗有效的患者在短期内逐渐发生获得性耐药,索拉菲尼抵抗性是多种复杂因素介导的,包括EGFR、c-Jun、AKT等蛋白的激活、自噬、缺氧环境、上皮间质转化、肿瘤干细胞、内质网应激等[11]。课题组之前的研究[12]表明内质网应激使癌细胞在不利的肿瘤微环境下存活,同时有研究[13-15]表明PERK可以磷酸化eIF2α、Nrf2、FOXO和脂质二酰基甘油介导蛋白质翻译促进细胞存活。本研究结果表明,PERK的抑制可以促进索拉非尼诱导的肝癌细胞凋亡,这可能是由于索拉菲尼在诱导肝癌细胞发生死亡的同时激活肝癌细胞的内质网应激,细胞器或蛋白质受损的肝癌细胞通过由内质网应激的PERK信号通路使eIF2α发生磷酸化减少未折叠蛋白的累积与聚集和促进发生错误折叠蛋白的降解,从而产生使受损细胞存活的适应性反应。
