硅铝比对催化剂Pd/ZSM-5性能的影响及其应用于氢氧直接合成过氧化氢
2020-01-01刘鹏何舜肖升林倩潘红艳
刘鹏,何舜,肖升,林倩,潘红艳
(1.贵州大学 化学与化工学院,贵州 贵阳 550025;2.贵州省绿色化工与清洁能源技术重点实验室,贵州 贵阳 550025)
在环境保护与污水处理等领域,过氧化氢(H2O2)被广泛应用[1-2]。目前,蒽醌法生产H2O2不仅费用高而且污染环境[3-4]。而直接合成H2O2过程简单和环境友好,有望替代蒽醌法合成H2O2[5-6]。
当前Pd基催化剂被公认为催化效果最好[7-8]。研究表明,影响H2O2活性的主要因素为载体表面酸性和活性组分Pd尺寸[9-13]。ZSM-5因其比表面积大和孔径分布均匀,故被广泛的作为催化剂载体[14]。
因此,本文以ZSM-5为载体制备催化剂Pd/ZSM-5,借助NH3-TPD、XRD、CO脉冲、N2吸附/脱附等温吸附线表征手段分析催化剂的性质。讨论催化剂Pd/ZSM-5表面酸性和活性组分Pd尺寸对直接合成H2O2的影响。
1 实验部分
1.1 材料与仪器
ZSM-5分子筛、氯化钯(PdCl2,99%)、甲醇(CH3OH,99.5%)、浓硫酸(98%)、硫代硫酸钠(99%)、H2O2溶液(30%)均为分析纯;实验用水均为去离子水。
202-2AB恒温干燥箱;D08-4F流量显示器;ES-500E电子天平;SK8200HP超声波清洗器;KSS-1 400 ℃梯度炉;GC-9560气相色谱仪;D07-7B质量流量器;活性评价装置,自制;D5000型X射线衍射仪;Micro-meritic Auto Chem Ⅱ2920化学吸附仪;ASAP2020型物理吸附仪。
1.2 催化剂的制备
将硅铝比分别为25,50和100的ZSM-5研磨、筛分和选取40~80目的粉末于100 ℃下烘箱中12 h备用。准确称取3 g 的ZSM-5粉末加入到PdCl2溶液中,然后搅拌、静置12 h、120 ℃干燥12 h和500 ℃空气中焙烧3 h,最终制备的催化剂记为Pd/ZSM-5(X),X=25,50和100。Pd负载量为3.5%(质量分数)。
1.3 催化剂表征
通过X射线衍射仪检测催化剂中物质的晶相,采用铜靶Kα光源(λ=0.154 32 nm),石墨单色器,管电压为30 kV,管电流为30 mA。扫描速度为 8(°)/min。
通过化学吸附仪表征催化剂的表面酸强度和酸量。在高纯He气流下,以10 ℃/min的升温速率从室温升温至550 ℃,吹扫1 h后降温至100 ℃,然后将气流切换为NH3-He(10%)吸附0.5 h,并将气流切换为高纯He,吹扫2 h,最后在该温度下以15 ℃/min的升温速率升温至550 ℃进行脱附。
通过采用化学吸附仪表征催化剂金属分散度。在H2气流下,以10 ℃/min的升温速率从常温升温至350 ℃,停留3 h,然后切换气流为He,保留时间为0.5 h,最后以20 ℃/min降温速率降至35 ℃进行CO吸附。
通过物理吸附仪测定催化剂的比表面积及孔道结构,在77 K液氮条件下测定催化剂的N2吸附等温线。测试前将催化剂在150 ℃条件下抽真空处理3 h。催化剂的比表面积利用BET方程计算,全孔孔径分布采用DFT理论计算,在P/P0=0.995时计算样品的总孔容。
1.4 催化剂活性测试
图1为直接合成H2O2的实验装置图,通过质量流量计控制反应气体H2(5 mL/min)和O2(5 mL/min)与载气N2(20 mL/min)的进气流量,使用气相色谱仪定量分析测得反应结束后尾气中H2的含量。催化剂用量为0.65 g,反应条件为0 ℃和0.1 MPa,反应介质为80 mL甲醇和1 mL浓硫酸的混合溶液。使用碘量滴定法测定1 h生成的H2O2浓度。

图1 H2O2活性评价装置图Fig.1 The test equipment chart of hydrogen peroxide
1.氧气钢瓶;2.氢气钢瓶;3.氮气钢瓶;4.气体减压阀;5.质量流量控制器;6.流量显示仪;7.半间歇式夹套三相反应器;8.CC-9560气相色谱仪;9.计算机;10.低温恒温循环槽
H2O2分解实验在相同的反应器和反应条件中进行。0.65 g催化剂、80 mL甲醇(99.5%)、0.9 mL浓H2SO4(98%)和150 μL H2O2(30%)。N2流速为20 mL/min,H2O2的浓度用碘量滴定法测定。
催化剂的性能指标为H2转化率(%)、H2O2的选择性(%)、收率(%)和产率mmol/(gPd·h),分别按以下公式计算:

(1)

(2)

(3)

2 结果与讨论
2.1 XRD分析
图2是催化剂Pd/ZSM-5(25)、Pd/ZSM-5(50)和Pd/ZSM-5(100)的XRD图。

图2 催化剂Pd/ZSM-5(X)的XRD谱图
由图2可知,3种催化剂均在2θ为7.9,8.8,23.1,23.9°出现ZSM-5的特征衍射峰;在2θ为29.3,33.5,45.1°出现PdO的特征衍射峰,并未存在金属Pd的特征衍射峰,说明催化剂Pd/ ZSM-5中活性组分以PdO形式存在。
2.2 NH3-TPD分析
图3是催化剂Pd/ZSM-5(25)、Pd/ZSM-5 (50)和Pd/ZSM-5 (100)的NH3-TPD谱图。

图3 催化剂Pd/ZSM-5(X)的NH3-TPD图谱
由图3可知,各催化剂在50~300 ℃均存在较大面积的弱酸位脱附峰;在450~550 ℃均有较少面积的强酸位脱附峰。值得注意的是,当硅铝比(Si/Al)为25时,催化剂Pd/ZSM-5(25)在300~450 ℃有较小面积的中强酸位脱附峰。
由各催化剂中弱酸位脱附峰面积可得,随着ZSM-5分子筛的硅铝比(Si/Al)增加,催化剂Pd/ZSM-5(X)弱酸位脱附峰面积逐渐降低,其大小顺序为:Pd/ZSM-5(25)>Pd/ZSM-5 (50)>Pd/ZSM-5(100)。这表明峰面积越大,催化剂表面的弱酸量相应越大,因此催化剂Pd/ZSM-5(25)表面有最大的弱酸量,而催化剂Pd/ZSM-5 (100)表面的弱酸量最小。
2.3 N2吸附/脱附分析
图4为催化剂Pd/ZSM-5(25)、Pd/ZSM-5(50)、Pd/ZSM-5(100)的N2吸附/脱附等温线(a)和对应的DFT孔径分布(b)。
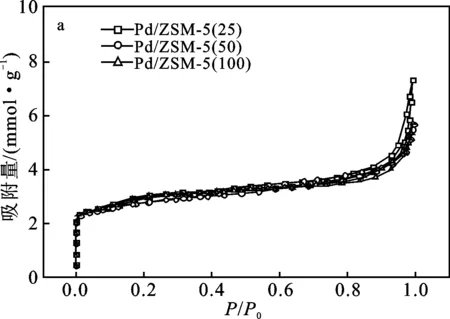

图4 催化剂Pd/ZSM-5(X)的N2吸附/脱附 等温线和对应的DFT孔径分布图
由图4a可知,3种催化剂均属于典型Ⅰ型等温吸附线,在较低相对压力(P/P0<0.01),有大量的N2吸附发生,表明各催化剂皆含有大量的微孔。随着相对压力(P/P0)的逐渐增大,均出现了不同程度的滞后回线,说明各催化剂均存在介孔。由图4b孔径分布也进一步说明了催化剂的孔径主要分布在1~4 nm,大于4 nm也有一定量的分布,与图4a结论一致。
由表1催化剂Pd/ZSM(X)的BET比表面积和孔结构数据可知,各催化剂Pd/ZSM-5(X)的比表面积基本一致,平均孔径均在4.0 nm左右。结果也进一步说明不同硅铝比的催化剂Pd/ZSM-5(X)的BET比表面积和总孔容与硅铝比的增加无相关性。

表1 催化剂Pd/ZSM-5(X)的比表面积和孔结构参数Table 1 Specific surface area,pore volume, and pore diameter data of Pd/ZSM-5(X)
2.4 CO脉冲吸附分析
表2为催化剂Pd/ZSM-5(25)、Pd/ZSM-5 (50)和Pd/ZSM-5 (100)的CO-脉冲数据。
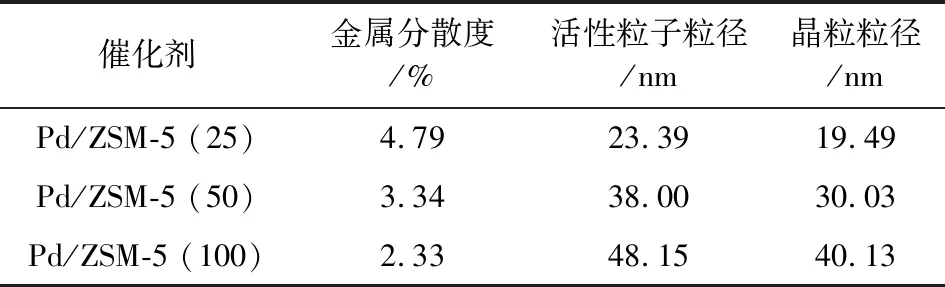
表2 催化剂Pd/ZSM-5(X)的CO脉冲数据Table 2 CO pulse of the Pd/ZSM-5(X)
由表2可知,硅铝比不仅影响了金属的分散度,而且影响了活性组分Pd尺寸。催化剂Pd/ZSM-5(X)中金属的分散度随硅铝比的增加而降低,催化剂Pd/ZSM-5(X)中活性组分尺寸随硅铝比的增加而增大。当硅铝比为25时,催化剂Pd/ZSM-5(25)的活性组分分散度最大,为4.79%,活性粒子尺寸最小,为23.39 nm,这是因为催化剂Pd/ZSM-5(25)载体表面的弱酸量最大,能够提高活性组分的分散度[15-16],因此催化剂Pd/ZSM-5(25)的活性组分分散度最大和尺寸最小。
2.5 活性评价
图5是催化剂Pd/ZSM-5(25)、Pd/ZSM-5 (50)和Pd/ZSM-5 (100)直接合成H2O2的催化活性。




图5 催化剂Pd/ZSM-5(X)的催化活性Fig.5 Activity test results of the catalysts Pd/ZSM-5(X) a.H2转化率;b.H2O2选择性;c.H2O2收率;d.H2O2产率
由图5可知,催化剂Pd/ZSM-5(X)的H2转化率、H2O2选择性、H2O2收率、H2O2产率随硅铝比的增加而逐渐降低,其大小顺序为:Pd/ZSM-5(25)>Pd/ZSM-5(50)>Pd/ZSM-5(100)。当硅铝比为25时,催化剂Pd/ZSM-5(25)合成H2O2的活性最高,H2转化率、H2O2选择性、H2O2收率、H2O2产率分别为64.2%,90.01%,57.6%,270.2 mmol/(gPd·h),与硅铝比为100的催化剂Pd/ZSM-5(100)相比,H2转化率、H2O2选择性、H2O2收率、H2O2产率分别提高了12%,72%,94%,39%。这是因为催化剂Pd/ZSM-5(25)中有较小的晶体尺寸和较大的表面弱酸量。活性组分Pd粒子尺寸越小,能为反应物(H2和O2)吸附和反应提供较多的活性位点,因此H2和O2的反应速率也就越大;此外,催化剂Pd/ZSM-5(25)载体表面弱酸量较大,能够提供较多的H+,使得产物H2O2质子化,从而抑制了H2O2分解和提高H2O2稳定性,因此催化剂Pd/ZSM-5(25)合成H2O2活性最高。值得注意的是,催化剂Pd/ZSM-5(X)的催化活性随着反应时间从1 h增加到4 h而降低,这是由于反应生成的H2O2会在活性组分Pd表面发生氢化反应(H2O2+H2→2H2O)和分解反应(H2O2→H2O+1/2O2),因此降低了催化剂的活性。
为了进一步论证催化剂Pd/ZSM-5(X)表面弱酸量越大,越有利于H2O2稳定性,做了H2O2的分解实验,结果见图6。

图6 催化剂Pd/ZSM-5(X)催化过氧化氢分解图
由图6可知,随着硅铝比的增加,H2O2的分解速率逐渐增加,催化剂Pd/ZSM-5(25)催化H2O2分解的速率最慢,而催化剂Pd/ZSM-5(100)催化H2O2分解的速率最快,这是由于弱酸量越大,能够提供较多的H+使得产物H2O2质子化,因此抑制了副反应H2O2→H2O+1/2O2的发生,从而提高了H2O2稳定性。
3 结论
通过浸渍法制备了硅铝比不同的催化剂Pd/ZSM-5,并借助NH3-TPD、XRD、CO脉冲和N2吸附/脱附吸附等温线表征手段分析催化剂性质。讨论催化剂Pd/ZSM-5的表面酸性及活性组分尺寸对直接合成H2O2的影响。结果表明,随着硅铝比(Si/Al)的增加,催化剂表面弱酸量随硅铝比的增加而减小,活性组分Pd的颗粒尺寸随硅铝比的增加而增大,H2O2的选择性和产率随硅铝比的增加而降低。当硅铝比为25时,催化剂Pd/ZSM-5(25)表面弱酸量较大和活性组分Pd粒子尺寸较小,H2O2的选择性和产率最高,分别为90.01%和270.2 mmol/(gPd·h)。这是由于催化剂表面弱酸量越大,产物H2O2分解速率较低,H2O2越稳定;活性组分Pd粒子尺寸越小,提供的活性位点较多,因此导致反应物(H2和O2)在单位时间单位催化剂上合成的H2O2较多,这两方面的原因共同提高了H2O2的选择性和产率。
