对凝聚胺法与微柱凝胶法两种交叉配血方法阳性结果的研究分析
2020-01-01金勇李继东余小平
金勇,李继东,余小平
东台市人民医院输血科,江苏东台 224200
常用的交叉配血有盐水介质法、 抗人球蛋白法、微柱凝胶法及木瓜蛋白酶法等[1]。 以往交叉配血多采用盐水介质法,但随着医疗技术的不断发展,交叉配血方法也得到了不断改进与更新,近年来,应用比较广泛的交叉配血方法为凝聚胺法和微柱凝胶法[2]。 为对比两种交叉配血的阳性结果, 该院选取了自2016年1 月—2019 年1 月申请输血患者108 例作为研究对象作交叉配血阳性结果的研究,现报道如下。
1 资料与方法
1.1 一般资料
选取该院申请输血患者108 例作为研究样本,分别采用凝聚胺法和微柱凝胶法交叉配血。 108 例患者中,男55 例,女53 例;年龄20~72 岁,平均年龄(50.4±9.2)岁。患者选取标准:年龄在20~89 岁;所有供血者均来自无偿献血者; 所有患者及家属对该次研究内容均知情,且经该院伦理委员会批准。
1.2 配血方法
1.2.1 试剂与器械 凝聚胺试剂由珠海贝索生物提供;ABO、RhD 血型定型检测卡、 不完全抗体检测卡、ABO 反定型红细胞、筛选细胞由长春博迅提供; BASO2005-1 型离心机由台湾贝索提供,TD-3A 型血型血清学离心机和TYQ 型免疫微柱孵育器由长春博研提供。
1.2.2 微柱凝胶交叉配血法 将受血者的血浆与献血者的红细胞加入主侧孔、次侧孔中加入受血者红细胞和献血者血浆,血浆为50 μL,红细胞悬液50 μL,浓度为1%。 随后将试验卡放入到已设置好37℃恒温的TYQ 型免疫微柱孵育器中, 孵育15 min 后, 放置在TD-3A 型血型血清学专用离心机,以900 rpm 的速度离心2 min,再以1 500 rpm 的速度离心3 min,观察结果,当红细胞全部留在凝胶上层,或少量滞留于凝胶柱介质中,表示配血不相合;当红细胞全部沉积于微柱底部,且上清无溶血现象,则表示配血相合[3]。
1.2.3 凝聚胺法交叉配血法 将受血者血浆与献血者红细胞悬液放入主侧管中、次侧管中加入受血者红细胞和献血者血浆,主侧管和次侧管中血浆和红细胞悬液分别为2 滴和1 滴,红细胞悬液的浓度为3%~5%[4]。随后在主侧管和次侧管中分别加入0.65 mL 低离子介质液,让其与管内血浆和红细胞混合均匀,放置1 min 后,在主侧管和次侧管内分别放入2 滴聚凝胺液,混匀后放置于BASO2005-1 型离心机上,以3500r/min的速度离心10 s,倒掉上清液,留取管底约0.1 mL 液体,轻轻摇动试管,目测红细胞有无凝集,如无,则必须重做;然后滴入2 滴复悬液(Resuspending)轻摇动试管观察结果,如在60 s 内凝集散开,代表配血结果相合;如凝集不散开,表示配血结果不相合,有疑问时,应倒在玻片上用显微镜进一步观察。
1.3 指标观察
对两组交叉配血结果进行记录,分析后进行比较。
1.4 统计方法
所有数据均采用SPSS 19.00 统计学软件进行分析,计量资料采用均数±标准差(±s)表示,采用t检验,计数资料采用率(%)表示,采用χ2检验,P<0.05 为差异有显计学意义。
2 结果
2.1 两种配血方法的交叉配血结果
凝聚胺法检测出7 例阳性样本,2 例主侧凝聚,4例次侧凝聚,1 例假阳性,微柱凝胶法检测出13 例阳性样本,4 例主侧凝聚,6 例次侧凝聚,3 例假阳性。 组间差异有统计学意义(P<0.05), 见表1。

表1 凝聚胺法与微柱凝胶法的交叉配血结果比较
2.2 两种配血方法的阳性检出率
凝聚胺法的总阳性检出率为6.48%,明显低于微柱凝胶法的12.04%, 组间差异有统计学意义 (P<0.05),见表2 。

表2 两种交叉配血阳性检出率比较(%)
2.3 两种方法的交叉配血相合率
凝聚胺法假阳性1 例标本抗凝不充分,未洗涤红细胞引起,2 例主侧凝集由于自身抗体影响,4 例次侧凝集有1 例为药物影响,另外3 例球蛋白增高引起的鍲钱状凝集;微柱凝胶法假阳性3 例均为异常白细胞增高引起,4 例主侧凝集2 例由于自身抗体,2 例由于不规则抗体引起;6 例次侧凝集5 例由于药物影响了患者红细胞引起直抗阳性,1 例由于献血者血液不规则抗体阳性所致,差异有统计学意义(χ2=11.071,P<0.05)。 见表3。
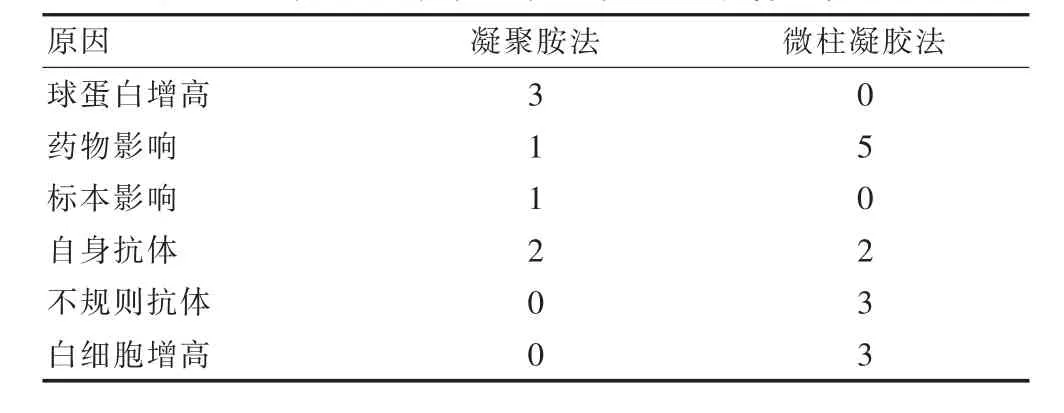
表3 凝胶胺法和微柱凝胶法的配血不相合因素分析
2.4 两种方法的检测时间
凝聚胺法的平均检测时间为(11.5±2.3)min,微柱凝胶法的平均检测时间为(29.6±3.6)min,差异有统计学意义(t=9.271,P<0.05)。
3 讨论
凝聚胺法通过凝聚胺能改变红细胞周围电荷、缩短红细胞间距的特点,引起红细胞可逆性的非特异性聚集(即加入重悬液后,通过振摇而聚集散开)以及可能的IgM/ IgG 类抗体直接凝集红细胞引起的聚集不能可逆,而被检测出来[5]。凝聚胺法试剂具有较为稳定的特点,凝聚胺法操作过程简单,可重复性操作,整个操作过程无需增加其他额外设备,所以非常符合急诊配血的时间要求。 微柱凝胶法将凝胶过滤技术(有效调节凝胶间隙[6])与抗原抗体反应相结合,敏感、方便、易观察,虽敏感性优于凝聚胺法,但微柱凝胶法在操作过程中需借助TYQ 型免疫微柱孵育器和TD-3A型血型血清学离心机, 且配血时间较长, 一般需要20~30 min, 所以微柱凝胶法不适合与有时间要求的急诊配血工作。 微柱凝胶法对标本用量要求较少,所以适应于标本的批量配血操作,在减少人工成本的同时,减低了人工操作误差发生率[7]。
凝聚胺法产生假阳性可能由于血小板出现聚集导致,所以需更换血清配血,且必须采用足够的离心速度和时间来离心, 另外采集的标本存在抗凝不佳、纤维蛋白原增高等情况都是影响凝聚胺法产生假阳性的重要因素。微柱凝胶法产生标本假阳性可能是由于血浆比例与血球比例存在不适合情况,使红细胞悬液浓度发生变化导致,红细胞悬液最适合的浓度应为1%[8],同时,采血时存在抗凝情况不佳、白细胞计数过高及血液中存在高球蛋白或异常血清蛋白,也是引发微柱凝胶法出现假阳性的影响因素[9]。 该次研究中凝聚胺法1 例假阳性是由于标本抗凝不佳,操作者未注意观察导致;微柱凝胶法3 例假阳性则由于是患者异常白血病细胞过高导致;主侧凝集的主要因素排除血型鉴定错误外,主要有:自身抗体,冷凝集,不规则抗体,以及药物的影响,其是对微柱凝胶法的影响更大;次侧凝集的影响因素,排除血型错误外,主要影响因素是患者的用药尤其是头孢类药物的应用,冷凝集以及球蛋白增高引起的鍲钱状凝集。 该次研究显示,凝聚胺法主侧凝集2 例均为自身抗体导致,而微柱凝胶法则还有2 例为不规则抗体引起;次侧凝集中,凝聚胺的4 例阳性,有1 例为药物影响,另外3 例鍲钱状凝集,6 例微柱凝胶法次侧凝集,5 例为药物影响,1例为献血者不规则抗体阳性。凝聚胺法与微柱凝胶法两者存在各自的优缺点。 使用微柱凝胶卡时,为防止运输及挥发形成凝胶附于微柱,出现交叉污染而影响结果,应先进行离心[10]。 应用凝聚胺法时,需有效把握离心时间、掌握振摇方法,完成配血后,需放在显微镜下查看凝聚状态,是否存在弱凝聚或假凝聚。 凝聚胺法与微柱凝胶法两法联合应用能将不规则抗体检测出来,防止可能的输血反应发生。 因为输入不相容的血液,可能会发生溶血反应,反应导致红细胞膜遭破坏,导致血红蛋白渗出红细胞。 虽然溶血反应发生率较低,但一经发生就严重威胁患者生命,所以一定要慎重。
该次研究显示,从凝聚胺法与微柱凝胶法的交叉配血阳性结果看, 凝聚胺法检测出7 例阳性样本,主侧凝聚、次侧凝聚、假阳性分别为2 例、4 例、1 例,明显低于微柱凝胶法,差异有统计学意义(P<0.05)。 从两组交叉配血方法的阳性检出率看,凝聚胺法的总阳性检出率为6.48%,明显低于微柱凝胶法的12.04%,差异有统计学意义(P<0.05)。 从凝聚胺法与微柱凝胶法的交叉配血相合程度看,凝聚胺法交叉配血相合数为101 例,相合率为93.52%,明显高于微柱凝胶法;凝聚胺法交叉配血不相合数为7 例, 不相合率为6.48%, 明显低于为微柱凝胶法, 差异有统计学意义(P<0.05)。 从检测时间看,凝聚胺法的平均检测时间明显低于微柱凝胶法。 这与丰强[11]的研究结果“选取自2016 年3 月—2017 年3 月的输血患者作为研究样本, 分别采用凝聚胺法和微柱凝胶法进行交叉配血。 微柱凝胶法的阳性标本检出率(90.00%)均高于凝聚胺法(50.00%),差异有统计学意义(t=64.34,P=0.00)凝聚胺法的标本阳性检出率,低于微柱凝胶法”相一致。
综上所述,凝聚胺法配血速度快,但检出率低于微柱凝胶法,有漏检可能,故该配血方法建议应用于急诊配血;微柱凝胶法配血时间较长,阳性检出率较高,具有较高的敏感性,因此适应于无时间要求的配血工作。
