基于GC-MS 的2 型糖尿病血浆代谢组学研究
2020-01-01王佳娜
王佳娜 薛 傲 张 悦 王 岩 姚 远 张 宁 刘 斌
1.黑龙江中医药大学佳木斯学院,黑龙江佳木斯 154007;2.黑龙江中医药大学药学院,黑龙江哈尔滨 150040
2 型糖尿病(T2DM)是一种常见的内分泌类代谢性病症,主要临床特征为慢性高血糖、胰岛素分泌不足等,其通常表现为整体性的代谢紊乱[1-2]。继发于糖尿病的心血管疾病是最严重的并发症之一[3],现有研究普遍认为T2DM 是多种危险因素共同作用形成的。代谢组学[4-6]是通过对生物体内所有的代谢物进行定量分析,来寻找代谢物与生理病理变化的相对关系一门学科。气相色谱-质谱联用(GC-MS)[7-10]是目前研究中最常用的一种代谢组学研究技术,是集色谱法的高分离能力和质谱法的结构鉴定准确能力于一体的分析方法,可检测大量小分子代谢物,并具有受机体效应影响小的特点,为代谢组学在复杂化合物研究提供了一种高效的定性和定量工具。
1 对象与方法
1.1 仪器
6890N-5975B 气质联用仪(美国安捷伦公司);DB-5MS 柱(30 m×0.25 mm,0.25 μm);十万分之一天平(德国赛多利斯公司);KQ5200 超声波清洗器(昆山市超声仪器有限公司);涡旋混合器(金坛市医疗仪器厂);TGL-16G-C 高速台式冷冻离心机(离心机半径5.9 cm,上海安亭科学仪器厂);DZF-6020 真空干燥箱(上海齐欣科学仪器有限公司);Thermo Scientific Forma 702 超低温冰箱(Thermo);HGC-12A 氮吹仪(天津恒奥科技发展有限公司)。
1.2 试剂
乙腈(Honeywell Burdick &Jackson,DF658);吡啶(天津市科密欧化学试剂有限公司,20120206);甲氧胺盐酸盐(LR10O40)、N-甲基-三甲基硅烷基-三氟乙酰胺(MSTFA,LS70O107)购于北京百灵威科技有限公司;三甲基一氯硅烷(TMCS,ACROS ORGANICS,A0330141);二十二烷(东京化工业株式会社,F14S034);氦气纯度为99.999%(哈尔滨卿华工业气体有限公司)。
1.3 样品
实验中所使用的人体血浆样本均取得本人同意后,清晨(即空腹8 h 以上)采集肘部静脉血,样本均由黑龙江省佳木斯市中心医院肾内科于2018 年6—7 月收集,健康组(60 名)为正常人血浆样本,T2DM组(100 例)为T2DM 患者血浆样本。
2 方法与结果
2.1 供试品溶液的制备
二十二烷正庚烷溶液(内标准液):取0.005 g 二十二烷,置入50 mL 容量瓶中,用正庚烷定容至刻度,摇匀,备用;甲氧胺吡啶溶液:称取0.15 g 甲氧胺盐酸盐,置入10 mL 容量瓶中,用吡啶溶液定容至刻度,摇匀,备用;硅烷化衍生化试剂:分别取MSTFA 溶液10 mL,TMCS 溶液100 μL 混合均匀,备用。
样品在4℃冰水上解冻30~60 min,取100 μL 样品至离心管中,加入400 μL 萃取溶剂涡旋混合15 s,-20℃下放置10 min,在4℃、10 000 r/min 离心10 min,取400 μL 上清液转移至2 mL 离心管内,氮吹后,将其加入100 μL 甲氧胺吡啶溶液,加入100 μL 衍生化试剂,并加入100 μL 内标准液,常温3000 r/min 离心10 min,取上清液至离心管中,待GC-MS 分析。
2.2 GC-MS 条件
色谱柱DB-5MS 柱;进样口温度270℃;分流比10∶1;流速:1.0 mL/min;载气:He(99.999%);进样量1 μL;溶剂延迟3 min。采用正离子模式,四级杆温度为150℃;电离方式:EI;离子源温度:230℃;电子能量70 eV;质量范围m/z 30~600;扫描间隔0.2 s;电子倍增电压0.9 kV。升温 程序:0~3 min,90~220℃;3~32.5 min,220~280℃;后运行温度280℃;后运行时间5 min。
2.3 统计学方法
采用SPSS 18.0 统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,两组间比较采用t 检验。以P <0.05 为差异有统计学意义。
2.4 精密度
取同一供试品溶液,连续进样6 次,色谱峰个数和主要共有峰相对面积的RSD 均小于5%,提示仪器精密度良好。
2.5 重现性
取样品平行制备6 份供试品溶液,比较色谱峰个数及主要共有色谱峰的相对峰面积,得RSD 值均小于5%,提示供试品溶液制备方法重复性良好。
2.6 稳定性
2.6.1 日内稳定性 样品按“2.1”项下方法处理后放置于4℃冰箱内,在0、2、4、6、8、10 h 分别进样,比较6 次进样后色谱峰的个数和主要共有峰的相对峰面积,得RSD 值均小于5%,提示供试品稳定性良好。
2.6.2 冻融稳定性 -80℃冷冻样品融化后,取400 μL至离心管后,立即将样品放回-80℃冰箱中,至完全冷冻后再取出,融化,取100 μL 至离心管中,按上述方法重复4 次后,制备所有取出样品,按“2.1”项下方法制备,分别比较样品峰的个数和共有峰相对峰面积,得RSD 值均小于5%,说明样品具有很好的稳定性。
2.7 血浆样品代谢谱建立
按“2.1”项下分析得到健康组和T2DM 组的血浆样品GC-MS 图,见图1。由于实验样本较多,为减少实验样本批次之间保留时间的漂移、色谱图背景不一致等影响,采用自动质谱去卷积鉴定系统、NIST05a质谱库、MZ-mine 等进行分析。共鉴定化合物37 种。
2.8 血浆样品代谢谱主成分分析(PCA)
T2DM 组和健康组血浆样品代谢谱的PCA 图,见图2。PCA 图直观反映了两组间存在代谢模式的差异。
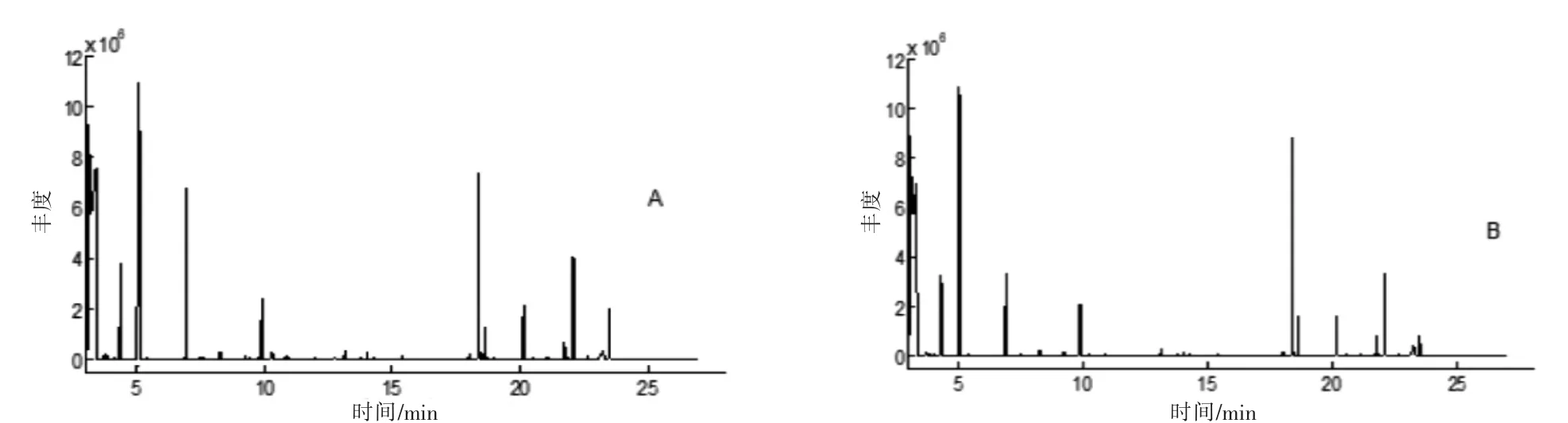
图1 血浆样品GC-MS 总离子流图
2.9 血浆样品偏最小二乘法判别分析(PLS-DA)模型
通过PCA 分析结果可以看出,两组的血浆样品存在显著差异,为进一步区分这两类群体,建立了具有更准确预测能力的PLS-DA 判别模型。见图3。
2.10 潜在生物标志物的确定
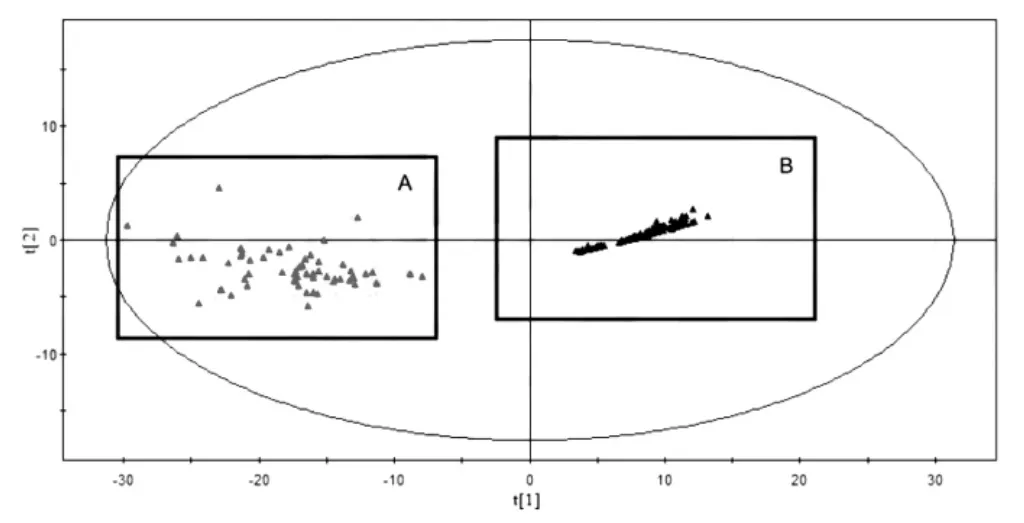
图2 血浆样品代谢谱的PCA 图
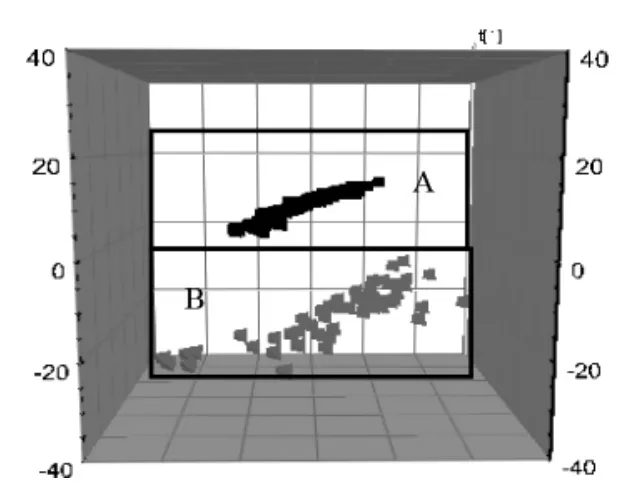
图3 血浆代谢谱的PLS-DA 图
通过对图3 的观察,可知健康组和T2DM 组的代谢图谱类似,只是在含量上有所不同。因此,引用SIMCAP 11.5 对数据进一步处理,采用PLS-DA 载荷矩阵图(见图4)对两组进行识别结合血浆供试品VIP图结合S 图(见图5),选取对分类贡献较大的变量。通过以上分析筛选,最终得到血浆样品的10 个差异代谢物(见表1),并对健康组和T2DM 组间进行t 检验分析(见表2),得到P <0.05 的潜在生物标志物确定为内源性生物标志物。
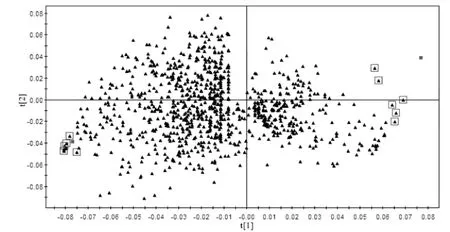
图4 血浆供试品PLS-DA 图
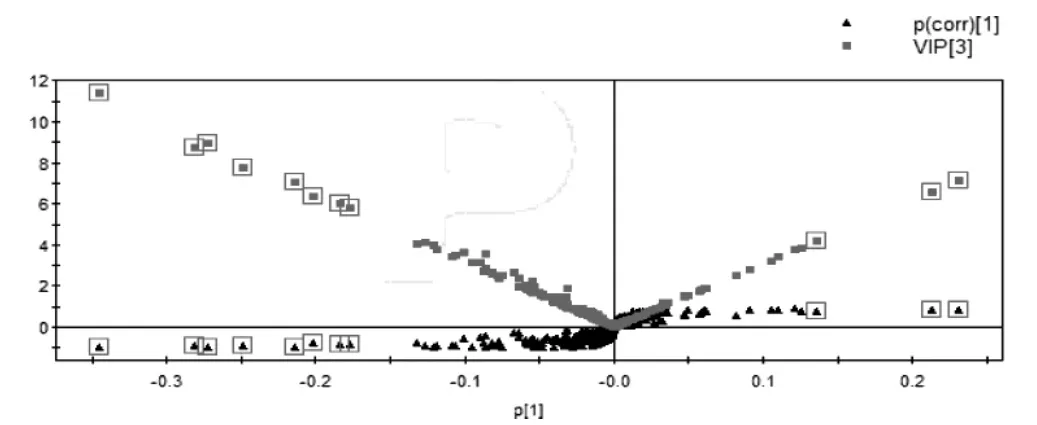
图5 血浆供试品VIP 图结合S 图
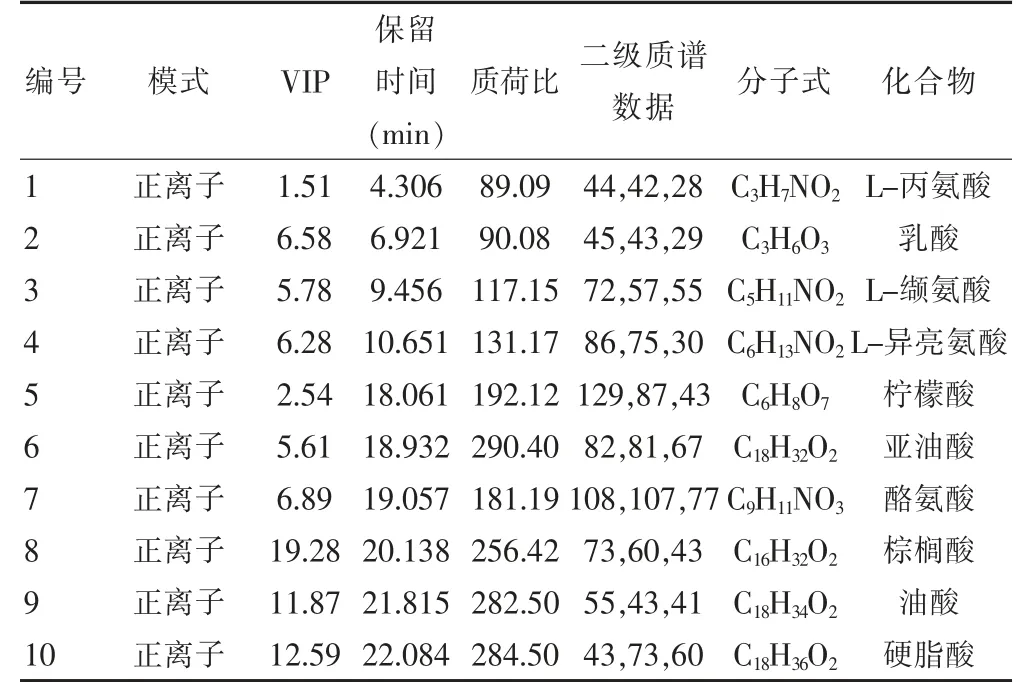
表1 生物标志物信息表
3 讨论
萃取溶剂主要对乙腈、甲醇用于样品代谢谱的影响做对比研究。结果显示色谱峰滤噪前乙腈处理的色谱峰个数及峰面积均低于甲醇,滤噪后结果相差不大。综上,本实验选用甲醇作为萃取剂。
对样品肟化条件进行研究,发现70℃反应1 h 所得的代谢物峰的个数及峰面积优于70℃反应0.5 h,而37℃反应12 h 与70℃反应1 h 结果相差不大。综上,肟化条件为70℃反应1 h。
衍生化条件发现,60℃反应1 h 的峰面积部分低于60℃反应2 h 和37℃反应12 h,37℃反应12 h 部分峰面积高于60℃反应2 h,可能是由于37℃反应12 h时间过久致部分样品挥发浓度增高,综上衍生化条件为60℃反应2 h。
本研究建立了基于GC-MS 的T2DM 血浆代谢组学分析方法[11-12],其中包括供试品溶液的制备方法,血浆代谢图谱的建立和内源性代谢物的鉴定。通过衍生化方法最大限度的采集到代谢信息。通过多元统计分析方法并结合NIST05a 标准质谱库进行检索,对血浆中的代谢物进行了定性、定量分析,成功鉴定出血浆内源性代谢物。其中L-丙氨酸、L-缬氨酸、L-异亮氨酸、柠檬酸、酪氨酸呈下降趋势;乳酸、亚油酸、棕榈酸、油酸和硬脂酸呈上升趋势。经过文献查阅发现,这些代谢产物主要与氨基酸代谢、糖脂代谢和能量代谢等途径相关[13-15]。文献显示[16-20],T2DM 患者的糖脂代谢、氨基酸代谢等多种代谢途径均发生了不同程度的紊乱。本实验为后续T2DM 研究提供基础。
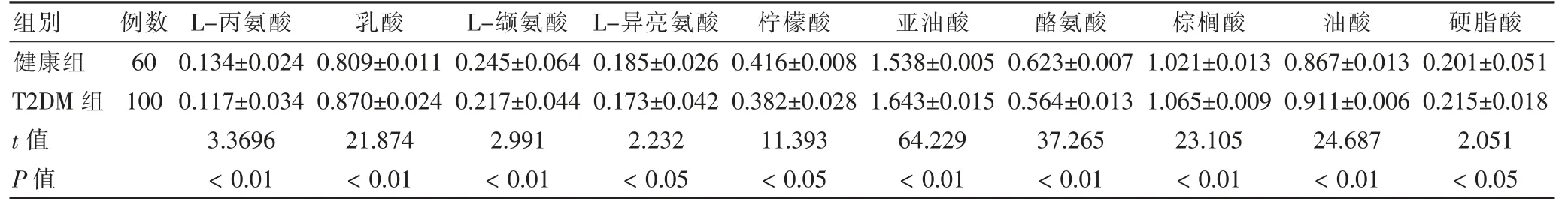
表2 两组血浆样品标志物水平比较
