地尔硫对肾移植患者环孢素A 血药浓度的影响
2020-01-01沈爱宗唐丽琴
苏 丹 陈 露 张 蕾 沈爱宗 唐丽琴
1.中国科学技术大学附属第一医院(安徽省立医院)药剂科,安徽合肥 230001;2.安徽中医药大学药学院,安徽合肥 230012
自1954 年成功进行了第1 例临床肾移植以来,全球有近百万患者接受肾移植手术而获得第二次生命[1]。然而,移植后排斥反应是影响移植肾长期存活的首要独立危险因素,也是亟待解决的瓶颈问题[2]。钙调神经磷酸酶抑制剂环孢素A(Cyclosporine A,CsA)是一种选择性作用于T 淋巴细胞的强效免疫抑制剂[4],在移植后的抗排斥反应中发挥着至关重要的作用[3],可降低免疫排斥反应,有利于改善肾移植预后[5-6]。但CsA 因其昂贵的费用、急性排斥反应和较大的个体差异性等原因[7],许多患者在应用后被迫停药,肾脏存活的时间受到影响[8]。地尔硫(Diltiazem,DTZ)可增加CsA 的血药浓度[9],从而降低其用药剂量、毒副作用和患者的药物治疗成本[10-11]。因此,本研究针对DTZ 对肾移植受者CsA 血药浓度的影响进行分析。
1 资料与方法
1.1 一般资料
选择2013 年1 月—2017 年12 月在中国科学技术大学附属第一医院(以下简称“我院”)接受肾移植的患者108 例,其中男84 例,女24 例,年龄17~49 岁。采用随机数字表法随机分为对照组(54 例)和研究组(54 例)。两组患者年龄、性别和体重比较,差异无统计学意义(P >0.05),具有可比性。见表1。纳入标准:为避免初期移植等因素的影响,受试者均为移植手术后移植物存活>3 个月;肝肾功能稳定;心功能正常;临床资料完整。排除标准:继发性肾病综合征和急性肾炎;合并其他严重内科疾病;合并使用其他影响CsA血药浓度的药物[12-13],如伏立康唑、利福平、红霉素等。本研究经我院医学伦理委员会批准,患者已知情同意并签署知情同意书。
1.2 方法
1.2.1 给药方案 对照组:患者环孢素软胶囊(杭州中美华东制药有限公司,国药准字H10960122,25 mg/粒)的起始使用剂量为10~15 mg/(kg·d),分2 次口服,后根据患者的血药浓度调整其维持量,分2 次口服。研究组:在对照组的基础上,于术后1 d 开始应用盐酸地尔硫片(天津田边制药有限公司,国药准字H12020126,30 mg/片),每次口服30 mg,2~3次/d。患者取样:对照组和研究组均于测定日8~9 时抽取患者的血样,并于2 h 内进行测定。
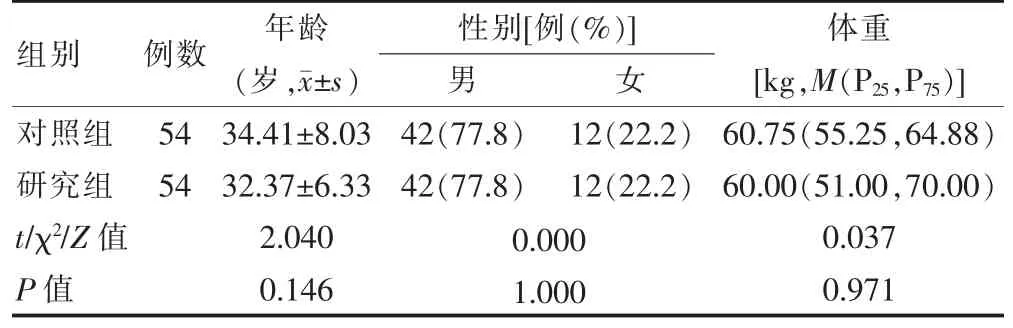
表1 两组肾移植受者基本信息比较
1.2.2 观察指标 监测肾移植的患者术后1~6 个月CsA 的血药浓度和肝、肾功能,收集受试者患者的血肌酐(CR)、尿素氮(BUN)和尿酸(UA)数据。本研究应用化学发光微粒子免疫法测定CsA 的血药浓度。设备与试剂:ARCHITECTi1000SR 全自动免疫分析仪(美国雅培公司),CsA 全血试剂盒(美国雅培公司),D-37520 台式离心机(Thermo 公司),PCR 仪(GeneAmp PCR System 9700,Applied Biosystems 公司)。
1.3 统计学方法
采用SPSS 23.0 统计软件对所得数据进行分析。符合正态分布计量资料以均数±标准差(±s)表示,两组比较采用t 检验,多组比较采用重复测量方差分析,若不满足球对称性检验,则对自由度进行Greenhouse-Geisser 校正。不符合正态分布计量资料以中位数及四分位数间距[M(P25,P75)]表示,采 用Mann-Whitney U 检验或Willcoxon 秩和检验。计数资料以例数或百分比表示,采用χ2检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 两组患者肾移植术后不同时间CsA 血药浓度比较
两组患者肾移植术后CsA 血药浓度组间及交互作用比较,差异无统计学意义(P >0.05);时间比较,差异有统计学意义(P <0.05)。其中,两组患者术后2~6 个月CsA 血药浓度低于术后1 个月,术后3~6 个月CsA 血药浓度低于术后2 个月,差异有统计学意义(P <0.05)。两组患者CsA 用药剂量组间及时间比较,差异有统计学意义(P <0.05);而交互作用比较,差异无统计学意义(P >0.05)。其中术后2、4、6 个月CsA 用药剂量低于术后1 个月,术后3 个月低于术后2 个月,术后4、6 个月低于术后3 个月,差异有统计学意义(P <0.05)。
2.3 两组患者治疗前后CR、BUN 及UA 水平比较
两组患者治疗前CR、BUN 及UA水平比较,差异无统计学意义(P >0.05)。治疗后,两组患者CR、BUN及UA 水平低于治疗前,差异有统计学意义 (P <0.05)。两组患者治疗后各指标水平比较,差异无统计学意义(P >0.05)。见表3。
表2 两组患者肾移植术后不同时间CsA 血药浓度及用药剂量比较(±s)

表2 两组患者肾移植术后不同时间CsA 血药浓度及用药剂量比较(±s)
注:与本组术后1 个月比较,*P <0.05;与本组术后2 个月比较,△P <0.05;与本组术后3 个月比较,#P <0.05;与对照组同期比较,aP <0.05。CsA:环孢素A
3 讨论
3.1 两组患者各指标水平分析
同期研究组CsA 的用药量明显低于对照组,差异有统计学意义(P <0.05)。而两组患者同期的血药浓度数据的比较,差异无统计学意义(P <0.05)。从CsA 血药浓度时间点比较来看,两组患者术后2~6 个月CsA 血药浓度低于术后1 个月,术后3~6 个月CsA 血药浓度低于术后2 个月,差异有统计学意义(P <0.05)。结果可见,DTZ 可提高CsA 的血药浓度。肾移植术后患者使用CsA 联合DTZ,可使CsA 用药剂量有所减少,且不会使CsA 的血药浓度降低。DTZ 的价格较CsA 来说较便宜,可减轻患者经济负担、保证用药疗效。
表3 两组患者治疗前后CR、BUN 及UA 水平比较(±s)
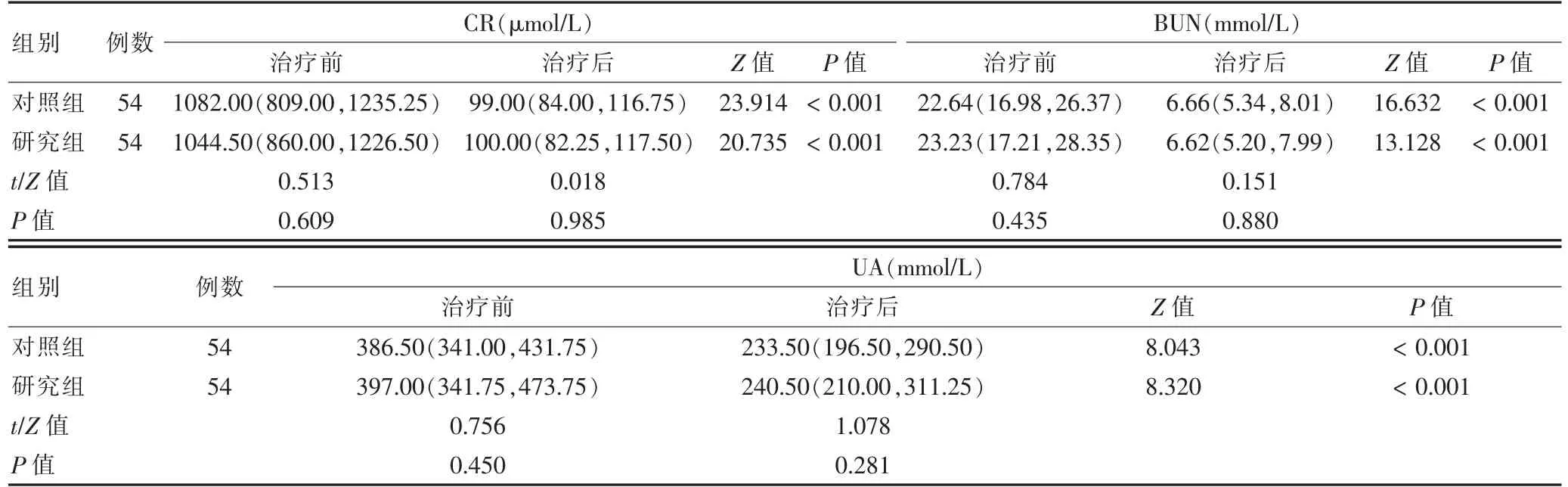
表3 两组患者治疗前后CR、BUN 及UA 水平比较(±s)
注:CR:血肌酐;BUN:尿素氮;UA:尿酸
由两组肾移植术后患者CR、BUN、UA 的数据分析得出,治疗前后两组患者CR、BUN、UA 比较,差异无统计学意义(P >0.05),提示两组患者肾移植术前术后的肾功能无显著差异,不会因此对接受治疗后的CsA 的血药浓度产生差异性的影响。此外,两组治疗方案均能显著降低患者的CR、BUN、UA 水平。
3.2 CsA 与DTZ 的相互作用
钙离子拮抗剂DTZ 与CsA 合用能明显增加器官移植受者CsA 的血药浓度,减低其肾毒性反应[14]。CsA增加系膜和血管平滑肌细胞中的跨膜钙通量,这可能解释了CsA 诱导肾血流量和肾小球滤过率降低的原因,由于DTZ 可抑制Ca2+进入细胞以及氧自由基的生成,从而减轻移植肾的损伤,促进移植肾功能的恢复[15]。因此,钙拮抗剂可能在预防或逆转CsA 肾毒性中起作用。同时,DTZ 有降血压作用,肾移植术后伴有高血压的患者在联合使用CsA 和DTZ 时,可适当减少同时正在使用的其他降压药的剂量,以避免血压下降过低而导致患者不适。DTZ 还具有血管扩张作用,可减少肾血管痉挛[16]。两药联合应用带来的不良反应也应被关注,如DTZ 可以通过提高CsA 的血浆浓度来增加其睾丸毒性,引起睾丸组织的形态变化以及睾丸激素、间充质细胞和支持细胞的超微结构变化[17]。
3.3 可能存在的影响因素
虽然本研究排除两组患者肾功能对最终数据及所得结果的影响,但仍存在一些可能的因素会影响结果准确性。①个体的差异[18-19]:CsA 口服个体差异较大。②饮食的影响[20]:当与某些食物,尤其是脂溶性食物同服时,CsA 的峰浓度、谷浓度、AUC 均会升高,不排除患者平时饮食中食用可对CYP3A4 酶产生影响的食物,从而影响了CsA 吸收与代谢。③患者的因素:虽然选定的患者样本都是于测定日上午8~9 时准时接受血样的抽取并及时进行测定,但不排除部分患者在两次血药浓度监测期间存在未严格遵医嘱按时按量服药的现象,可对血药浓度的测定产生很大程度的影响。在病例筛选过程中,已剔除血药浓度波动幅度过大的患者,以避免对本研究结果的准确性产生影响。④基因分型的影响[21-22]:有研究者[23]发现,225 例中国肾移植患者的CYP3A4*1G 和CYP3A5*3 基因多态性与DTZ 的谷浓度/剂量比、药代动力学及其主要代谢物密切相关。
本研究证明肾移植术后的患者在使用CsA 的同时联合使用DTZ 可升高CsA 的血药浓度,减小CsA的用药剂量,从而降低CsA 的毒副作用,减轻对患者造成的损害,也减轻患者的经济负担[24-25]。在临床上联合应用这两种药物时,临床药师还应做好药学监护,密切监测CsA 的血药浓度,避免两者相互作用导致的药物不良反应[26]。
