Skp2 高表达与骨肉瘤患者新辅助化疗耐药之间的联系
2020-01-01许多辉宋正南白靖平
许多辉 丁 路 余 伟 宋正南 白靖平
1.新疆医科大学第三临床医学院骨软科,新疆乌鲁木齐 830000;2.新疆医科大学第五临床医学院骨一科,新疆乌鲁木齐 830000
骨肉瘤(osteosarcoma,OS)是好发于儿童和青少年的骨恶性肿瘤[1-2]。新辅助化疗使骨肉瘤5 年生存率大幅度提高[3-4],近几十年5 年生存率进入了平台期,化疗耐药是主要因素之一[5-6]。因此,探索骨肉瘤化疗耐药的分子机制,是改善预后的关键。
S 期激酶相关蛋白2(S-phase kinase associated protein 2,Skp2)可识别和降解细胞周期素依赖性激酶抑制剂(CKI),如p21、p27 等[7]。前期体外实验发现[8-10],Skp2 可抑制细胞凋亡,增加侵袭能力,促进上皮间充质转化(EMT),敲除Skp2 可逆转上皮间质转化(EMT)特征。本研究利用公共数据库和骨肉瘤样本探讨Skp2 在患者中的表达。
1 对象与方法
1.1 数据来源和分析
GSE126209 含6 例骨肉瘤样本和5 例癌旁组织。GSE16089 含甲氨蝶呤敏感的Saos-2 骨肉瘤细胞和甲氨蝶呤耐药的Saos-2 细胞各3 株。TCGA 数据含87 例附生存信息的骨肉瘤样本。
limma 软件包计算GSE126209 和GSE16089 中的差异表达基因(DEGs)。筛选条件为logFC>1 且P <0.05。clusterProfiler 软件包对DEGs 进行富集分析,筛选阈值P <0.05。
1.2 研究对象
收集2018 年2 月—2019 年6 月新疆医科大学第三临床医学院(以下简称“我院”)骨软科按标准方案收治的OS 患者所有患者均采用新辅助化疗方案:甲氨喋呤:8~12 g/m2、阿霉素:60~90 mg/m2、顺铂:120~150 mg/m2、异环磷酰胺15 g/m2。共2 个循环(10 d)。经我院医学伦理委员会审批及患者、家属同意后获取肿瘤及癌旁组织各17 例。见表1。按肿瘤细胞坏死率(TCNR)≥90%为非耐药,TCNR<90%为耐药分组[11]:非耐药肿瘤组织(A 组)11 例和耐药肿瘤组织(B 组)6 例;非耐药癌旁组织(C 组)11 例和耐药癌旁组织(D组)6 例。

表1 耐药与非耐药患者一般资料比较
1.3 肿瘤细胞坏死率的测定
沿最大径做纵切面后分区。每个分区按上、中、下取材、制片后镜检。见图1。
图1 标本取材
1.4 RT-qPCR
Trizol(Ambion,15596-026)提取样本RNA,HiScript Reverse Transcriptase(RNase H)(VAZYME,R101-01/02)反转录。SYBR Green Master Mix(VAZYME,Q111-02)获得RT-PCR 产物。结果以GAPDH 为内参基因进行2-△△Ct分析。
1.5 Western-blot
单去污剂裂解(含PMSF)样本,BCA 试剂盒(Solarbio)测上清蛋白浓度。WB 检测Skp2(Ab183039)、AKT(Ab18785)、p21(Ab109520)、p27(Ab32034)、FOXO1(Ab52857)、E-cadherin(Ab40772)蛋白表达。分别计算与GAPDH(Bioswamp,PAB36269)的灰度比值(%)。
1.6 统计学方法
采用SPSS 21.0 对所得数据进行统计学分析,计量资料采用均数±标准差(±s)表示,组间比较采用t检验,计数资料采用百分率表示,组间比较采用Fisher确切概率法。骨肉瘤预后的风险因素采用Cox 回归分析,以P <0.05 为差异有统计学意义。
2 结果
2.1 Skp2 与OS 耐药相关
Skp2 在OS 和耐药肿瘤中均上调(P <0.05)(图2A、2B)。富集分析示Skp2 在耐药肿瘤中参与细胞周期和FOXO 通路等(图2C)。String 数据库(https://string-db.org)示Skp2 与AKT,FOXO 通路和细胞凋亡基因间具有互作关系(图2D)。
2.2 mRNA 表达差异
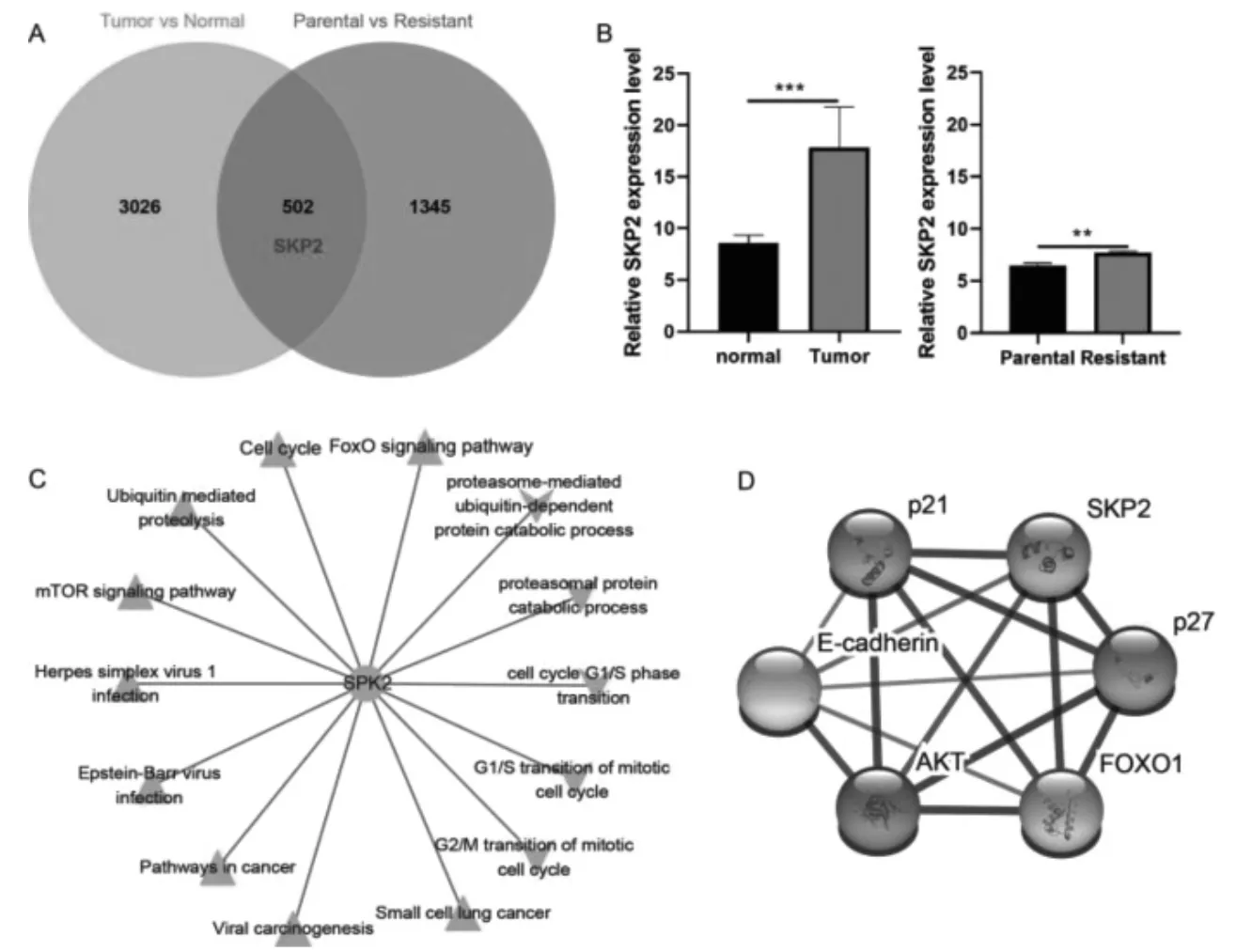
图2 Skp2 与耐药相关
RT-qPCR 结果示,与A 组比较,B 组Skp2 和AKT显著上调,p27、FOXO1、E-cadherin 显著下调,C 组Skp2、AKT、E-cadherin 显著下调,P21、P27、FOXO1 显著上调(P <0.05);与B 组比较,D 组Skp2、p21、AKT 下调,p27、FOXO1、E-cadherin 显著上调。见图3。
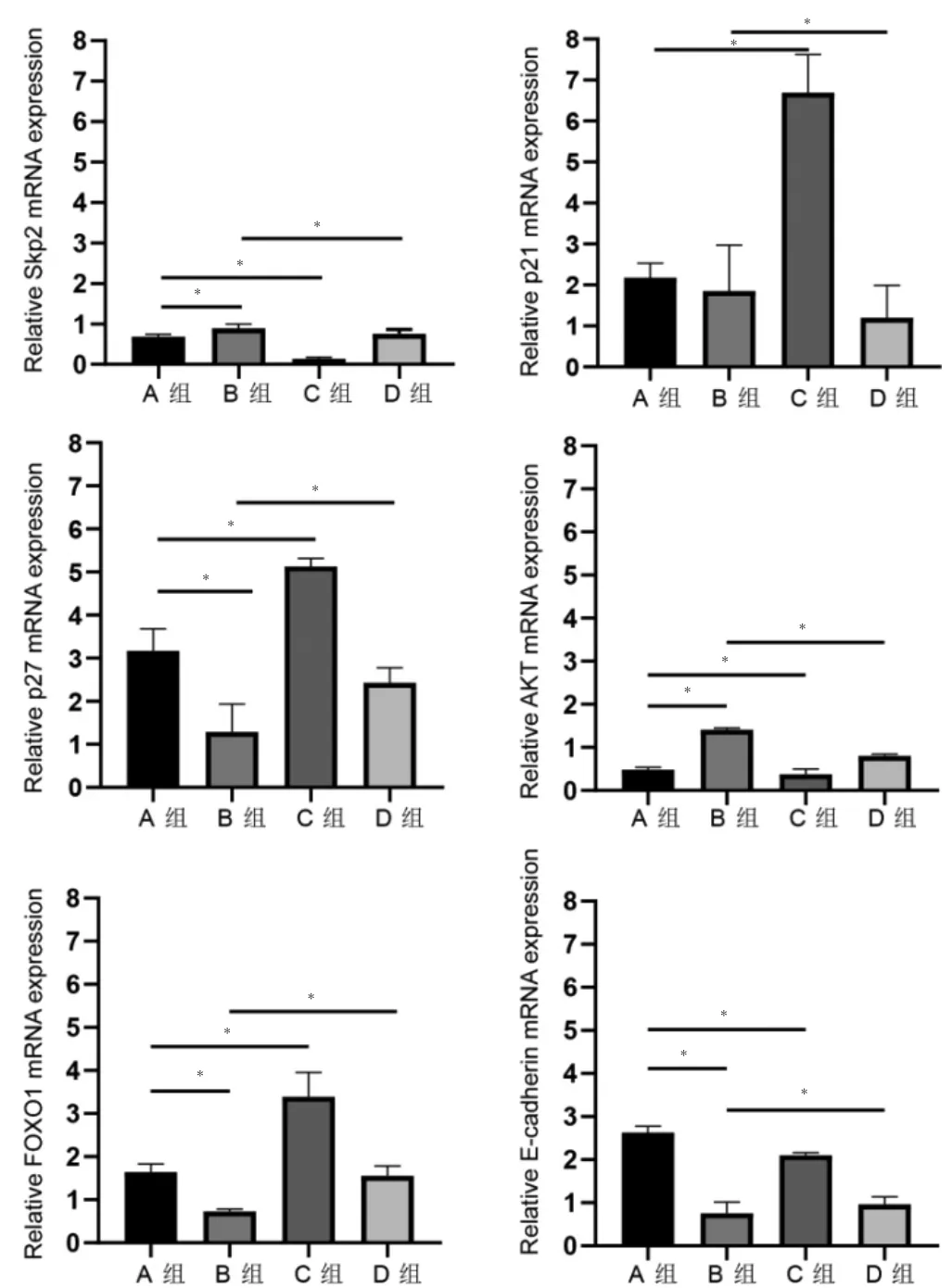
图3 Skp2、AKT、p21、p27、FOXO1、E-cadherin 在不同分组中的mRNA 表达差异
2.3 蛋白表达差异
Western-blot 结果示,与A 组比较,B 组Skp2 和AKT 显著上调,p27、FOXO1、E-cadherin 显著下调,C组Skp2、AKT、E-cadherin 显著下调,P21、P27、FOXO1显著上调(P <0.05);与B 组比较,D 组Skp2、p21、AKT 下调,p27、FOXO1、E-cadherin 显著上调。见图4。
2.4 骨肉瘤预后的风险因素
Cox 回归分析结果示,Skp2、AKT 和p27 的风险比均>1,且P <0.05 可能是OS 患者预后的风险因素。见表2。
3 讨论
化疗可杀灭微小转移灶,但常伴有耐药的发生[12-13]。Skp2 与多种肿瘤耐药相关,如前列腺癌、乳腺癌、OS等[14-15,8]。本研究首先识别了Skp2 在OS 和耐药OS 中表达上调,且Skp2 高表达是预后较差的预测因素,表达下调对侵袭、肺转移具有抑制作用[16]。
Skp2 泛素化促进AKT 活化,与预后不良有关[17]。在食管鳞癌中,抑制AKT 磷酸化,可抑制Skp2 的表达,减缓细胞增殖[18]。AKT-Skp2 通路可能是改善OS化疗效果的靶通路。另外,Skp2 抑制OS 细胞中E-cadherin、FOXO1、p21 和p27 表达,抑制细胞凋亡[10,19]。然而,分子检测示p21 在耐药肿瘤组与非耐药组间无明显差异,提示p21 的生成和降解不仅受Skp2 的调节[20]。Skp2 通过对p27 的降解,在OS 的发生和发展中发挥重要作用,是OS 的重要预后指标[21-22]。研究表明Skp2 通过降解E-cadherin 促进细胞迁移[23]。E-cadherin 与EMT 诱导的转录抑制因子相互作用,并与肿瘤细胞化疗耐药间存在着紧密联系[24-25]。同时,Cox 分析结果显示,性别、Skp2、AKT、p21 和p27 可能是OS 患者生存时间的风险因素,需要进一步研究和探讨。
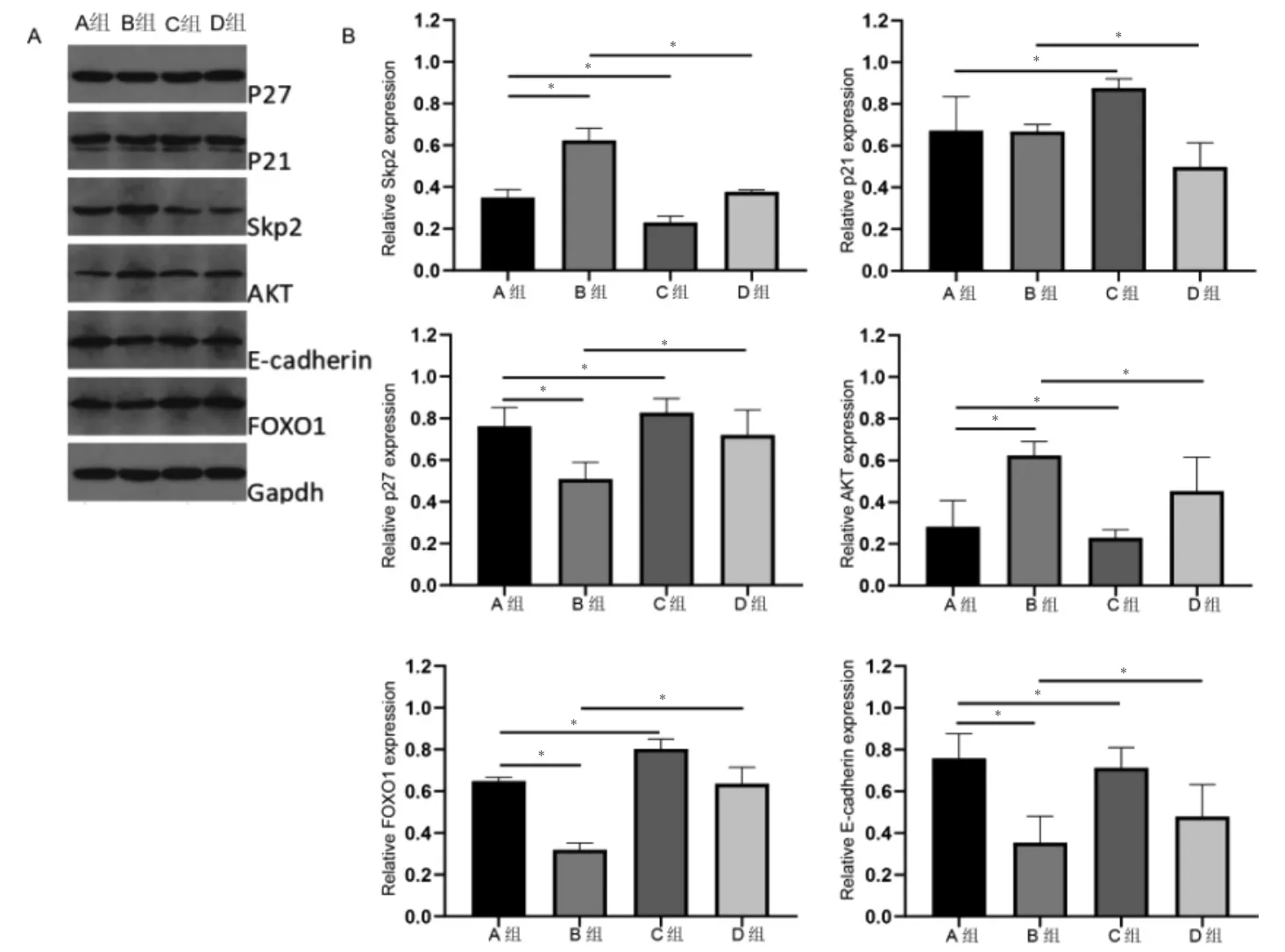
图4 Skp2、AKT、p21、p27、FOXO1、E-cadherin 在不同分组中的蛋白表达
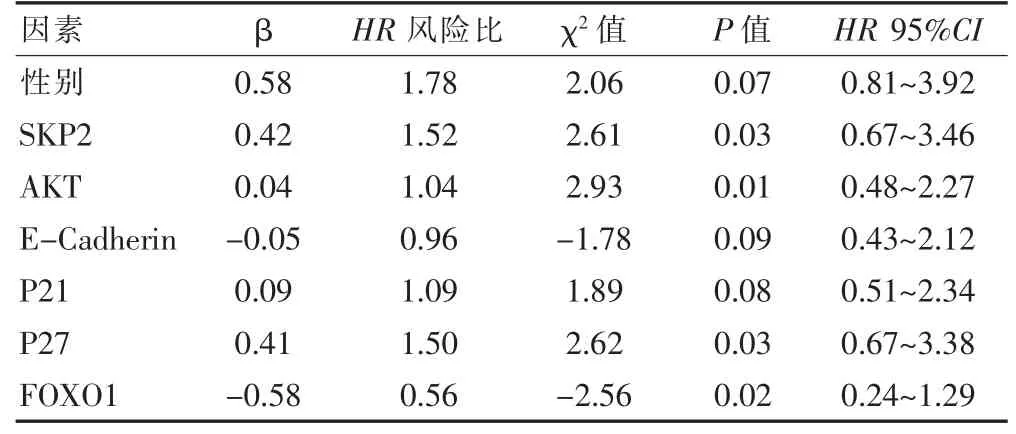
表2 Cox 回归分析
综上所述,Skp2 的高表达与OS 新辅助化疗耐药密切相关,Skp2 可能是改善化疗疗效的潜在靶点。
