低pH值条件下不同大豆蛋白组分聚合性能研究
2019-12-31徐红华郭珊珊马金玉高子雯马彩虹
徐红华 丁 瑞 郭珊珊 马金玉 高子雯 马彩虹
(东北农业大学食品学院, 哈尔滨 150030)
0 引言
长期以来,食品蛋白质的研究主要集中在大于等电点的pH值条件下,但近年研究表明,低 pH 值条件下部分蛋白质可以自组装形成纳米纤维聚合结构,并且其凝胶性、乳化性、起泡性等功能性质得到明显改善[1]。pH值的变化也会赋予蛋白质不同的聚合结构,例如:乳中的β-乳球蛋白在等电点附近形成颗粒状聚合物[2],进一步降低pH值,形成链状聚合物[3],当pH值低于2.5、低离子强度、持续加热时,则形成纤维状聚合物[4]。也有学者对大豆蛋白进行了相关研究。文献[5-6]研究发现,7S在pH值为2.0、80℃长时间加热时,也可以形成纤维;随后文献[7]将7S的亚基α′、α和β-亚基分离出来,在pH值为2.0、85℃条件下加热,可以形成纤维聚合物;课题组前期研究中也发现,11S 自身不能形成纤维聚合物,但11S的酸性亚基在pH值2.0、95℃条件下加热20 h,可以形成淀粉样纤维聚合物[8]。除了低pH值对蛋白质聚合形态的影响以外,蛋白质组成也对功能性质有很大影响。7S比11S的凝胶特性弱,由于网状结构的差异,7S热致凝胶的硬度比11S低,而且易断裂[9]。综上,大豆蛋白组成不同、相同蛋白组分不同的情况下,聚合结构都可能赋予其不同的功能特性。本文通过研究大豆蛋白不同组分在不同pH值条件下形成的热致凝胶,比较分析不同组分、相同组分不同pH值条件下聚合物的结构特性、微观形态及其主要驱动力的差异,探讨不同大豆蛋白组分在低pH值条件下的自组装聚合结构与功能特性之间的关系,为改善大豆蛋白功能性提供一种新思路。
1 材料与方法
1.1 材料与仪器
试验采用的大豆(Glycinemax)原料品种为东农42号大豆,经研磨、过筛、脱脂制备脱脂豆粉。其它化学试剂均为分析纯(AR)试剂。
试验使用的主要仪器有:GL-21M型离心机,上海精密仪器研究所;DK-98-ⅡA 型恒温水浴锅,天津市泰斯特仪器有限公司;pHS-3C 型精密 pH 计,梅特勒-托利多仪器(上海)有限公司;AL204 型分析天平, 梅特勒-托利多仪器(上海)有限公司;LNK-872 型多功能快速消化器,江苏省宜兴市科教仪器研究所;KDN-102C 型半自动定氮仪,上海纤检仪器有限公司;JEM-1200EX型透射电子显微镜,日本日立公司;S-3400N型扫描电子显微镜,日本日立公司;DTT-6C型电泳仪,北京六一仪器厂;DYCZ-28A型电泳槽,北京六一仪器厂;UV-240IPC型紫外可见分光光度计,日本岛津公司;PE Pyris6 型差示扫描量热仪,美国PE公司;H-1 微型漩涡混合器,上海精科实业有限公司;F-4500 型荧光分光光度计,日本日立公司;旋转流变仪,英国马尔文公司;DS-1型高速组织捣碎机,上海精科实业有限公司;LGJ-1型冷冻干燥机,上海医用仪器分析厂;TA-XT2 PLUS 型物性测定仪,英国 Stable Micro System 公司。
1.2 实验方法
1.2.1原料成分的测定
脱脂豆粉蛋白含量参照AOAC 991.20[10]测定。
1.2.2蛋白样品的制备
脱脂豆粉的制备:将大豆磨碎后过40目筛,所得的豆粉按照文献[11]脂肪的测定方法脱除脂肪,最后将脱脂豆粉风干,重新过40目筛,得到蛋白质量分数为40.83%的脱脂豆粉。
可溶性大豆蛋白(以下简称全蛋白)的制备:将脱脂豆粉与水按照液料比10 mL/g混合,分别将其调制不同的pH值,室温(20℃)下搅拌1 h,4℃下离心(10 000g,20 min)处理,取上清液,即为相应pH值下水可溶性全蛋白溶液。
7S和11S的分离制备:将得到的水可溶性全蛋白溶液调pH值到6.4,4℃条件下冷沉12 h,4℃下冷冻离心(10 000g,20 min),得到的沉淀即为11S的粗提物。将11S沉淀复溶,分别将其调制不同的pH值,室温下搅拌1 h,4℃下离心(10 000g,20 min)处理,取上清液待用。收集可溶性蛋白的上清液,调pH值到4.8,8℃下离心(6 500g,20 min)处理,得到的沉淀即为7S粗提物。将7S沉淀复溶,分别将其调制不同的pH值,室温下搅拌1 h,4℃下离心(10 000g,20 min)处理,取上清液待用[12]。
酸性亚基和碱性亚基的分离制备:酸性亚基和碱性亚基的分离[13]由大豆球蛋白(11S)开始。用30 mol/L的pH值8.0的Tris缓冲液将大豆球蛋白(11S)稀释到0.005 g/mL,然后加入β-巯基乙醇使其浓度为15 mol/L,90℃加热处理30 min,冷却到室温后,4℃下离心(10 000g,20 min) 处理,所得的沉淀即为碱性亚基。将沉淀复溶,分别将其调制不同的pH值,室温下搅拌1 h,4℃下离心(10 000g,20 min)处理,取上清液待用。收集除掉碱性亚基的上清液用2 mol/L HCl调pH值到4.8,4℃离心(6 500g,20 min)处理,沉淀物即为酸性亚基。将沉淀复溶,分别将其调制不同的pH值,室温下搅拌1 h,4℃下离心(10 000g,20 min)处理,取上清液待用。
1.2.3凝胶的制备
利用凯氏定氮法测定溶液的蛋白质含量,将溶液的蛋白质质量分数调至3.0%,再用1 mol/L HCl和0.1 mol/L HCl将溶液调至相应的pH值,全蛋白90℃,7S 80℃,11S、酸性亚基、碱性亚基95℃,分别水浴10 h,取出立即冷却,4℃冰箱保存12 h。
1.2.4表面疏水性
采用ANS荧光探针法[14]进行测定。分别将不同蛋白样品用磷酸盐缓冲液(0.01 mol/L,pH值7.0)依次稀释至0.1、0.05、0.025、0.012 5 mg/mL后,取不同质量浓度样品的溶液6 mL,分别加入 25 μL 8 mmol/L 的 ANS 溶液(用0.01 mol/L、pH值7.0 的磷酸盐缓冲液配制),经振荡后静置15 min,再测定样品的荧光强度。实验中激发波长λex=390 nm,发射波长λem=470 nm,夹缝为5 nm。以荧光强度对蛋白质质量浓度制图,初始段斜率即为蛋白质分子的表面疏水性指数。
多角度写——既从参与者(自己)的角度来写所见、所闻、所感,也从旁观者(他人)的角度来写;既从面上来写集体的表现,也从点上来写有特点的个体表现。
1.2.5游离巯基
蛋白溶液中游离巯基的测定方法参照文献[15]的方法,并加以改进。取 0.25 mL大豆蛋白聚合物溶液(20 mg/mL)加入到5 mL Tris-Gly缓冲溶液(0.086 mol/L Tris,0.09 mol/L 甘氨酸,0.004 mol/L乙二胺四乙酸,pH值8.0和8 mol/L 尿素)中,然后再向其中加入体积为20 μL的2,2-dinitro-5,5-dithiodibenzoate (DTNB)试剂,振荡混匀,在室温下静置15 min,利用紫外分光光度计在412 nm波长下测定吸光度,以不加蛋白样的溶液做空白调零。游离巯基质量摩尔浓度计算公式为
SH=73.53A412D/C
式中SH——游离巯基质量摩尔浓度,μmol/g
A412——412 nm下的吸光度
C——固形物质量浓度,mg/mL
D——稀释系数
1.2.6透射电镜
参照文献[16]的方法,使用透射电子显微镜(TEM)测定样品的微观结构。将蛋白样用去离子水稀释成蛋白质量分数为0.2%的待测样品,取一滴稀释液滴于透射电镜专用铜网上吸附15 min,多余的部分用滤纸移除,室温下干燥10 min,80 kV电压下用透射电镜进行分析。
1.2.7扫描电镜
参照文献[17]的方法,实验操作步骤如下:①固定:取凝胶约1 cm3左右,加入pH值6.8、2.5%的戊二醛进行固定,然后置于4℃冰箱中保存。②切片:用液氮将样品冷冻,小心用刀片切断横截面。③冲洗:用pH值6.8磷酸缓冲液反复冲洗3次,每次10 min。④脱水:分别用体积分数为 30%、50%、70%、90%、100%的乙醇脱水,每次10~15 min, 乙醇体积分数为 100%时脱水3次。其他体积分数时各一次。100%的乙醇中要加入吸水剂。⑤置换:100%乙醇10 min,100%乙醇与叔丁醇体积比1∶1一次,纯叔丁醇一次,各10 min。⑥冷冻干燥。⑦镀金:选择要观察的面进行固定,离子渐射镀金。⑧上镜观察,取相。
1.2.8质构测定
本实验采用TA-XT2型物性测定仪测定凝胶的质构,它通过模拟人的触觉感应,分析检测触觉中的物理特性。参照文献[18]的方法,采用直径为35 mm的P35型探头以恒定的速率施加于样品上,记录穿透厚度达到一定值时所用的力。实验参数:测前速度1.0 mm/s;测试速度1.7 mm/s;测后速度2.0 mm/s,感应力设为50 N,测试距离为10 mm。
1.2.9流变学测定
表观粘度测定:参照文献[19]的方法,略有修改。采用马尔文流变仪稳态测试系统测试表观粘度,选择夹具直径为60 mm的平行板,平行板之间的夹距为500 nm,取3.0%样品分散液缓慢倾注充满夹具,溢出的部分用专用的塑料刮勺刮去,盖好保温套,剪切速率范围0.01~100 s-1。
粘弹性测定[20]:选择夹具直径为60 mm、夹角为0.5°的锥形板,通过应力扫描,确定应力为0.050 61 Pa。
1.3 数据处理分析
实验数据采用Origin 2017进行制图和IBM SPSS Statistics v 20.0 软件对实验数据进行ANOVA方差分析,检验差异显著性(P<0.05)。数据均以平均值±标准差表示(n=3)。
2 结果与分析
2.1 pH值对流变学特性的影响
不同pH值(1.5、2.0、2.5、3.0)条件下大豆全蛋白热聚合后流变学特性存在很大差异,从图1(图中G′为贮能模量,G″为损耗模量)的结果可以看出,同一pH值条件下,随着剪切速率的增加,全蛋白的表观粘度降低,并且pH值越低,其表观粘度降低幅度越大,尤其是在剪切初期。pH值3.0样品的表观粘度大一些,抗剪切能力强一些,随pH值的降低依次递减,pH值1.5时最低。同样,随着频率的增加,粘弹性逐渐升高,pH值3.0样品的弹性模量和粘性模量表现最好,其次是pH值2.0、pH值2.5,pH值1.5时最差(图1)。pH值改变带来的流变学性质变化可能与大豆蛋白聚合物结构差异有关[21-22]。
2.2 不同大豆蛋白组分的凝胶质构特性
不同pH值会带来大豆全蛋白流变学性能的差异,当把全蛋白分离为7S、11S,11S又分离为酸性亚基和碱性亚基,这些不同大豆蛋白组分在相同蛋白不同pH值条件下凝胶特性也同样存在很大差异。从表1可以看到,全蛋白在pH值3.5处形成的凝胶硬度是pH值2.0处形成的1.19倍;7S凝胶的这种差异更加明显,是其1.91倍;11S形成的两种凝胶的倍数关系是3.16;酸性亚基是1.827倍;碱性亚基2种pH值下形成的热致凝胶硬度差异小,是其0.742倍,差异性不明显。上述结果可以发现,对于pH值3.5的蛋白凝胶来说,其硬度、黏性及咀嚼性都高于pH值2.0各种大豆蛋白组分形成的凝胶(表1)。
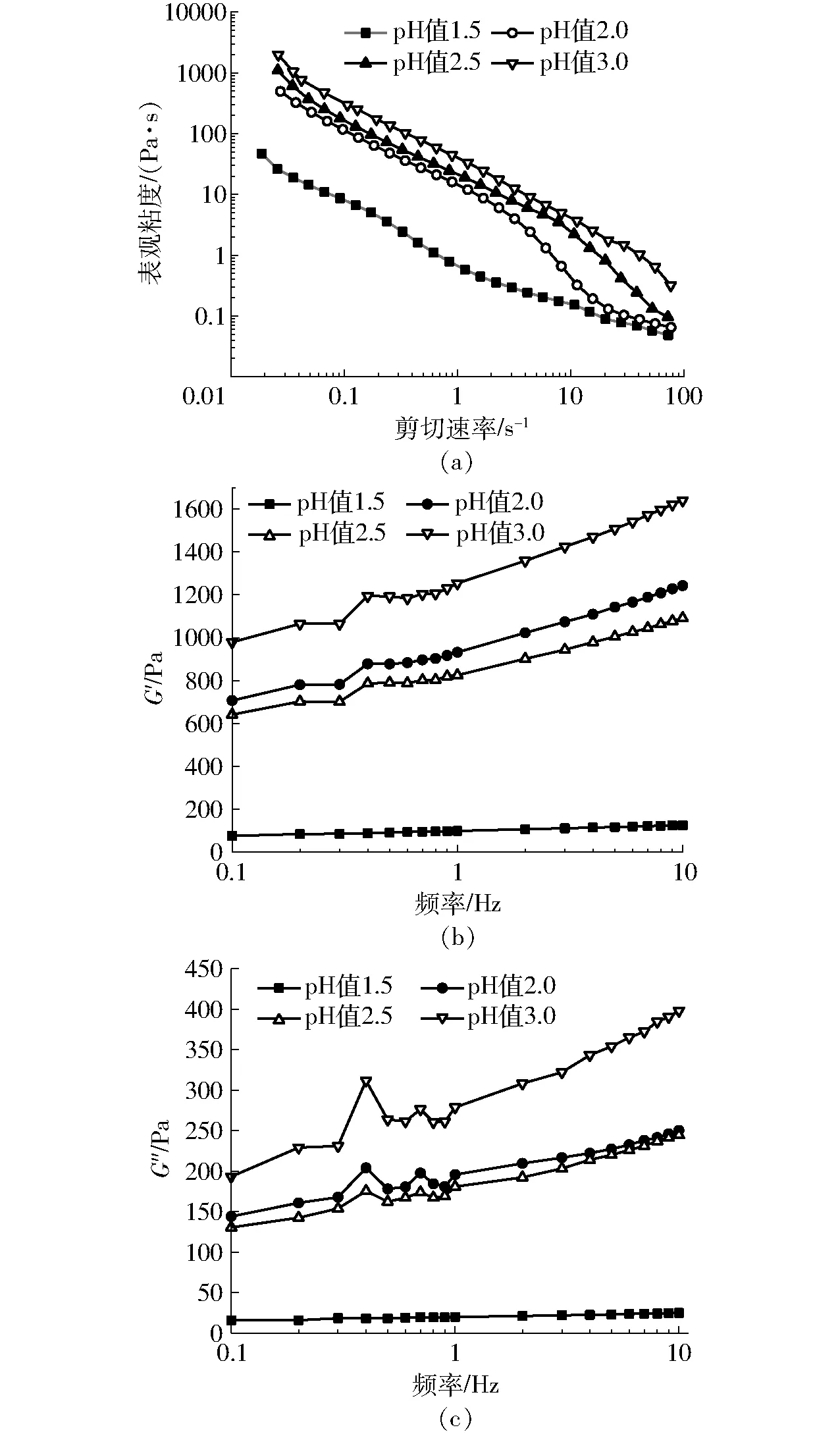
图1 不同pH值样品表观粘度及粘弹性的变化曲线Fig.1 Apparent viscosity changes of samples at different pH values
2.3 不同大豆蛋白组分的聚合形态
大豆全蛋白、7S、11S、酸性亚基和碱性亚基在不同pH值条件下凝胶性能的差异可能与形成的聚合物形态存在很大关系。从透射电镜的结果可以看出,pH值2.0和pH值3.5两种条件下,蛋白聚合物形态有很大不同,pH值2.0主要以纤维或链状结构为主;pH值3.5则以颗粒或片状团簇结构为主。其中碱性亚基在两个pH值条件下聚合物状态差别不大,没有明显的纤维聚合物形成,都是以团簇状聚集。在扫描电镜中可以看到,对于不同大豆蛋白成分的凝胶,其在pH值3.5处凝胶的结构比在pH值2.0处凝胶的结构更致密,孔隙度很小且均匀,网状结构更规则,这与其聚合特性也有关,在pH值3.5处的聚合为颗粒聚合,pH值2.0处的蛋白为线性或链状聚合。其中7S和酸性亚基两种蛋白成分在不同pH值形成的凝胶微观结构的差异性表现最为明显(图2)。
2.4 聚合驱动力
对于全蛋白、7S和11S的变化规律,在热处理1 h时,表面疏水性达到最大,随后的加热处理过程,表面疏水性呈下降趋势,而酸性亚基和碱性亚基在加热过程中,表面疏水性均呈下降趋势。产生这种差异可能是由于其分子结构的差异。5种蛋白样品表面疏水性在不同pH值条件的变化均从小到大依次为pH值1.5、pH值2.0、pH值3.0、pH值3.5(图3)。由于未加热前不同pH值的表面疏水性接近,进而说明pH值越低疏水相互作用能力越强。相对于pH值3.5处形成的颗粒凝胶,在pH值2.0处细链凝胶的疏水相互作用是主要作用力,而pH值3.5处颗粒凝胶的这种非共价作用力弱(图3)。
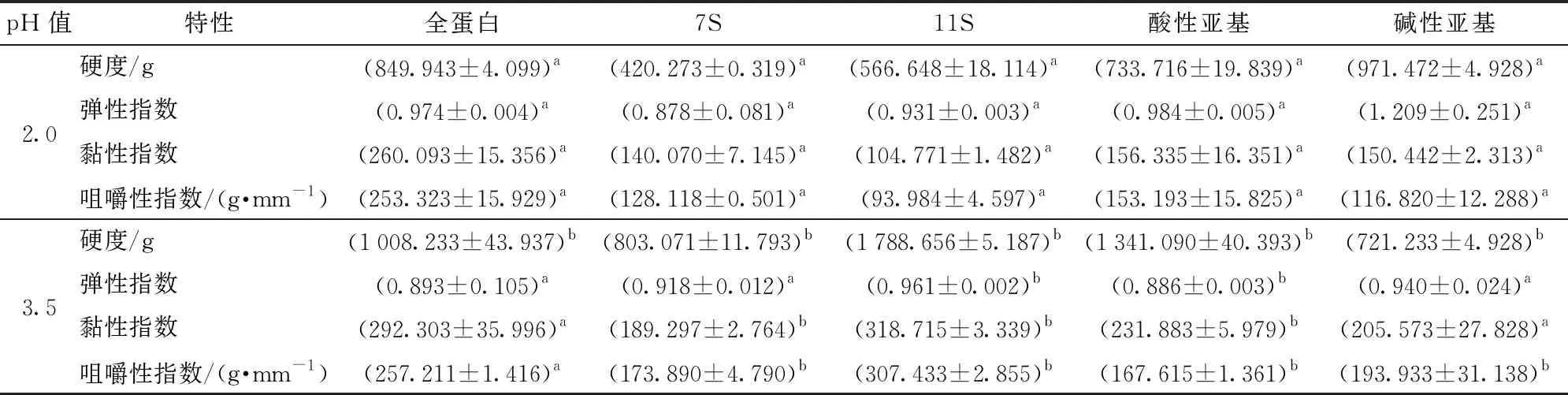
表1 不同样品的质构特性比较Tab.1 Comparison of textural properties of different samples
注:不同pH值同一参数a、b表示差异显著(P<0.05)。
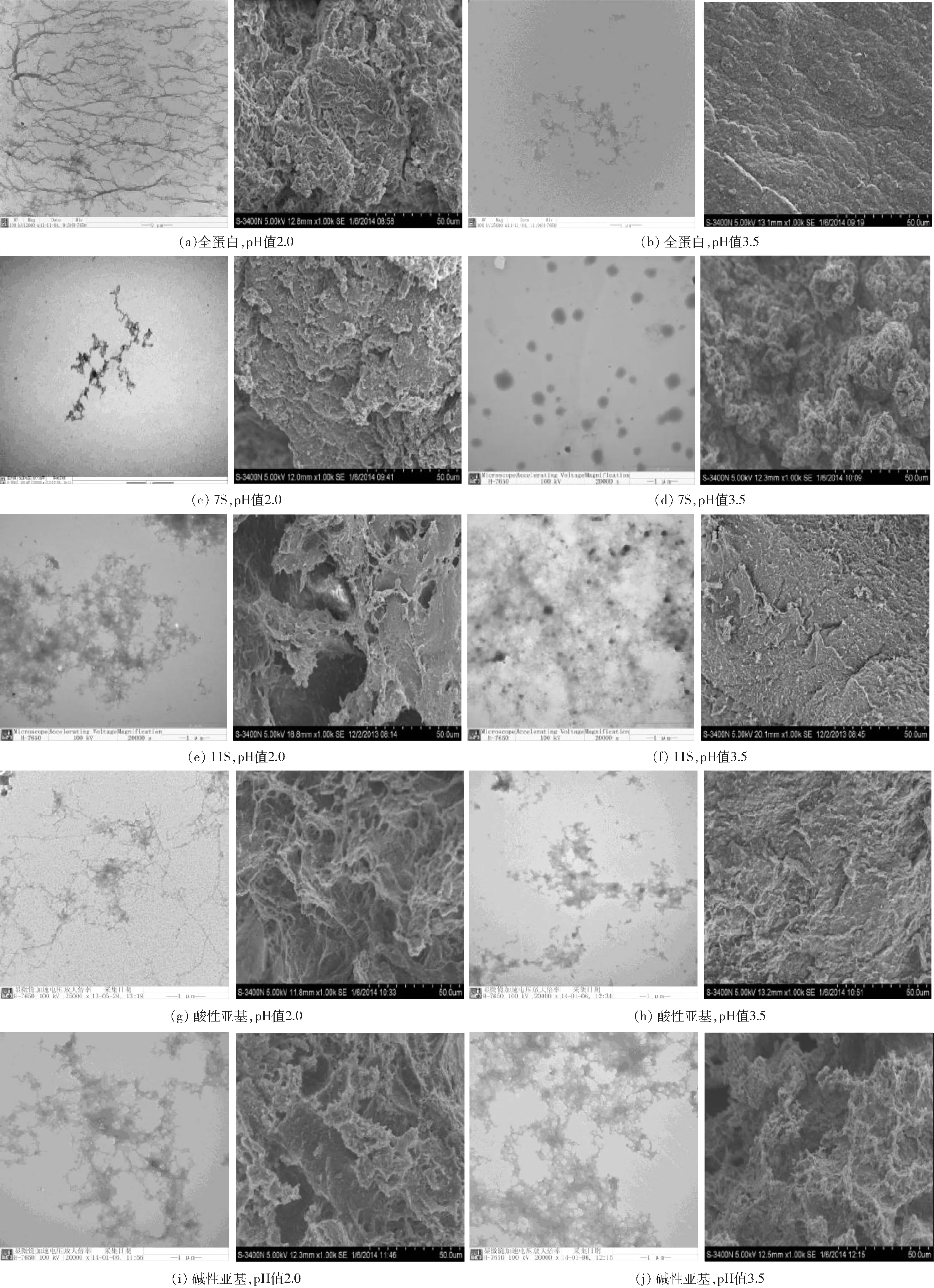
图2 不同pH值的各种蛋白加热的透射电镜和扫描电镜图像Fig.2 Transmission electron microscopy images and SEM pictures of aggregates with different morphologies formed by heating proteins under different conditions
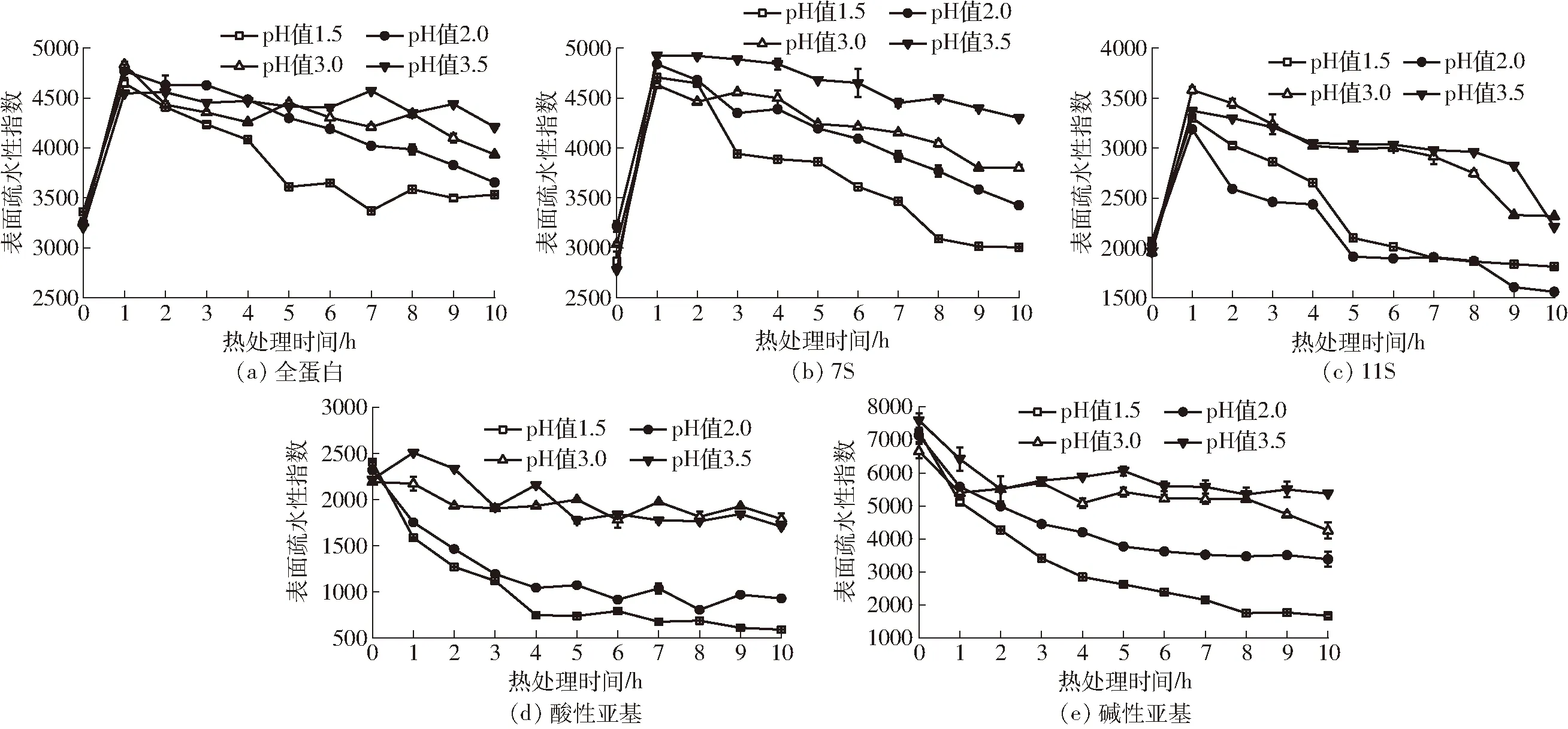
图3 不同蛋白样品表面疏水性变化曲线Fig.3 Surface hydrophobic change of different protein samples
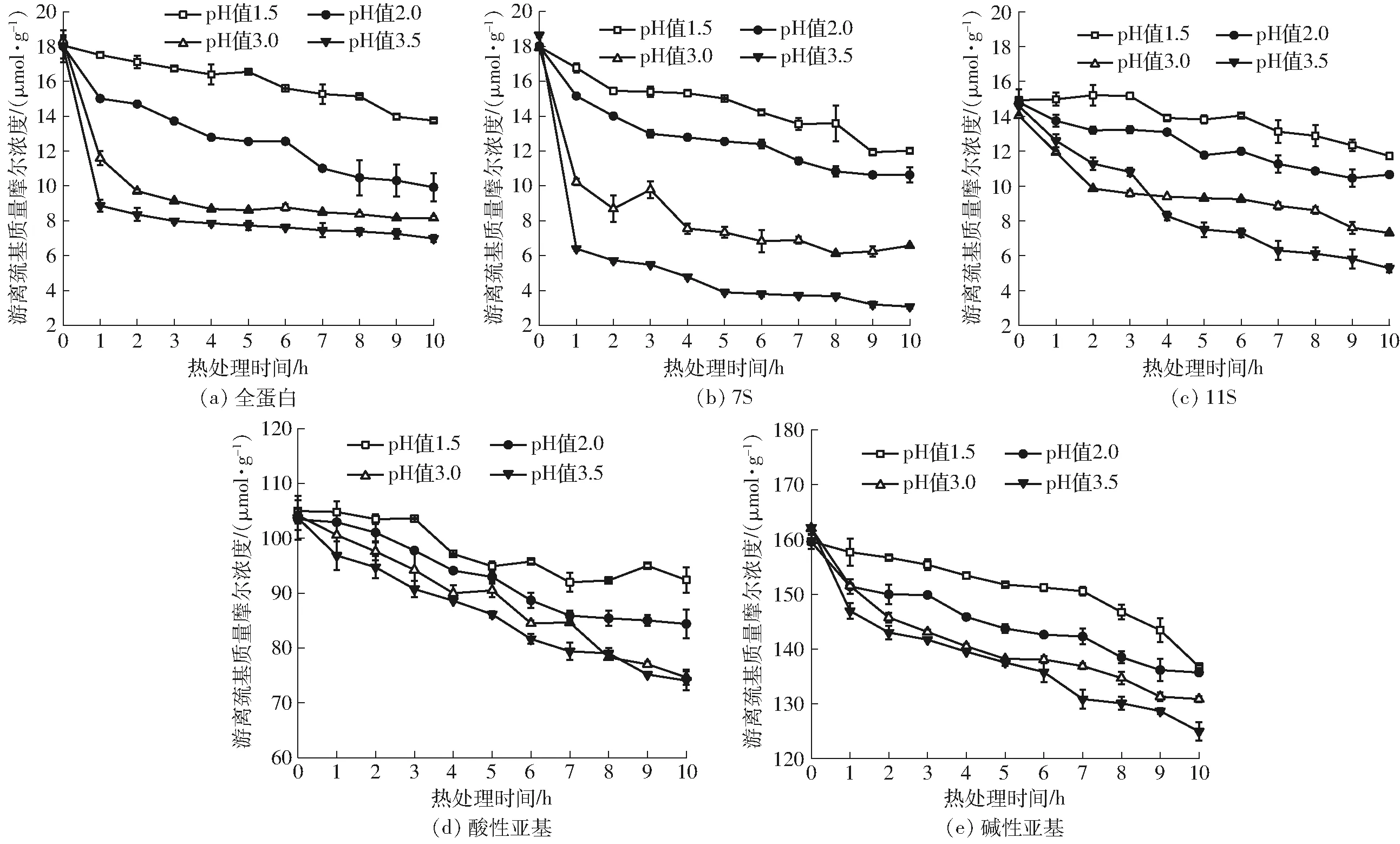
图4 不同蛋白样品的游离巯基变化曲线Fig.4 Free sulfhydryl group change of different protein samples
对于共价键-二硫键的变化而言,在不同大豆蛋白样品中,热处理带来的游离巯基变化规律是一致的,都有明显下降趋势且从小到大依次为pH值3.5、pH值3.0、pH值2.0、pH值1.5(图4)。其中酸性亚基和碱性亚基由于在分离过程中加入β-巯基乙醇的作用,断开了二硫键,其游离巯基的含量明显高于可溶性全蛋白和7S、11S(图4)。但是其变化规律仍然一致。在加热的过程中游离巯基相互结合形成二硫键,造成游离巯基的数量减少,pH值越低的样品其减小程度越小。低pH值条件下形成的细链凝胶其二硫键作用相对颗粒凝胶要弱,即相对颗粒凝胶共价作用弱,非共价作用较强。
3 结论
(1)低pH值会带来不同大豆蛋白组分聚合结构及凝胶形态的差异,多数大豆蛋白组分在pH值2.0时形成柔长细链状的细链凝胶,7S和酸性亚基纤维化明显,pH值3.5时多为颗粒形、短簇片状的颗粒凝胶。
(2)pH值在等电点以下的变化会带来大豆蛋白组分热聚合结构的改变,进而产生功能性质的变化,细链凝胶表观粘度降低幅度较颗粒凝胶大,硬度相对较低。
(3)细链凝胶的形成中主要作用力是疏水相互作用,二硫键的作用很弱。相反,在颗粒凝胶的形成中,二硫键的作用较细链凝胶强,非共价键作用弱。
