不同Ca2+源、Mg2+源对固态发酵产纳豆激酶的影响
2019-12-30陆丽霞熊晓辉
孟 健,陆丽霞,熊晓辉
(南京工业大学 食品与轻工学院,江苏 南京 211800)
传统溶栓药物如尿激酶、链激酶等具有人体内半衰期短、口服无效、易出血等缺点。1987年,日本科学家Sumi等[1]从纳豆食品中分离到具有强烈纤溶活性的物质,并命名为纳豆激酶(nattokinase,NK),NK有望弥补传统溶栓药物的不足,具有较大的开发潜能,成为新一代抗栓药物[2-4],也可开发为优良的保健食品。由于微生物种类多,繁殖快,容易培养,生长条件易于控制,提取工艺也较简单,且随着老年人口增加及运动、饮食的影响,发生血管栓塞人数不断增加,因此,近年来微生物源溶栓药物的研发受到广泛重视[5-6]。微生物溶栓药物的研发,旨在提高药物的医用价值,关键在于提高溶栓药物中发挥主要作用的酶活性。研究表明,适当离子浓度对固态发酵纳豆激酶活力有促进作用,如金属离子Ca2+、Mg2+对纳豆激酶的纤溶活性的提高有不同程度的作用[7]。如刘诚[8]通过研究发现,Mg2+对酶活的提高有作用;李妍[9]经过研究发现,Ca2+、Mg2+、Na+和K+会对酶活的提高有作用。已有的报道主要是研究不同离子对酶活性的影响,本文中,笔者在已有研究的基础上,研究3种不同Ca2+、Mg2+源对固态发酵产纳豆激酶的影响,以确定最佳的Ca2+、Mg2+源和最佳添加量水平,获得高酶活的纳豆产品。
1 材料与方法
1.1 材料与试剂
枯草芽孢杆菌(Bacillussubtilis),保存于笔者所在实验室。
蛋白胨、胰蛋白胨、牛肉膏、营养琼脂,北京奥博星生物技术有限责任公司;NaCl(分析纯,下同)、可溶性淀粉、CaCl2(食品级)、 NaH2PO4、Na2HPO4、K2HPO4、KH2PO4,西陇化工股份有限公司;酵母浸膏、HCl(分析纯)、NaOH(分析纯),国药集团化学试剂有限公司;乳酸钙(CaC6H10O6·5H2O食品级)、CaCO3(食品级),广东汕头市西陇化工厂;MgSO4(食品级)、MgCl2(食品级)、MgCO3(食品级),连云港科德化工有限公司;牛纤维蛋白(74 mg/支)、凝血酶(160 BP/瓶)、尿激酶(1 240 IU/瓶),中国药品生物制品检定所。
1.2 仪器与设备
全温摇瓶柜,太仓市强乐实验设备有限公司;真空冷冻干燥机,北京博医康实验仪器有限公司;恒温恒湿培养箱,广东省医疗器械厂;SW-CJ-1F型单人双面净化工作台,苏州净化设备有限公司;电热鼓风干燥箱、立式压力蒸汽灭菌锅,上海博迅实业有限公司设备厂;XJA-100A型高速粉碎机,上海标本模型厂。
1.3 实验方法
1.3.1 酶活标准曲线的制作
纳豆激酶(NK)活力的测定是以其相对于尿激酶的活力单位来表示的,故需要建立尿激酶的活力单位与纤维蛋白平板溶圈大小间的相关性[10]。
以不同活力单位的尿激酶溶液为标准,制作标准曲线。将尿激酶标准品用pH 7.4的磷酸盐缓冲液依次稀释至6.25、12.5、25.0、50.0、100.0、150.0、200.0 IU/mL,分别用微量进样器各取10 μL尿激酶溶液点样于制作好的纤维蛋白平板上。放入37 ℃恒温培养箱中反应18 h,然后分别测定纤维蛋白溶解圈的2个垂直直径,计算其乘积近似为纤维蛋白溶解圈的面积,并根据尿激酶的活力单位与纤维蛋白溶解圈的面积绘制酶活标准曲线。
1.3.2 纳豆的制备
洗净后的豆子与水按1∶ 1的体积比浸泡适当时间后,加入2%可溶性淀粉,0.5%酵母膏,搅拌至充分溶解后,调节pH(7.2~7.4)。在121 ℃下灭菌40 min,灭菌结束后取出,冷却至室温后,接种5%种子培养液,搅拌均匀后,37 ℃下发酵培养24 h,发酵结束后在冷冻干燥机上预冻结,冻结完成后干燥36 h即可[11-12]。
1.3.3 纳豆激酶活力测定
按1.3.2节的方法制备纳豆,发酵结束后的纳豆经打磨成糊粉状,称取2 g糊粉状纳豆溶于18 mL生理盐水中,适当稀释即为粗酶样液。微量进样器取待测NK样液10 μL,点样于纤维蛋白平板上,同时将一定单位的标准尿激酶溶液点样于纤维蛋白平板上作为对照,放入37 ℃恒温培养箱中反应18 h,然后分别测定纤维蛋白溶解圈的2个垂直直径,计算其乘积近似为纤维蛋白溶解圈的面积。
溶解圈面积直接反映了酶活力的相对大小,将NK溶解圈面积与标准的尿激酶UK的溶解圈面积相比较,得出NK相当于尿激酶活性单位(IU/mL)。NK活性计算见式(1),纳豆粉的酶活性计算见式(2)。
(1)
(2)
式中:m表示称取糊粉状纳豆的质量(g),V表示纳豆粉与生理盐水溶液的总体积(mL)。
1.3.4 活菌数测定方法
取4 g发酵结束后的纳豆置于装有36 mL无菌生理盐水的三角瓶中,振荡混匀后,制成1∶ 10的样品液,移液枪吸取1 mL样液依次做10倍系列稀释,选用适宜的稀释倍数,吸取1 mL稀释液于无菌平板上,平板倒入适量的培养基液,迅速混匀,做3个平行培养皿。待凝固后倒置,37 ℃恒温培养24 h。选用菌落数在30~300的培养皿,进行菌落计数[13]。
1.3.5 不同Ca2+及添加量对固态发酵产纳豆激酶的影响
以CaCl2、CaCO3、CaC6H10O6·5H2O为Ca2+源,配制不同添加量水平的豆子样液,于250 mL的三角瓶中进行摇床发酵,同时做平行,考察不同Ca2+源及添加量对固态发酵产纳豆激酶的影响[14]。培养基其他成分、培养条件同1.3.2节纳豆的制备。以不添加离子源的实验组为空白组。Ca2+的添加量水平按混合后豆子与水质量总和的质量百分比计算。
1.3.6 不同Mg2+及添加量对固态发酵产纳豆激酶的影响
以MgCl2、MgCO3、MgSO4分别为Mg2+源,具体方法、培养条件参照方法1.3.5节。
1.3.7 纳豆的感官评价
感官评价人员12人,得分是去掉1个最高分和1个最低分取平均分。不同Ca2+源、Mg2+源制成的纳豆通过产品的颜色、香气、滋味、组织形态4个指标来进行感官评定,每个指标满分为10分。感官评价标准[15]见表1。

表1 纳豆产品的感官评定标准
2 结果与讨论
2.1 酶活标准曲线
尿激酶酶活标准曲线如图1所示。

图1 尿激酶标准曲线Fig.1 Standard curve for urokinase
从图1中可以看出,尿激酶的酶活与其溶解圈的面积成线性关系,其方程为:y=0.004 3x+0.136 9(x表示纳豆激酶相对酶活性,y表示平板溶解圈的面积),相关系数R2=0.993 4。根据此线性方程,可以计算出纳豆中纳豆激酶的相对尿激酶活性。
2.2 不同Ca2+及添加量对固态发酵产纳豆激酶的影响结果
不同Ca2+及其不同添加量对固态发酵产纳豆激酶的影响如图2~4所示。

图2 不同CaCO3添加量对固态发酵产 纳豆激酶及菌体量的影响Fig.2 Effects of different additions of CaCO3 on the growth of nattokinase and amount of bacteriaby solid-state fermentation
由图2可以看出:随着CaCO3添加量的增加,纳豆激酶活力和菌体量呈现出先上升后下降的趋势。当CaCO3添加量0.4%时,此时纳豆激酶活性达到9 100 IU/g,同时菌体量达到6.3×107CFU/g;之后,随着CaCO3添加量的增加,纳豆激酶活性、菌体量呈现下降的趋势,表明以CaCO3作为Ca2+源,最佳添加量为0.4%,在该添加量下,纳豆激酶活性较空白组的酶活性(6 260 IU/g)相比提高了45%。

图3 不同CaCl2添加量对固态发酵产 纳豆激酶及菌体量的影响Fig.3 Effects of different additions of CaCl2 on the growth of nattokinase and amount of bacteria by solid-state fermentation
由图3可以看出:CaCl2作为Ca2+源,CaCl2添加量对纳豆激酶活性、菌体量有一定的影响。CaCl2添加量水平低于0.04%,利于酶的分泌合成、菌体的生长、繁殖;当CaCl2添加量继续增加,纳豆激酶活性、菌体量逐渐下降。表明CaCl2作为Ca2+源,最佳的添加量为0.04%,此时的纳豆激酶活性达到7 786 IU/g,比空白组的酶活力4 960 IU/g提高了57%,菌体量达到5.4×107CFU/g。

图4 不同乳酸钙添加量对固态发酵产 纳豆激酶及菌体量的影响Fig.4 Effects of different additions of calcium lactate on the growth of nattokinase and amount of bacteria by solid-state fermentation
由图4可以看出:乳酸钙作为Ca2+来源,随着添加量的增加,纳豆激酶活性和菌体量呈现出先上升后下降的趋势。当添加量为0.3%时,纳豆激酶活性8 453 IU/g,比空白组的酶活性6 260 IU/g提高了35%,菌体量达到8.6×107CFU/g,此时的酶活性最高、菌体量最多,利于发酵过程中酶活的分泌合成,菌体的生长繁殖。
3种最佳添加量水平的Ca2+源制备的纳豆,在酶活提高效果方面,CaCO3、CaCl2制备的纳豆激酶活性提高率高于乳酸钙制备的纳豆,表明在发酵过程中,CaCO3、CaCl2作为Ca2+源更能促进纳豆激酶的分泌合成;从菌体量方面来看,菌体量总数差异不大。选用0.04% CaCl2为Ca2+源为宜,酶活提高效果最高。
2.3 不同Mg2+及添加量对固态发酵产纳豆激酶的影响结果
不同Mg2+及不同添加量对固态发酵产纳豆激酶的影响如图5~7所示。

图5 不同MgCl2添加量对固态发酵产 纳豆激酶及菌体量的影响Fig.5 Effects of different content of MgCl2 on the growth of nattokinase and amount of bacteria by solid-state fermentation
由图5可以看出:以MgCl2作为Mg2+源,随着MgCl2添加量的增加,纳豆激酶活性总体上有所提高,菌体量逐渐增加。当添加量为0.06%时,纳豆激酶活性相对较高,达到6 040 IU/g,比空白组的酶活性4 981 IU/g提高了21%,菌体量达到9.6×107CFU/g;MgCl2添加量超过0.08%之后,纳豆激酶活性较空白组相比有所下降,菌体量降低,同时MgCl2添加量低于0.04%,对纳豆激酶活性、菌体量提高效果不明显。说明以MgCl2作为Mg2+源,MgCl2适宜的添加量范围为0.04%~0.08%。考虑到菌体量、生产成本因素,选用0.06% MgCl2为Mg2+源。
图6中,以MgCO3作为Mg2+源,随着MgCO3添加量的增加,纳豆激酶活性呈现出先上升后下降的趋势。MgCO3添加量达到0.16%时,纳豆激酶活性最高可达8 704 IU/g,比空白组的酶活性6 188 IU/g提高了40%,菌体量达到4.8×107CFU/g。不过,随着添加量的增加,菌体量逐渐降低,说明以MgCO3作为Mg2+源发酵制备纳豆,对菌体的生长繁殖有一定的抑制作用。

图6 不同MgCO3添加量对固态发酵产 纳豆激酶及菌体量的影响Fig.6 Effects of different content of MgCO3 on the growth of nattokinase and amount of bacteria by solid-state fermentation
从图7中可以看出:以MgSO4作为Mg2+源,随着添加量的增加,纳豆激酶活性和纳豆菌呈现出先上升后下降的趋势,MgSO4添加量达到0.72%时,此时纳豆激酶活性达到10 591 IU/g,比空白组的酶活性6 188 IU/g提高了71%,菌体量达到7.8×107CFU/g,效果最佳。之后,随着添加量的继续增加,纳豆激酶活性、菌体量呈现下降的趋势,表明当以MgSO4作为Mg2+源,MgSO4最佳添加量是0.72%。

图7 不同MgSO4添加量对固态发酵产 纳豆激酶及菌体量的影响Fig.7 Effects of different content of MgSO4 on the growth of nattokinase and amount of bacteria by solid-state fermentation
3种最佳添加量水平的Mg2+源制备的纳豆,在酶活提高效果方面,MgSO4、MgCO3制备的纳豆激酶活明显高于MgCl2制备的纳豆,不过MgCO3作为Mg2+源发酵制备纳豆,对菌体的生长繁殖有一定的抑制作用。选择0.72% MgSO4为Mg2+源为宜,纳豆激酶酶活提高效果最好。
2.4 纳豆的感官评价结果
不同离子源制备的纳豆产品通过产品的颜色、香气、滋味、组织形态4个指标来进行感官评定,每个指标满分为10分,结果如表2。
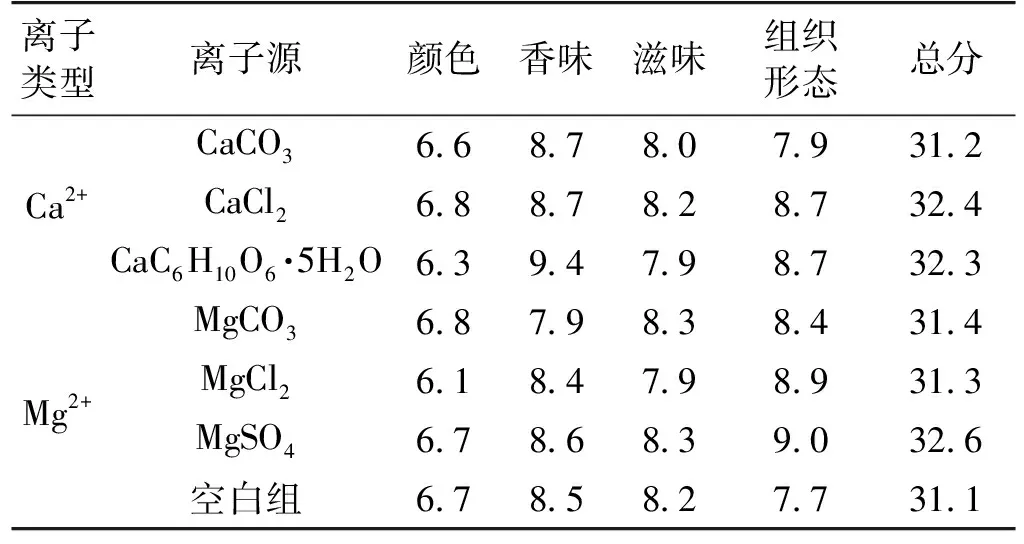
表2 不同离子源制备的纳豆感官评价
不同离子源制备的纳豆产品在感官上有所差异。由表2可以看出:以不同离子源制备的纳豆制备感官评分总分与空白组相比相差不大。不过在单项评分上有明显的差异。在香气方面,以CaC6H10O6·5H2O为Ca2+源制备的纳豆,有纳豆特有的香气,而CaCO3、CaCl2、空白组制备的纳豆略带有氨味;在组织形态方面,CaCl2、CaC6H10O6·5H2O制备的纳豆有很多的黏细丝,而CaCO3、空白组制备的纳豆的黏细丝相对较少;在纳豆颜色和滋味方面,3种Ca2+制备的纳豆与空白组之间相差不大。不同Mg2+源制备的纳豆在纳豆颜色方面,都呈黄色、微红,彼此相差不大,和空白组制备的纳豆颜色基本相符;在香气方面,MgCO3制备的纳豆略带氨味,明显不如MgCl2、MgSO4、空白组制备的纳豆有特有的香气;在滋味方面,MgCl2制备的纳豆不如MgCO3、MgSO4、空白组制备的纳豆酥软、湿滑,口感不佳;在组织形态方面,MgSO4制备的纳豆相比于其他2种Mg2+源、空白组制备的纳豆,有较多细长的黏丝。综合考虑上述研究的纳豆激酶活提高效果、菌体量、纳豆的感官评价结果、生产成本等因素,选用0.04% CaCl2为Ca2+源,0.72% MgSO4为Mg2+源发酵制备纳豆。
3 结论
综合考虑纳豆功能性成分、纳豆感官评价结果、节约成本等方面,得出CaCl2为最佳Ca2+源,最佳添加量0.04%,制备的纳豆激酶活性达到7 786 IU/g,相比空白组酶活性提高了57%,菌体量为5.4×107CFU/g;MgSO4为最佳Mg2+源,最佳添加量0.72%,制备的纳豆激酶活性达到10 591 IU/g,相比空白组酶活性提高了71%,菌体量达到7.8×107CFU/g。感官评价结果显示,以不同离子源制备的纳豆制备感官评分总分与空白组相比无显著差异,单项指标上有差异。CaCl2制备的纳豆虽略带有氨味,但有很多的黏细丝;MgSO4制备的纳豆酥软、湿滑,口感较佳,且有很多的黏细丝。
