叶酸靶向载MMP-2反义寡核苷酸磁性纳米复合物在喉癌细胞中的分布及靶向性研究*
2019-12-30黄水仙许熠铭朱瑾谢民强李勇管明伏晓
黄水仙 许熠铭 朱瑾 谢民强 李勇 管明 伏晓
随着细胞生物学技术的发展,肿瘤的基因治疗在临床得到广泛应用。基因治疗的原理是采用基因转移技术将正常目的基因导入靶细胞,使其表达特定的蛋白质。磁性纳米颗粒可将基因治疗分子携入细胞并释放,实现安全有效的靶向性基因治疗作用,并可缩短转染时间、提高转染效率,而且磁性纳米载体有被动靶向、磁靶向和分子靶向等靶向性能,在肿瘤靶向治疗方面有一定优势。本研究将MMP-2-ASODN与醛基化海藻酸钠(ALG)改性的叶酸靶向磁性纳米载体耦联,制备叶酸靶向载MMP-2-ASODN磁性纳米复合物。然后以喉癌Hep-2细胞株及其BALB/c裸鼠皮下移植瘤作为相应模型,采用透射电镜、普鲁士蓝铁染色及MRI成像技术检测MMP-2-ASODN磁性纳米复合物对喉癌细胞的体内、外靶向性,为后续喉癌基因靶向治疗打下前期实验基础。
资料与方法
1主要药物、试剂与仪器
叶酸(美国Sigma公司),ALG(山东青岛水产有限公司)。RCT bssic磁力搅拌器(德国IKA公司),DDS-11A数显电导率仪(上海雷磁新泾仪器公司),日本电子株式会社提供的透射电子显微镜(型号JEM-100CX II),美国Varian公司提供的石墨炉(型号GFA-Ex7i)及铁空心阴极灯,美国GE公司提供的超导型双梯度磁共振成像仪(型号GE 1.5 T),1英寸手指线圈。人喉鳞状细胞癌细胞株Hep-2(中南大学湘雅医学院细胞库),BALB/c裸鼠(南方医科大学实验动物中心)。
2 实验方法
2.1 叶酸靶向载MMP-2-ASODN磁性纳米复合物的制备
2.1.1 MMP-2-ASODN的设计和合成
利用Primer5.0软件,根据人MMP-2基因cDNA序列设计与启动子互补的反义寡核苷酸序列(antisenes oligodeoxynucleotide,ASODN),经 Genbank 同源性检测证实该ASODN仅与MMP-2基因相应位点匹配,与其它人类基因无匹配。同时设计与其碱基组成相同,但碱基顺序随机排列的无义寡核苷酸序列(nonsense oligodeoxynucleotide,NSODN)作为对照,经Genbank检测与任何已知人类基因无匹配。ASODN和无义寡核苷酸序列的碱基采用硫代修饰以增强稳定性,5’端用氨基修饰以便下面实验连接磁性纳米粒子。反义寡核苷酸和无义寡核苷酸均由上海生工公司合成,双蒸水稀释至100μmol·L-1,-20℃保存备用。
寡核苷酸序列如下:
MMP-2 ASODN:5'-CAC ACC TTG CCA TCG-3'
MMP-2 NSODN:5'-CGT CCC TAT ACG ACC-3'
2.1.2 制备叶酸靶向载MMP-2-ASODN磁性纳米复合物
我们课题组前期已成功制备了醛基化ALG修饰的磁性纳米粒子,流体力学直径为48.7±1.7nm,Zeta电位:-66.43±1.22mv,磁核平均粒径8.116±0.24nm,其最大饱和磁化强度为56.2emu·g-1,矫顽力为零,其磁强度及超顺磁性均较好。根据文献报道的方法[1,2]合成 NH2-PEG-FA。取 100μL 醛基化ALG修饰的磁性纳米颗粒,然后加入30μL叶酸修饰的氨基聚乙二醇溶液(12mg·300μL-1) 和 20μL 100μmol·L-1的 Hpa AS-ODN,涡旋均匀后,于 4℃条件下避光反应24小时。然后再加入一定量的硼氢化钠溶液,使体系中硼氢化钠的浓度为0.5mol·L-1。
2.2 叶酸含量的测定
叶酸分子包含高度共轨的苯环结构,在365nm处存在特征性的强吸收峰,因此利用这个特点可采用紫外分光光度计测量样品中的叶酸含量[2]。
2.3 纳米复合物体外靶向性实验
2.3.1 细胞铁染色
选取培养较好的两组Hep-2细胞,其中一组预先叶酸封闭,经消化离心后将其制成单细胞悬液(采用无叶酸RPMI-1640全培养基),调整其浓度至2×104个·ml-1后分别接种于 24 孔板内,500μl/孔。贴壁培养24h,每株细胞各取6孔加入50ul叶酸PBS溶液(孔内游离叶酸终浓度1mmol·L-1),作用30分钟。加入无叶酸RPMI-1640稀释的纳米药物培养2h,按铁含量计药物终浓度依次为0,2.5,5,10,20μg·ml-1。使用 PBS 液充分洗涤残留药物粒子,4%多聚甲醛溶液室温下固定10分钟。采用普鲁士蓝液染色,室温静置30min并避光,使用双蒸水洗涤后采用中性红染液复染。倒置显微镜下观察。
2.3.2 透射电镜观察
选取培养较好的两组Hep-2细胞,其中一组预先叶酸封闭,经消化离心后将其制成单细胞悬液(采用无叶酸RPMI-1640全培养基),调整其浓度至5×104个·ml-1分别接种于 6 孔板内,2ml/孔;贴壁培养24h后,加入无叶酸RPMI-1640稀释的纳米药物培养2h,按铁含量计药物终浓度依次为0、2.5、5、10、20μg·ml-1;使用 PBS 液充分洗涤残留药物粒子;将胰蛋白酶加入各孔并在消化后制成单细胞悬液,1500rpm离心5分钟后收集底部沉淀的细胞块,向其中加入2.5%戊二醛下固定(温度4℃);低速离心除去固定液并用1%饿酸固定,采用梯度丙酮进行脱水,使用环氧树脂包埋。取超薄切片,枸橼酸铅和醋酸双氧铀染色,观察细胞吞噬纳米药物在透射电镜下的情况(中山大学北校区电镜室)。
2.4 MRI观察裸鼠移植瘤内纳米复合物的分布
2.4.1 喉癌移植瘤动物模型的建立
选取5周龄BALB/c裸鼠6只,在SPF环境下(中山大学实验动物中心动物实验部,场地合格许可证号SYXK粤2007-0081)经适应性饲养1周后,将对数生长期的人喉癌Hep-2细胞以5×107个·ml-1的密度分别接种于裸鼠腋后背部皮下,每只接种0.2ml。
2.4.2 MRI及透射电镜观察纳米复合物在裸鼠移植瘤内的分布
接种Hep-2细胞的裸鼠移植瘤长至直径10mm左右后进行MRI观察。裸鼠以1%戊巴比妥钠经腹腔注射麻醉以减少成像过程中的肢体活动。首先进行MR T2加权成像(T2 W1),然后经尾经脉注射叶酸修饰的纳米药物0.2ml,继续饲养2小时后再次行MR成像。
MRI采用Philips Quasar Dual 3.0T MR Achieva磁共振仪完成,选择头部线圈,成像系数TR/TE 1900/62ms,矩阵 512×512,FOV115mm,层厚 1mm,层距0.5mm。
MRI检查结束后裸鼠脱颈处死,迅速取出瘤块,1%饿酸固定,采用梯度丙酮进行脱水,使用环氧树脂包埋。取超薄切片,枸橼酸铅和醋酸双氧铀染色,观察细胞吞噬纳米药物在透射电镜下的情况(中山大学北校区电镜室)。
3 统计学分析
采用SPSS 19.0软件处理数据,计量资料以(±s)表示。P<0.05认为差异有统计学意义。
结果
1 叶酸含量的测定结果
以叶酸含量浓度(μg·ml-1)为纵坐标,吸光度(OD值)为横坐标,绘制叶酸含量标准曲线(见图1)。其回归方程式为y(叶酸含量)=112.08x-0.3832,R2=0.9996。根据样品OD值用回归方程式计算其叶酸含量,实验重复 3 次,计算均值为 930.5±8.57μg·ml-1。
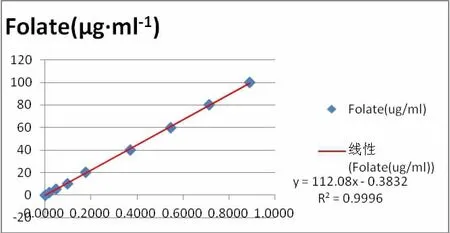
图1 叶酸含量标准曲线
2 纳米复合物体外靶向性实验结果
2.1 铁染色结果
铁染色结果显示,纳米复合物与Hep-2细胞培养2h后,大量的纳米颗粒被Hep-2细胞胞浆吞噬(图片上显示为蓝色颗粒),并且纳米复合物浓度越高,被吞噬的颗粒越多(见图2a、b)。而在预先给予叶酸封闭后,Hep-2细胞吞噬的纳米颗粒较相同浓度下未封闭时明显减少(图2c、d)。
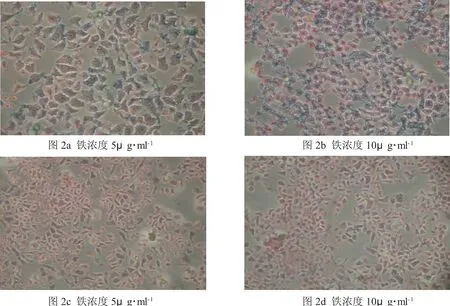
图2a、2b 铁染色结果显示Hep-2细胞胞浆内吞噬了大量的纳米颗粒(蓝色颗粒),并且随着纳米药物浓度增加,吞噬的颗粒越多(图 2a、b,400×)。图2c、2d 铁染色结果显示预先给予叶酸封闭后,Hep-2细胞吞噬的纳米颗粒较相同浓度下未封闭时明显减少(图2c、d,200×)。
2.2 透射电镜观察
两组Hep-2细胞与纳米复合物共培养2小时后进行透射电镜检测,结果见未经叶酸封闭处理的Hep-2细胞吞噬大量高电子密度的纳米颗粒,成团散布在细胞胞浆内(图3箭头表示)。而经叶酸封闭处理的Hep-2细胞仅吞噬少量高电子密度的纳米颗粒。
2.3 荷瘤裸鼠的MR成像结果
BALB/c裸鼠皮下种植Hep-2细胞成瘤后,在经尾静脉注射叶酸靶向磁性纳米复合物前和注射24小时后进行MRI成像,结果如图4所示,注射后瘤区T2信号显著降低。
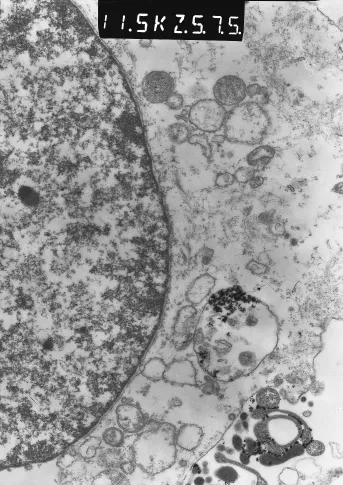
图3 透射电镜照片(11.5千倍)
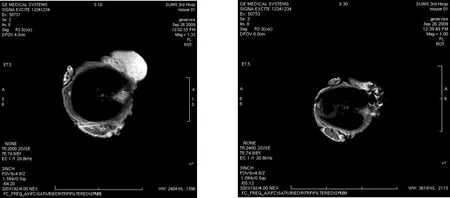
图4 荷瘤裸鼠的MRI成像结果(左为注射纳米药物前,右为注射后)
2.4 裸鼠移植瘤透射电镜检查结果
检查结果显示大量高电子密度的纳米颗粒被部分肿瘤细胞吞噬,并成团分布于细胞胞浆内;另有少量纳米颗粒存于细胞间隙(图5箭头表示)。

图5 透射电镜照片(15.5千倍)
讨论
基因治疗的原理是采用基因转移技术将正常目的基因导入靶细胞,使其表达特定的蛋白质。其中,ASODN技术是指利用人工合成的与DNA或mRNA某一区段互补的ASODN片断,通过碱基互补原则结合于目的基因上,从而封闭基因的表达,起到基因治疗的作用[3]。然而寡核苷酸因其自身负电荷导致较难穿过细胞膜,且易被核酸酶降解[4,5],因此ASODN需要一个基因载体来维护并提高其转染效率。目前常用的基因载体主要有病毒、非病毒载体[5,6]。病毒载体主要有慢病毒、腺病毒载体、反转录病毒等。病毒转染效率较高,但仍存有不足之处:病毒载体制备复杂;具有免疫原性及细胞毒性;携带DNA量少(4.5~30kbp);其宿主范围较为广泛,同时组织细胞特异性也较为缺乏;潜在的致瘤性会导致在重组过程中产生病毒感染[7]。非病毒载体目前应用最多的是脂质体,但是脂质体容易被细胞内外的水解酶消化、转染效率不高、组织特异性缺乏、有一定细胞毒性等[8]。不论是病毒载体还是脂质体,它们在肿瘤基因治疗中靶向性均不良,而基因载体在靶部位聚集较慢、靶部位载体浓度过低是导致基因传输及表达效率不高的主要原因[9]。
磁性纳米颗粒是一种新型非病毒基因载体,在肿瘤靶向治疗方面有一定优势。研究表明在细胞的吞噬作用下直径在100nm以下的磁性纳米颗粒可携带基因治疗分子进入细胞并释放,其靶向性基因治疗安全有效[10]。磁性纳米颗粒对肿瘤的靶向性主要有分子靶向、磁靶向、被动靶向。肿瘤组织新生血管内皮细胞排列不整齐且间隙较大、缺乏有效的淋巴引流系统形成被动靶向,纳米颗粒通过渗透增强和截留作用(enhanced permeability and retention effect,EPRE)更容易沉积在肿瘤组织中[11,12]。通过在外磁场的引导下使磁性纳米颗粒逐渐定向于肿瘤为磁靶向机制,使与磁性纳米药物搭载的治疗基因在肿瘤区域定位并集中释放,达到低毒、高效治疗的效果。研究表明,采用磁性纳米药物作为基因载体转染特定细胞或组织器官,可降低转染时间,转染率随之升高[13]。分子靶向是通过在纳米药物表面修饰针对肿瘤细胞特异靶点的配体(例如单克隆抗体或某些小分子),通过配体-受体的特异性结合使得纳米药物被肿瘤细胞摄取吞噬,从而达到靶向治疗的目的。此外,磁性纳米载体还具有无免疫原性、无遗传毒性与细胞毒性等优点。
文献显示叶酸受体在正常组织中很少表达,而在多种肿瘤组织中过度表达,是一种肿瘤相关抗原[14,15]。我们前面的实验也证实了叶酸受体在喉癌中高度表达。因此,我们在本实验中采用叶酸受体作为磁性纳米复合物主动靶向的靶点,通过在磁性纳米载体表面修饰叶酸,制备叶酸靶向载MMP-2-ASODN磁性纳米复合物。我们制备的纳米复合物粒径较小、含有亲水的改性表层,可有效的逃避网状内皮系统的吞噬,延长其体内循环时间,增加磁性纳米复合物的靶向效率。因此,这种叶酸靶向磁性纳米粒作为基因载体具有良好的稳定性和靶向性。
由于本纳米复合物以Fe3O4作为核心,因此实验中我们采用铁染色、MRI、透射电镜等容易显示铁粒子的方法来检测该叶酸靶向磁性纳米复合物的分子靶向性能。铁染色的原理是Fe3+在酸性条件下与亚铁氰化钾通过普鲁士蓝反应生成蓝色的亚铁氰化铁沉淀,定位于含铁的部位,可反映组织细胞内摄取的氧化铁纳米粒子的情况[16,17]。我们将不同浓度的叶酸靶向纳米复合物与Hep-2细胞共培养2h后进行铁染色检查,结果发现Hep-2细胞内吞噬了大量的纳米颗粒,其吞噬数量与药物浓度正相关,而预先给予叶酸封闭的Hep-2细胞同样吞噬了部分纳米颗粒,但是较之相同浓度下未封闭的Hep-2细胞显著减少。这说明叶酸靶向纳米复合物是通过叶酸受体途径的分子主动靶向作用,可以显著增加喉癌Hep-2细胞对纳米复合物的吞噬。透射电镜的观察也可明显看到Hep-2细胞对纳米复合物的吞噬。核磁共振成像(MRI)通过计算机将生物体不同组织在外磁场的作用下产生的共振信号还原为图像,能够立体的显示不同组织间的细小差别,是临床早期发现和诊断肿瘤的重要方法之一。超顺磁性纳米颗粒(superparamagnetic nanopatticles)是应用于MRI的新一代磁性造影剂。其磁化强度随磁矩值不同而改变,并且撤去外磁场后其磁化消失,其驰豫率(Relaxivity)显著高于钆螯合物类造影剂[18,19]。我们制备的叶酸靶向磁性纳米复合物具有超顺磁性,因此可以作为MRI造影剂。通过MRI检查可以发现注射后裸鼠移植瘤区域T2信号显著降低,说明经尾静脉注射的叶酸靶向纳米复合物具有良好的靶向性,同时具有MR阴性造影剂的效果,可以通过MRI检查进行药物分布的检测。
本研究成功制备了叶酸靶向载MMP-2-ASODN磁性纳米复合物,通过铁染色、MRI、透射电镜等检查证实,该纳米复合物对喉癌Hep-2细胞和裸鼠移植瘤具有良好的分子靶向性,为后续喉癌的基因治疗奠定了基础。
