基于DIS实验进行原电池电极电势变化的实验探究及其拓展
2019-12-30黄彦媚
欧 勇,黄彦媚
(华东师范大学 教师教育学院,上海 200062)
1 问题的提出
在人教版高中物理选修3-1第2章第7节“闭合电路的欧姆定律”[1]的备课过程中,参考文献[2]关于原电池实验的改进方案:用铜板和锌板作为两极,可乐作为电解液,外接最大阻值为99 999 Ω的电阻箱,用2只电压传感器分别测量外电压UAB和内电压UCD,电路图如图1所示,分别测量并记录断路状态、外电阻从20 000 Ω减小至0 Ω过程中的内、外电压,在处理数据时发现当外电阻减小至5 000 Ω后,内、外电压之和明显小于开路电压(即电源电动势),如表1所示. 更换电解液为0.005 mol/L的硫酸,仍出现类似结果,如表2所示. 笔者针对外电阻减小使得内、外电压之和小于电源电动势的问题进行了深入研究.
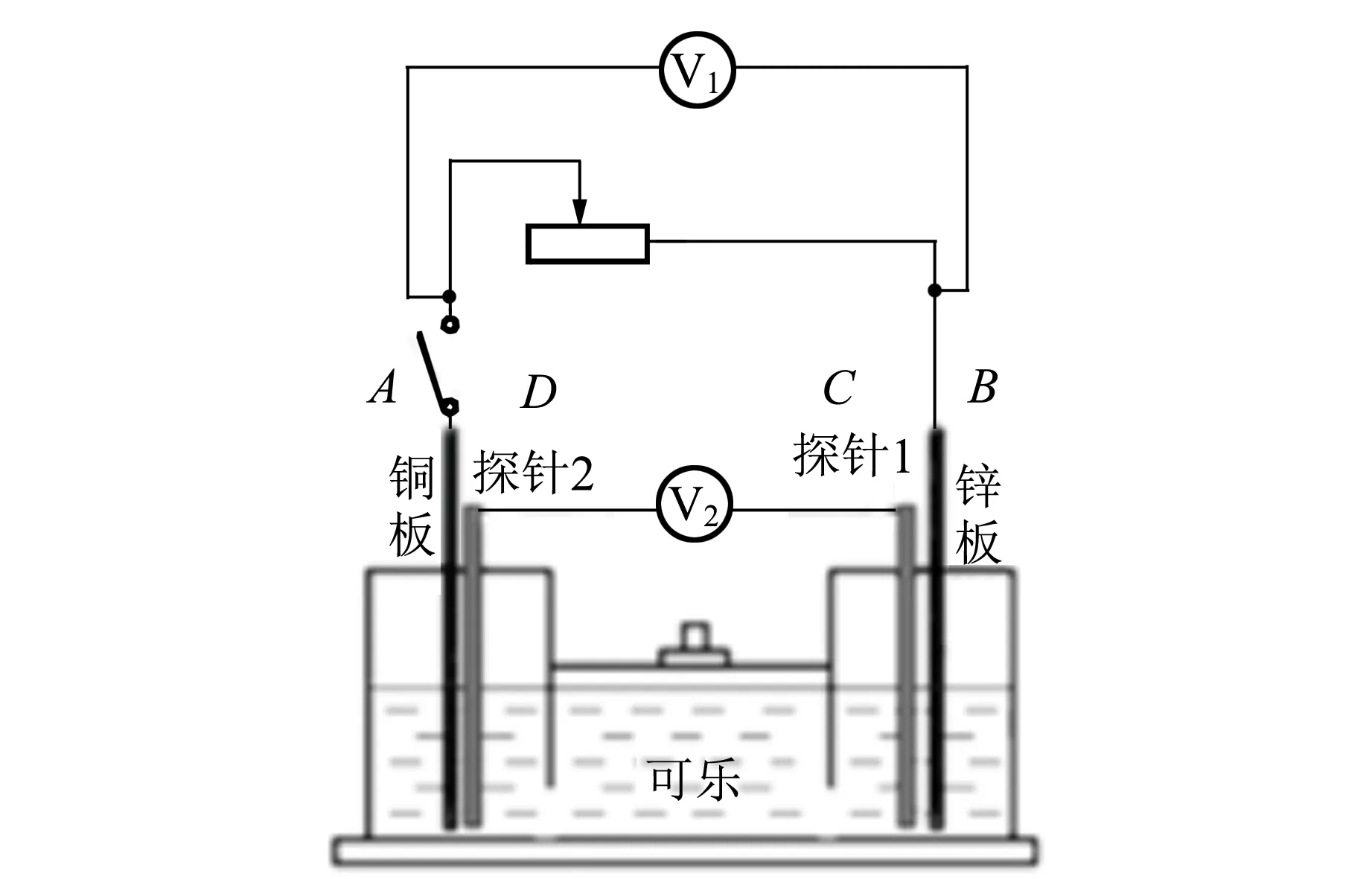
图1 DIS实验电路原理图
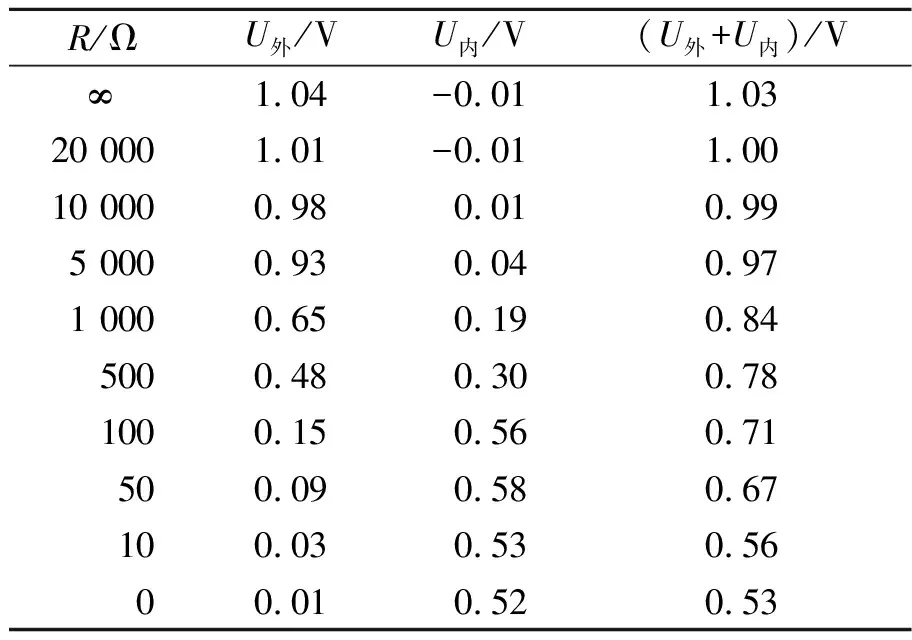
表1 内、外电压随外电阻的变化(电解液为可乐)
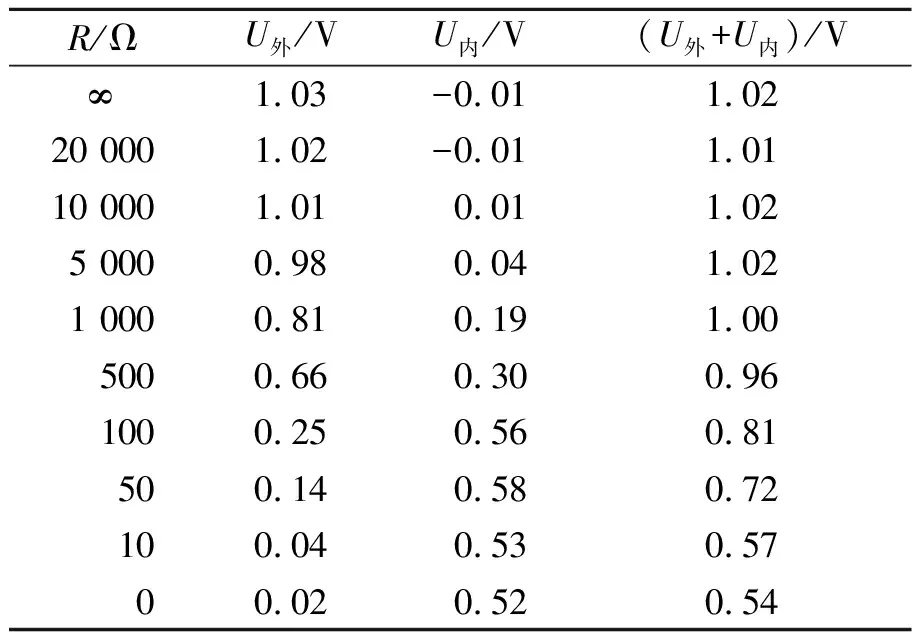
表2 内、外电压随外电阻的变化
2 实验装置及过程
实验仪器:铜锌原电池(电解液为可乐)、最大阻值为99 999 Ω的电阻箱、3只电压传感器、数据采集器、2根铜探针、1个开关、计算机、导线若干.
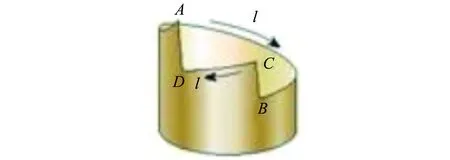
实验过程:根据图2所示的电路图,将铜锌原电池与电阻箱相连,以锌板作为零电势点,利用3只电压传感器分别测量并记录在减小电阻箱阻值的过程中,铜板、铜板附近的铜探针、锌板附近的铜探针这几处相对于锌板的电势差变化.
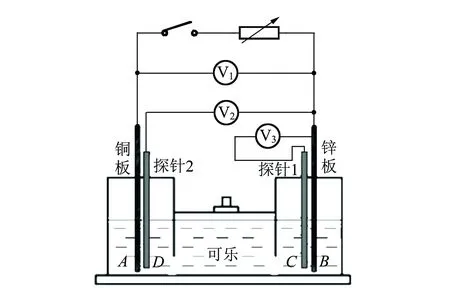
图2 DIS实验电路图
3 实验结果及讨论
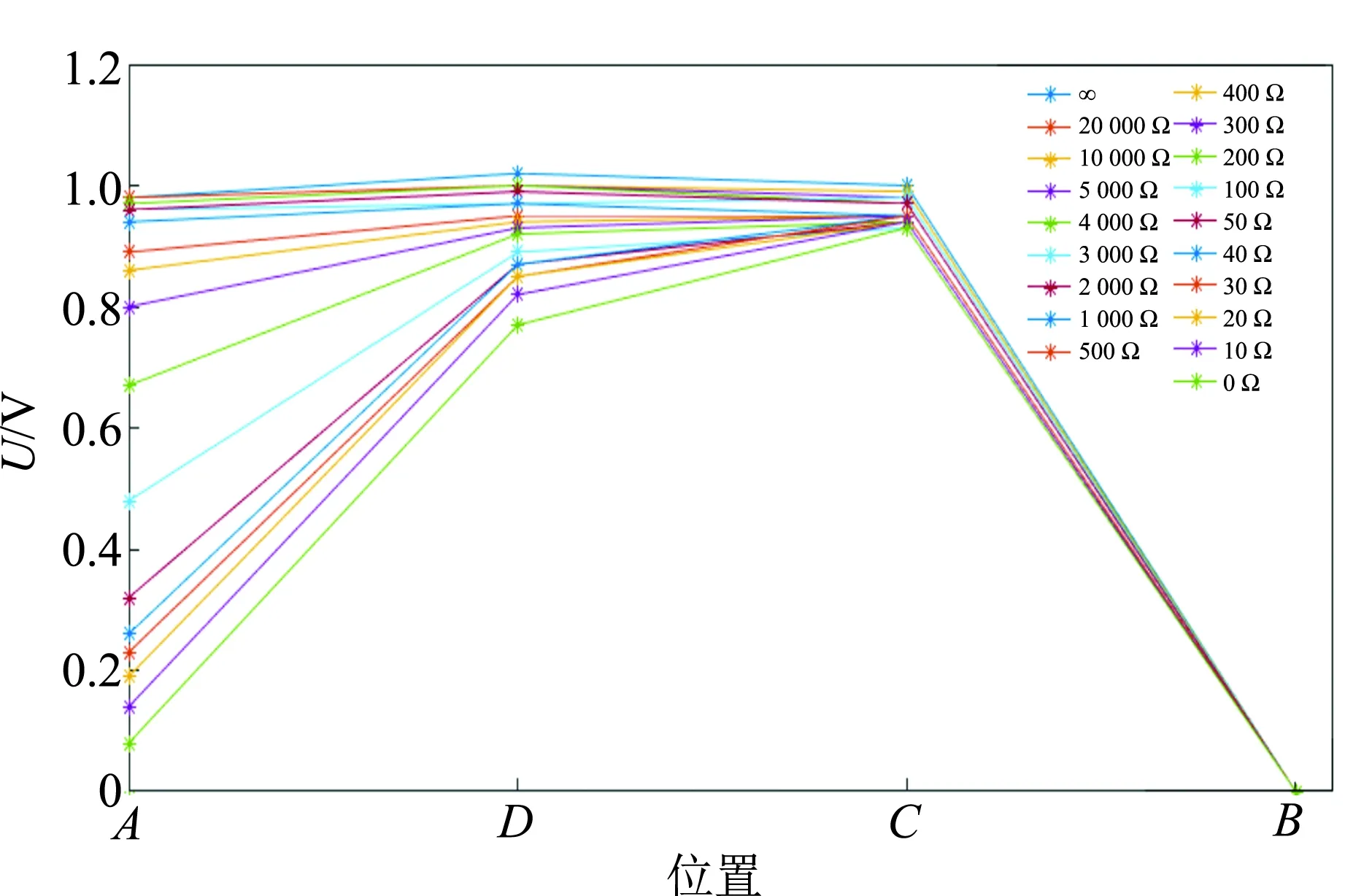
如图3所示,以B点为零电势点,将A,D,C3点电势随外电阻变化的图像以折线图形式画出,图中UCD即为内电压,UAB即为外电压. 从图3中可以发现:
1)断路状态时,UAD和UDC几乎为0;
2)电路接通,随外电阻减小,AD两点的电势都逐渐降低,并且A点的电势低于D点的电势;
3)UCB在误差范围内几乎不变.
根据上述实验结果,笔者认为出现“外电阻较小时,内、外电压之和小于电源电动势”这一现象的原因与AD两点的电势差变化有关:
a.当外电路断路时,AD两点的电势差几乎为0,则UCD(内电压)+UAB(外电压)=E(电动势);
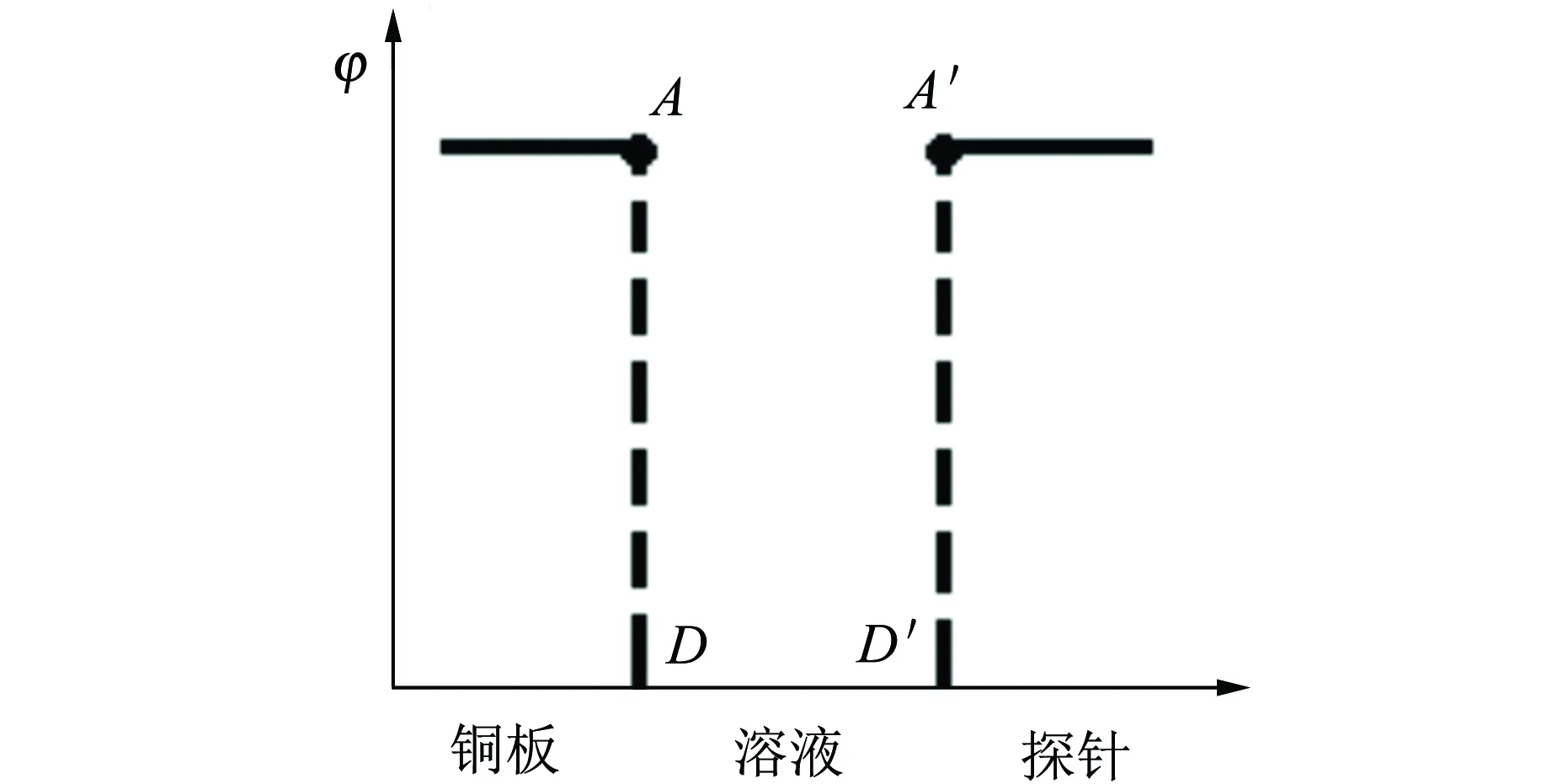
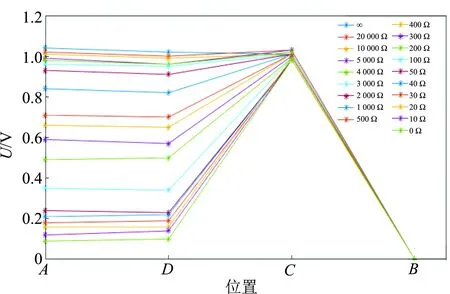
b.当外电阻较小时,AD两点的电势差为负值,则UCD(内电压)+UAB(外电压) 根据教材上的图(图4),铜板电势应该比溶液电势高,实验结果与之不符. 文献[3]指出,铜探针与电解液之间也存在电势差,即铜探针的电势φ探并非是溶液本身的电势φ液,即φ探≠φ液,而是φ探=φ液+U探-液. 所以电压传感器所测的UAD并非铜板与溶液的电势差,而是铜板(A)—溶液(D)—溶液(D′)—铜探针(A′)的电势差UAA′,如图5所示. 故在断路状态(或外电阻较大)时,所测的“UAD”(实际是UAA′)几乎为0. 图4 闭合电路的电势 图5 铜板与铜探针电势差示意图 通过查阅相关文献[4],提出了2个猜想. 1)由于铜板与铜探针之间存在电阻,有电流流过时,铜板与铜探针之间产生电势差. 由前所述,利用铜探针测量出的电势差并不是铜板与铜板附近溶液中的电势差UAD,而是铜板与铜探针之间的电势差UAA′. 当回路中有电流时,由于铜探针与铜板之间的溶液有电阻,故两者之间会有电势降落. 上述猜想似乎能很好地解释实验结果,但是继续深入分析,会发现这种猜想是不正确的. 在电路接通时,假设是由于铜板与铜探针之间的电阻有电流流过而产生电势差,那么外电阻减小,电流增大,根据欧姆定律铜板与铜探针的电势差UAA′(即φA-φA′)减小,同理可得锌板附近的铜探针与锌板之间的电势差UCB(即φC-φB)也应减小,但实验结果却显示UCB几乎不变,说明上述猜想其实是错误的. 2)铜电极发生了极化现象. 极化可分为2种: a.由于铜板上有氢气产生,细小的气泡附着在铜板上,从而阻碍了溶液中的氢离子吸附到铜板上. 当外电阻较大时,系统反应速率较慢,产生的细小气泡较少,氢离子吸附到铜板上的过程中受到的阻碍作用较小,因此极化电压几乎为0;当外电阻逐渐减小时,反应速率加快,产生的细小气泡增多,氢离子吸附到铜板上的过程中受到的阻碍作用增加,不能即时与铜板上的电子反应,因此电子聚集导致铜板的电势降低,产生极化电压,且极化电压随外电阻的减小而增大. b.由于电解液中氢离子的浓度较低. 当外电阻较大时,铜板附近的氢离子的消耗速率较慢,周围溶液中的氢离子能及时扩散至被消耗区域,与铜板上的电子持续发生反应,极化电压几乎为0;当外电阻逐渐减小时,铜板附近的氢离子的消耗速率加快,而如果周围溶液中的氢离子浓度较低,来不及扩散至被消耗区域,使得铜板上的电子不能即时参与反应,因此电子聚集,电势降低,产生极化电压,且极化电压随外电阻的减小而增大. 仍以如图2所示的装置进行实验,此时将电解液更换为0.1 mol/L硫酸,目的是增大溶液中的氢离子浓度,以探究是否由于电解液中氢离子的浓度较低而导致铜电极发生了极化现象. 实验结果如图6所示. 图6 电势变化图(电解液为0.1 mol/L硫酸) 由图6可见,当外电阻减小至1 000 Ω后,A点的电势仍然要明显低于D点的电势,即铜电极仍然发生了极化现象. 据此可以认为铜电极发生极化现象与电解液中氢离子的浓度无关. 将铜板灼烧,使其表面覆盖致密的氧化铜薄膜,再将其与锌板插入电解液(0.005 mol/L硫酸)中,连接好电路,进行实验. 实验结果如图7所示. 图7 电势变化图(电解液为0.005 mol/L硫酸) 由图7可见,外电阻减小,AD两点的电势差几乎为0,也就是说,铜电极上的极化现象被消除了. 究其原因,此时铜电极上发生的反应是: 无气体生成物,故而无气泡附着在铜板上,无极化电压产生. 这证明了铜电极发生极化现象是因为气泡阻碍了氢离子附着在铜板上. 本文针对“外电阻减小会使得内、外电压之和小于电源电动势”问题进行了深入的理论分析和实验探究. 为了确定“少的那一部分电压去哪了”,尝试测量了整个回路电势变化情况,结果发现电路中A和D2点电势差与教材理论描述不符,教材中φA>φD,但实验数据显示:1)当外电路断路时,φA≈φD;2)当外电阻较小时,φA<φD. 查阅相关文献后,经理论分析提出猜想,并通过2组拓展实验证明产生上述实验现象的原因是铜电极发生了极化现象,即电路接通后,铜板上有氢气产生,细小的气泡附着在铜板上,阻碍了溶液中的氢离子吸附至铜板. 将铜板灼烧,使其表面覆盖一层致密的氧化铜薄膜,可消除铜板上的极化现象.3.1 当外电路断路时,AD两点的电势差几乎为0
3.2 当外电阻较小时,AD两点的电势差为负值
4 拓展实验
4.1 拓展实验1
4.2 拓展实验2

5 结束语
