Al/TiH2/PTFE三元活性材料的热行为研究
2019-12-30于钟深李裕春吴家祥宋佳星
曹 林,于钟深,方 向,李裕春,张 军,吴家祥,宋佳星
(陆军工程大学野战工程学院,江苏 南京 210001)
引 言
金属/氟聚物复合材料是一类冲击引发型含能材料 ,经造粒混合、粉末压实、真空烧结等工艺处理后具有一定密度、强度特性和释能特性。通常,该类材料被认为是一种对摩擦、热、爆轰等不敏感的惰性物质,但当其受到冲击载荷作用时会迅速发生反应并释放出大量热量。铝/聚四氟乙烯 (Al/PTFE)是其中较为典型的一类含能材料,在完全配比条件下,Al/PTFE(质量比26.5∶73.5)活性材料完全反应时单位质量热值达到8.53MJ/kg,是TNT反应热值(4.18MJ/kg)的2倍。由于其兼备良好的力学性能和冲击释能特性,因此军事上常将这类材料制成各种常规战斗部毁伤元,如活性破片、药型罩及战斗部壳体等,使弹药具有更强的侵彻穿孔效果并产生燃烧、类爆轰及内爆等后效毁伤作用,即独特的“撞击-反应”两段式毁伤效果,应用价值极高。国内外学者对Al/PTFE类活性材料的制备工艺、力学性能及反应特性等方面进行了大量研究,并取得了卓越的成果[1-9]。
氢化钛(TiH2)是一种高效的储氢材料,储氢率最高能达到4%,具有很高的燃烧热值,是极具潜力的高能添加剂。李辰芳[10]测得含氢量为3.9%的TiH2燃烧热值高达21.5MJ/kg,远远高于TNT (4.18MJ/kg)和RDX (9.4MJ/kg)等烈性炸药的热值。同时,TiH2化学性质稳定,与氧化性物质相容性较好。Sorensen等[11]研究表明,TiH2与高猛酸钾混合并贮存20年后仅有0.011%的TiH2分解。近年来,许多学者将TiH2作为高能添加剂加入到炸药、推进剂及烟火剂中,并开展了一系列研究。薛冰[12]将TiH2引入到RDX炸药中,并将该混合炸药应用于聚能射流装药,结果表明,与钝化RDX装药聚能射流相比,该混合炸药能大幅提高聚能射流的侵彻深度;Cheng Y F等[13]将TiH2应用到传统玻璃微球敏化型乳化炸药中,并进行了水下爆炸和猛度实验,发现新型混合炸药爆炸产生的总能量及比冲量等都显著增加,且猛度较不含TiH2乳化炸药提高了37%;李辰芳[10]研究了TiH2对推进剂燃速的影响,结果表明TiH2的加入促进推进剂气相的放热反应,导致从气相到燃烧表面传导的热量增加,从而提高了推进剂的燃烧。
鉴于TiH2的优越性能,于钟深等[14]将TiH2作为高能添加剂引入到Al/PTFE反应材料体系中,对Al/TiH2/PTFE三元活性材料的准静态压缩力学性能进行了研究,结果表明适量氢化钛不仅能提高材料的准静压力学强度,还能参与准静压条件下试样的化学反应,释放出氢气并发生燃烧作用,达到了其作为高能添加剂的目的[14]。但是,目前还没有关于Al/TiH2/PTFE受热条件下化学反应机制方面的研究。
因此,本研究制备了Al/TiH2/PTFE三元活性材料,同时制备了Al/PTFE、TiH2/PTFE和Al/TiH23种粉末样品作为参考,采用TG-DSC对不同复合材料的热反应行为进行研究,并对不同温度下材料的反应产物进行XRD物相分析。此外,还采用氧弹量热仪对Al/PTFE及Al/TiH2/PTFE材料反应热值进行了测量,以期为金属氢化物在活性材料体系中的应用提供参考。
1 实 验
1.1 材料与仪器
Al粉(球形),纯度大于99.5%,平均粒径为1~2μm,湖南金天铝厂;TiH2粉,纯度大于99.8%,平均粒径4~6μm,株洲润峰新材料有限公司;聚四氟乙烯 (PTFE),纯度大于99.5%,粒径25μm,上海三爱富有限公司。
STA449C型TG-DSC热分析仪,德国Netzsch公司,氩气氛围,流速30mL/min,升温速率10℃/min,温度范围25~1200℃;D8 Advance型X射线衍射仪(XRD),德国Bruker公司,扫描范围5°~90°,扫描步长0.02°;Parr6300氧弹量热仪,美国PARR公司,氧气氛围,测试前采用苯甲酸在3MPa氧环境下燃烧,以对仪器进行标定;VersaTM3D型电子扫描显微镜(SEM),美国FEI公司。
1.2 样品制备
实验共制备了Al/PTFE、TiH2/PTFE、Al/TiH2和Al/TiH2/PTFE 4种材料,材料各组分含量如表1所示。

表1 不同样品各组分含量
样品制备过程为:将各组分粉末按比例称质量并初步干混,向其中加入适量无水乙醇制成悬浮液,经电动搅拌机充分混合30min后,将混合溶液放入60℃真空烘箱中干燥24h,干燥结束后取出混合粉末,过筛得到均匀样品。采用电子扫描显微镜(SEM)对其微观结构进行观测。
2 结果与讨论
2.1 微观结构表征
以Al/TiH2/PTFE材料为例,样品的SEM结果如图1所示。图1(a)为TiH2粉末原材料微观形貌,从图中可以看出,TiH2粉末呈有棱角的不规则形状,平均粒径为4~6μm。图1(b)为Al/TiH2/PTFE材料背散射模式下的电镜扫描图,由于钛元素具有相对较高的原子序数,因此图中TiH2颗粒亮度最高,铝粒子亮度介于TiH2和PTFE之间。图1(b)结果显示,材料各组分混合较为均匀,满足复合材料混合均匀性的要求。图1(c)~(f)为对应区域的Al、Ti、C和F元素的分布图,进一步证明了材料混合的均匀性。

图1 材料微观结构和元素分布Fig.1 Microstructure and element distributions of the materials
2.2 Al/PTFE受热分解和反应过程分析
图2为Al/PTFE复合材料样品在氩气氛围下的TG-DSC曲线,及其对应的不同温度下反应产物的XRD图谱。

图2 Al/PTFE复合材料的TG-DSC曲线及其在不同温度下反应产物的XRD衍射图Fig.2 TG-DSC curves of Al/PTFE composite and XRD patterns of reaction products at different temperatures
从图2(a)中可以看出,DSC曲线上在325 ~350℃之间有一个小的吸热峰A,对应着PTFE的熔融吸热峰[15]。TG曲线显示,510~598℃样品质量急剧下降,伴随着DSC曲线上出现较大的吸热峰B,此阶段样品质量损失达到68.72%,与PTFE的分解吸热温度范围相吻合。随着温度升高,DSC曲线在609℃附近出现了放热峰C,并在619℃附近放热结束,此时XRD图谱中出现了较强的AlF3衍射峰,表明放热峰C是由Al和PTFE的反应放热造成的,与Osborne等[16]的研究结果一致。在660℃时DSC曲线上出现吸热峰,对应着未完全反应金属Al的熔融吸热过程。随着温度继续升高,TG曲线从895℃附近开始出现5.06%的质量损失,对应972℃附近出现的吸热峰E。从XRD结果可知,1200℃时AlF3衍射峰已消失,推测吸热峰E可能是由AlF3升华吸热造成的。为验证该推测,对纯AlF3在氩气氛围下进行TG-DSC测试,结果如图3所示。
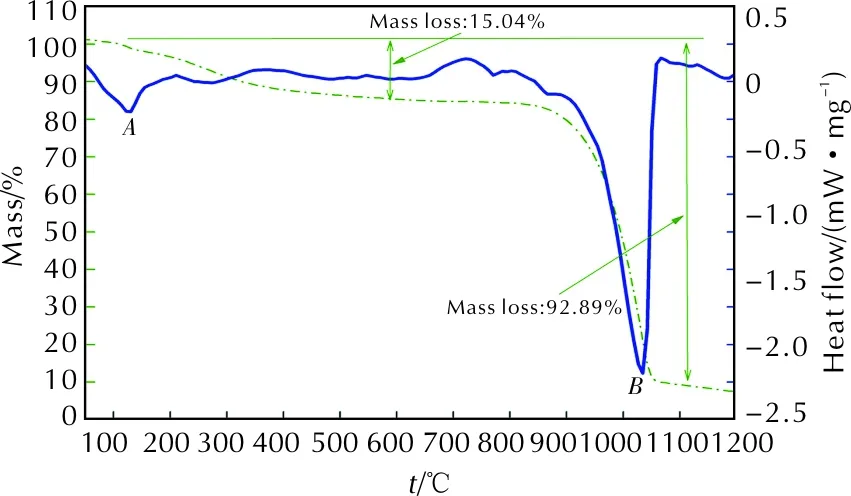
图3 AlF3粉末的TG-DSC曲线Fig.3 TG-DSC curve of AlF3 powder
图3表明,AlF3在600℃之前产生了15.1%的质量下降,这是由于AlF3为湿法工艺生产,含有3个结晶水,此阶段质量下降是由AlF3脱去结晶水引起的。从860℃开始,AlF3样品开始升华,质量急剧下降,并伴随产生吸热峰,峰值温度为1028℃。故吸热峰E为AlF3升华吸热造成的,只是在Al/PTFE活性材料系统中,峰值温度提前了约50℃。通过以上分析可知,在氩气氛围下Al/PTFE活性材料系统中发生的化学反应主要有:
(-C2F4-) →C2F4(g)
(1)
4Al+3C2F4→ 4AlF3+6C
(2)
4Al+3C→Al4C3
(3)
2.3 TiH2/PTFE受热分解和反应过程分析
在对TiH2/PTFE复合材料热分析之前,先对纯TiH2在氩气氛围下进行了TG-DSC测试,结果如图4所示。

图4 纯TiH2粉末的TG-DSC曲线Fig.4 TG-DSC curve of TiH2 powder
由图4可知,TiH2受热分解包含两个吸热峰,峰值温度分别为438℃和527℃,对应的质量损失分别为1.25%和2.62%,该质量损失为TiH2脱氢引起的,即原始TiH2粉末含氢量为3.87%,与TiH2理论含氢量接近。图5为TiH2/PTFE复合材料的TG-DSC曲线及其相应的不同温度下反应残渣的XRD图谱。
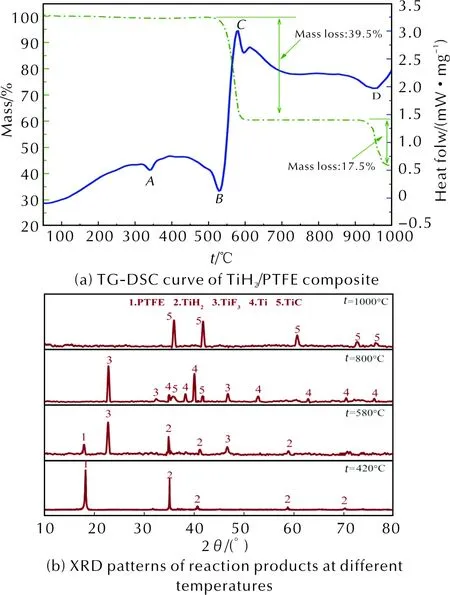
图5 TiH2/PTFE复合材料的TG-DSC曲线及其在不同温度下反应产物的XRD衍射图谱Fig.5 TG-DSC curves of TiH2/PTFE composite and XRD patterns of reaction products at different temperatures
由图5可知,峰A为PTFE熔融吸热峰,在530℃附近有一个吸热峰B,与TiH2高温侧分解吸热峰相对应,表明此阶段TiH2开始分解产生Ti和氢气,而TiH2低温侧吸热峰在图5中DSC曲线上体现并不明显。随着温度升高,样品DSC曲线在578℃附近出现放热峰,且XRD图谱显示580℃时有TiF3衍射峰出现,表明该放热峰为TiH2分解产生的钛和PTFE发生放热反应,生成TiF3所致。另外,在这个过程中也有可能生成TiF4,因为TiF4较TiF3稳定,但由于其沸点较低较易升华[17],故未在产物残渣XRD中检测到TiF4物相。需要注意的是,TG曲线从511℃附近开始便出现了较大的质量下降,此阶段主要为PTFE的吸热分解,但DSC曲线却没有出现PTFE分解吸热峰,这与Al/PTFE材料的DSC曲线不同,分析认为这是由于PTFE分解吸热峰与Ti和PTFE反应的放热峰重叠,最终表现出放热峰造成的,即吸热峰B和放热峰C为TiH2、PTFE的分解吸热和Ti与PTFE反应放热共同作用下形成。从893℃开始,TG曲线显示样品质量损失为17.5%,伴随着DSC曲线出现吸热峰D,且XRD结果显示800℃之后TiF3衍射峰逐渐减少至消失,分析认为这是由TiF3发生歧化反应生成固态金属Ti和气态TiF4所致[17]。另外,从800℃开始,XRD图谱中开始出现TiC衍射峰且峰强度随温度升高逐渐增强,表明此阶段Ti和C发生反应生成了TiC。结合上述分析,TiH2/PTFE复合材料在氩气氛围下受热发生的化学反应可能有:
(-C2F4-)→C2F4(g)
(4)
TiH2→ Ti + H2
(5)
4Ti + 3C2F4→ 4TiF3+ 6C
(6)
Ti+C2F4→TiF4(g)+2C
(7)
4TiF3→3TiF4(g) + Ti
(8)
Ti+C→TiC
(9)
2.4 Al/TiH2/PTFE受热分解和反应过程分析
图6为Al/TiH2/PTFE在氩气氛围下的TG-DSC曲线及其不同温度下样品反应产物XRD物相检测结果。
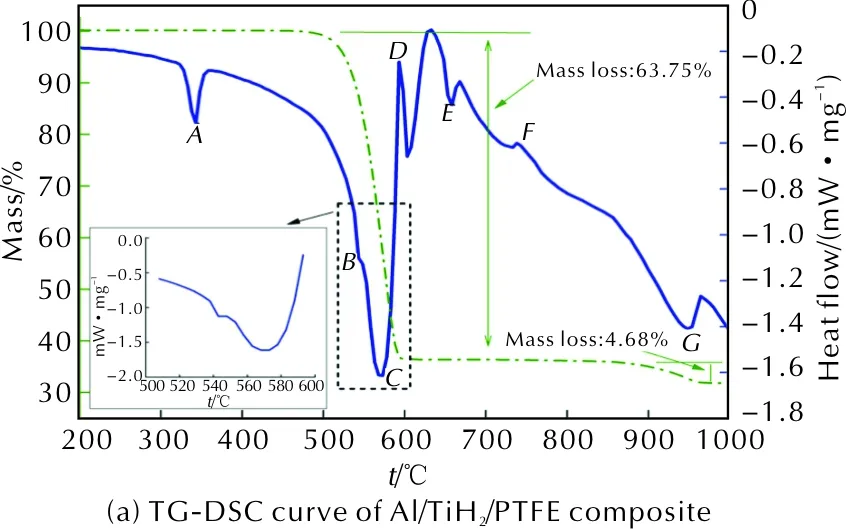

图6 Al/TiH2/PTFE活性材料的TG-DSC曲线及其在不同温度下反应产物的XRD衍射图Fig.6 TG-DSC curves of Al/TiH2/PTFE active material and XRD patterns of reaction products at different temperatures
图6中,DSC曲线上吸热峰A对应PTFE熔融吸热过程,在542℃附近有一个小的吸热峰B,分析可知该吸热峰为TiH2分解为金属Ti和氢气造成的。从510℃开始,TG曲线显示样品质量明显下降,伴随着DSC曲线出现大的吸热峰C,该过程与PTFE的分解吸热过程相一致。随着温度升高至612℃,DSC曲线出现放热峰D,由Al/PTFE的DSC曲线结果可知该放热峰为Al和PTFE反应放热,生成AlF3和C造成的。XRD检测结果显示,从580℃开始即有AlF3和TiF3物相生成,表明在PTFE分解过程中,既有Al和PTFE反应生成AlF3,又有Ti和PTFE反应生成TiF3(或TiF4),由于样品中TiH2含量较少,故DSC曲线上并未体现出Ti与PTFE的反应放热峰。DSC曲线上在660℃时的吸热峰E为未完全反应金属Al的熔融吸热峰。当温度为752℃附近时,DSC曲线上出现一个小的放热峰F,且XRD图谱中显示有Al3Ti衍射峰出现,初步推断放热峰F为金属Al和金属Ti发生放热反应生成Al3Ti造成的。为证实该推断,对Al/TiH2混合粉末在氩气氛围下进行TG-DSC测试,并对反应残渣进行XRD检测,结果如图7所示。
从图7可以看出,Al/TiH2混合粉末在温度为743 ~792℃出现放热峰,且反应产物主要为Al3Ti和未完全反应的金属Al,故图7(a)中的放热峰F为金属Al和Ti的反应放热峰。随着温度继续升高,TG曲线在890℃时开始出现4.68%的质量损失,相应的DSC曲线上出现吸热峰G,分析认为这是由AlF3升华及TiF3歧化反应造成固态物质质量减小引起的。XRD结果表明,从780℃到1000℃,AlF3及TiF3逐渐减少,进一步证明吸热峰G为AlF3升华吸热及TiF3歧化反应吸热造成的。同时,XRD结果显示从780℃开始,反应产物中有TiC出现,表明此阶段Ti和C发生反应生成了TiC。研究表明,Ti和C发生放热反应的温度范围较大[18],且实验中反应物Ti的量相对较少,故DSC曲线上并未体现出Ti和C的反应放热峰。

图7 Al/TiH2复合材料的TG-DSC曲线及1000℃时反应产物的XRD衍射图Fig.7 TG-DSC curves of Al/TiH2 composite and XRD patterns of reaction products at the temperature of 1000℃
综上所述,在Al/TiH2/PTFE活性材料体系中发生的化学反应可能有:
(-C2F4-)→C2F4(g)
(10)
TiH2→Ti+H2
(11)
4Al+3C2F4→ 4AlF3+ 6C
(12)
4Ti+3C2F4→4TiF3+6C
(13)
Ti+C2F4→TiF4(g)+2C
(14)
4TiF3→3TiF4(g)+Ti
(15)
Ti+3Al→Al3Ti
(16)
Ti+C→TiC
(17)
2.5 燃烧热值分析
表2为Al/PTFE和Al/TiH2/PTFE燃烧热值测试结果。

表2 两类反应材料的燃烧热值测量结果
从表2中可以看出,加入质量分数10%的TiH2后,反应材料的燃烧热值达到了14876J/g,比Al/PTFE的热值提高了近7.7%,表明TiH2作为反应材料高能添加剂的效果较为明显。另外,实验收集了Al/TiH2/PTFE氧弹量热反应残渣,并对其进行了XRD物相检测,结果如图8所示。
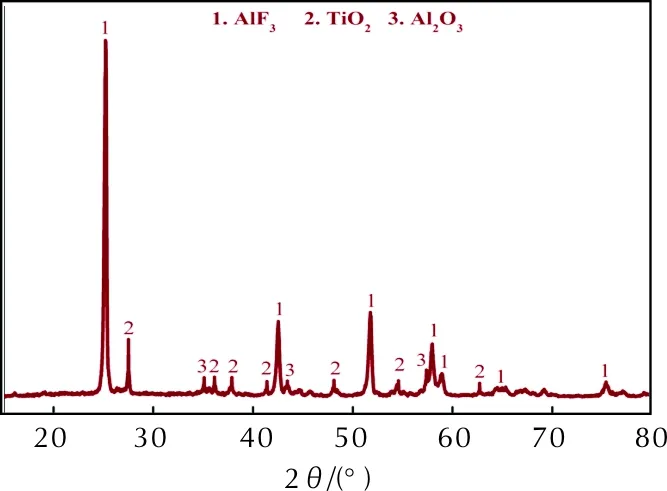
图8 Al/TiH2/PTFE氧弹反应残渣的XRD衍射图Fig.8 XRD patterns of reaction products of Al/TiH2/PTFE after oxygen bomb reaction
由图8可见,反应产物主要为AlF3,另外还有少量的Al2O3和TiO2。由上述分析可知,Al和PTFE反应产物中还有炭黑,但从回收的反应残渣来看,其颜色为白色,并无黑色物质存在,表明炭黑在氧弹条件下已反应完全,生成CO2,样品燃烧较为充分。
3 结 论
(1)在Al/PTFE活性材料体系中,TG-DSC程序升温条件下PTFE能将Al氧化为AlF3,发生放热反应。随着温度升高,未完全反应的Al能与碳发生反应生成Al4C3。在TiH2/PTFE复合材料体系中,TiH2受热首先分解成金属Ti和氢气,然后金属Ti与PTFE发生放热反应,生成TiF3(或TiF4)和C(碳)。XRD结果显示,从800℃开始,金属Ti又可与C发生反应,生成TiC,释放出热量。
(2)在Al/TiH2/PTFE三元活性材料体系中,TiH2受热条件下同样先发生分解,生成金属Ti和氢气。随后金属Ti和金属Al作为还原剂与PTFE发生反应,即金属Ti被PTFE氧化生成TiF3(或TiF4),金属Al被PTFE氧化生成AlF3。随着温度升高,未完全反应的金属Al和Ti发生化合反应生成Al3Ti,同时Ti和C发生化合反应生成TiC,释放出热量。
(3)在Al/PTFE中引入质量分数10%的TiH2,材料燃烧热值从13812J/g增至14876J/g,提高了7.7%,表明TiH2能有效提高Al/PTFE活性材料的能量密度。
猜你喜欢
杂志排行
火炸药学报的其它文章
- Fabrication and Characterization of Submicron-sized RDX with Reduced Sensitivity via Green Mechanical Demulsification Technology
- 硝酸异丙酯的去能工艺优化
- Effects of Different Content of Nanomaterials on the Combustion Performance of RDX-CMDB Propellants
- 自修复固体推进剂研究进展
- 降低发射装药弹道温度系数技术的国内外研究进展
- 硅基纳米含能亚稳态复合物Si@PVDF/CL-20的制备及热分解特性
