抑制COTE1表达对多柔比星诱导的肝癌细胞凋亡的影响
2019-12-27朱津张海徐三荣
朱津,张海,徐三荣
(江苏大学附属医院普外科,江苏 镇江 212001)
肝细胞肝癌是肝脏原发性恶性肿瘤中最为常见的一种类型,具有发展隐匿、进展迅速、复发容易、预后不佳等特点,患者确诊时多为晚期[1]。目前,针对肝癌的治疗方法仍然以外科手术进行局限性切除为主,但由于肝癌的特殊性,往往只有部分患者符合肝脏肿瘤手术切除指征,因此,化疗成为治疗肝癌的重要手段[2]。多柔比星是临床上常用的高效性广谱化疗药物之一,长期使用易使肿瘤细胞产生明显的耐药性,致化疗效果降低,严重影响肝癌患者的生存和预后[3]。COTE1基因,即人FAM189B基因(family with sequence similarity 189 member B),广泛表达于心脏、肝脏、肺等多个脏器[4]。有研究表明,COTE1能通过与WWOX(WW domain-containing oxidoreductase)相结合参与肝癌细胞的凋亡过程,影响肝癌细胞的增殖与转移[5-6],而WWOX又能够通过凋亡途径来逆转肺癌、骨肉瘤等细胞的耐药,提高肿瘤细胞对化疗药物的敏感性[7-8]。但是,COTE1在肿瘤细胞耐药中的作用尚不清楚,因此,本研究拟探讨COTE1对肺癌细胞凋亡水平的影响,揭示COTE1在肝癌细胞耐药中的作用。
1 材料与方法
1.1 细胞株及主要试剂
人肝癌PLC/PRF/5细胞株购自中国科学院上海生命科学研究院;COTE1短发夹RNA(short hairpin RNA,shRNA)慢病毒表达载体购自苏州吉玛基因有限公司;MEM(美国Hyclone公司);胎牛血清(美国Gibco公司);多柔比星(大连美伦生物技术有限公司);CCK-8试剂盒(日本同仁化学公司);RIPA裂解液、cocktail蛋白酶抑制剂(美国Sigma公司);羊抗人COTE1抗体(美国Santa Cruz公司);GAPDH抗体、β-肌动蛋白、驴抗羊二抗、兔抗小鼠二抗、嘌呤霉素、ECL试剂盒和BCA蛋白浓度测定试剂盒(上海碧云天生物公司);Annexin V-Alexa647 fluor/PI凋亡试剂盒(南京福麦斯生物公司)。
1.2 细胞培养
人肝癌细胞株PLC/PRF/5培养于含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的MEM中,置于37 ℃、5%CO2恒温孵育箱内,取对数生长期细胞进行实验。
1.3 慢病毒转染及稳转细胞株的构建
将PLC/PRF/5肝癌细胞分为shRNA组和对照组,分别接种于6孔板;次日细胞汇合度达30%~50%时,shRNA组加入(1~2)×106/U慢病毒和2 μL多聚赖氨酸,使终浓度为5 μg/mL;24 h后换液;48 h后于荧光显微镜下观察感染效率;加入0.1 μg/mL嘌呤霉素进行细胞筛选。对照组加入相同浓度的无关序列慢病毒,其余处理同shRNA组。shRNA组慢病毒靶序列:5′-GTATGTAAGCCTTCAATAA-3′,对照组慢病毒靶序列:5′-TTCTCCGAACGTGTCACGT-3′。
1.4 实时荧光定量PCR检测COTE1 mRNA表达
收集相应处理后的细胞,按照说明书提取各组细胞总RNA,再经过反转录合成cDNA模板,最后进行荧光定量PCR检测。扩增条件:95 ℃预变性30 s,95 ℃ 5s,60 ℃ 30 s,72 ℃ 30 s,共40个循环,95 ℃ 1 min,55 ℃ 30 s,95 ℃ 30 s收集荧光。引物序列:COTE1上游引物 5′-GGGCTCTGACCTAGGCTTCT-3′、下游引物5′-ACAGAAGCTCTCCCAGTCCA-3′;β-肌动蛋白上游引物5′-AGAGCCTCGCCTTTGCCGATCC-3′,下游引物5′-CTGGGCCTCGTCGCCCACATA-3′。扩增结果采用ΔΔCt法计算相对定量。
1.5 蛋白质印迹检测COTE1蛋白表达
收集相应处理后的细胞,用预冷PBS清洗3次;每孔加入100 μL RIPA细胞裂解液和1 μL cocktail蛋白酶抑制剂,冰上裂解30 min;用细胞刮刀刮取细胞,4℃行13 000 r/min离心15 min;取上清液,BCA法测蛋白浓度。总蛋白行10% SDS-PAGE,湿转1.5 h至PVDF膜;用含5%脱脂奶粉的TBST室温封闭1 h;加入羊抗人COTE1抗体(1 ∶200)、GAPHD抗体(1 ∶1 000),4 ℃孵育过夜;TBST洗膜3次,每次10 min;加入相应的HRP标记的二抗(1 ∶5 000)室温孵育1 h;再洗膜3次;采用ECL化学发光试剂显色。
1.6 CCK-8法检测细胞抑制率
将shRNA组及对照组细胞分别以每孔1×104个接种于96孔板,待细胞贴壁后,加入不同浓度的多柔比星(终浓度为0,0.125,0.25,0.5,1.0 μg/mL)培养48 h;每孔加入10 μL CCK-8试剂,培养2 h;用酶标仪检测D(450 nm)值;每个浓度设置3个复孔。
1.7 流式细胞术检测细胞凋亡率
将shRNA组及对照组细胞分别以每孔2×105个接种于6孔板中,各设3个复孔,待细胞贴壁后,加入多柔比星使终浓度为0.25 μg/mL,培养48 h;按照Annexin V-Alexa Fluor647/PI凋亡试剂盒说明步骤收集细胞,进行流式细胞术检测。
1.8 统计学方法
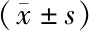
2 结果
2.1 慢病毒转染
慢病毒转染细胞并经过0.1 μg/mL嘌呤霉素筛选1周后,荧光显微镜下几乎全部细胞均可见绿色荧光,提示慢病毒转染成功。见图1。

图1 荧光显微镜下荧光蛋白的表达(200×)
2.2 慢病毒感染后肝癌细胞中COTE1 mRNA及蛋白的表达
实时荧光定量PCR显示,shRNA组COTE1 mRNA表达较对照组显著降低(t=10.329,P<0.05);进一步蛋白质印迹结果显示shRNA组COTE1蛋白表达也明显降低(t=3.459,P<0.05),见图2。由此表明,shRNA组的目的基因COTE1被抑制,可进行后续实验。

图2 实时定量PCR和蛋白质印迹法检测COTE1-shRNA的干扰效果
2.3 COTE1-shRNA对肝癌细胞增殖的影响
CCK-8检测结果显示,肝癌细胞经慢病毒感染后,多柔比星对细胞的增殖抑制率明显高于对照组(P<0.05),且呈浓度依赖性。见图3。

*:P<0.05
2.4 COTE1增强多柔比星对细胞凋亡的诱导作用
流式细胞术检测结果显示,经多柔比星处理后,shRNA组细胞凋亡率较对照组明显升高(t=-4.038,P<0.05),见图4。由此表明,抑制COTE1表达可促进肝癌细胞凋亡。
3 讨论
文献表明,慢病毒载体具有转染率高,持续时间长等优点,能实现目的蛋白长期、稳定的有效表达[9]。本实验通过将携带有COTE1基因干扰序列的慢病毒载体感染肝癌PLC/PRF/5细胞,并在嘌呤霉素的筛选下得到COTE1基因稳定沉默表达的细胞,最后验证目的基因COTE1表达被显著抑制。

图4 流式细胞术检测两组肝癌细胞株的凋亡率
既往研究发现,癌基因在耐药细胞株中表达较亲本细胞升高或降低,而利用反义寡聚核苷酸下调这些基因的表达,促进凋亡蛋白或凋亡通路因子的激活,能够增强肿瘤的化疗增敏作用。如通过干扰大肠癌SW480细胞中HSPA27表达,能够提高5-氟尿嘧啶对肿瘤细胞的促凋亡作用,增强细胞对化疗药物的敏感性[10]。本实验研究结果表明,与对照组相比,不同浓度多柔比星处理后shRNA组细胞的增殖抑制率均明显升高,表明抑制COTE1表达能够增强多柔比星对肝癌细胞的化疗作用。同时,多柔比星处理后的细胞凋亡率也明显高于对照组,提示COTE1能够通过促进细胞凋亡来增强化疗药物的抗肿瘤效果,逆转细胞耐药,但其通过何种途径,有待进一步实验研究。
综上所述,抑制COTE1表达能够增强肝癌细胞对多柔比星的化疗敏感性,逆转肝癌细胞耐药。
