雷帕霉素靶蛋白复合物1对Hela细胞微管蛋白稳定性的影响
2019-12-27毛正发徐进季佩宇王旭青张建新周小明
毛正发,徐进,季佩宇,王旭青,张建新,周小明
(1. 江苏大学附属医院普通外科,江苏 镇江212001; 2. 江苏大学医学院,江苏 镇江212013)
微管是细胞骨架的成分之一,参与细胞中许多重要的生理过程。它可以维持细胞形态和结构的稳定性[1],参与细胞分裂[2]、细胞内信号转导[3],还可以通过其运动蛋白发挥转运功能[4]。微管在其他生物过程如细胞极性、迁移中也起着重要作用[5]。微管组装的动态平衡受微管稳定相关蛋白的调控如促微管解聚蛋白、促微管聚合蛋白、微管切割蛋白等,同时作为细胞骨架的成分,也受多种激酶的调控,如Ras同源基因家族成员A(Ras homolog gene family member A,RhoA) GTP酶等[1]。微管组装的动态平衡异常参与多种癌的发生和发展。据报道,促微管解聚蛋白Stathmin1可能通过促进微管解聚而影响细胞迁移和转移,在许多人类癌症组织及细胞系中其表达上调,如乳腺癌[6]、前列腺癌[7]、肝细胞癌[8]。
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是一种非典型的丝氨酸/苏氨酸激酶,由mTORC1和mTORC2两种复合物组成,它们参与细胞的各种活动,如增殖、能量代谢等,同时可以通过调控多种信号通路及自噬相关基因(autophagy-related gene,ATGs)调节自噬,维持细胞稳态,在细胞生长中发挥重要作用[9]。已有研究报道mTORC2参与了微管的调节并影响其稳定性[10]。但mTORC1是否也有相同功能尚不清楚,本研究探讨了mTORC1对微管稳定性的影响及其可能的机制。
1 材料和方法
1.1 材料
人多克隆抗α-微管蛋白抗体,促微管解聚药物诺考达唑(美国Sigma Aldrich公司)。抗-p190RhoGAP,抗-RhoA、stathmin、Katanin、Spastin、KIF2A、CLIP170抗体(加拿大Santa Cruz公司)。人多克隆ATG5抗体,抗P70S6K、抗P-P70S6K(T389)抗体(美国Cell Signaling Technology公司)。mTORC1抑制剂雷帕霉素(美国MCE公司)。其他化学品均为美国Sigma 公司或Fisher Scientific公司产品。
1.2 细胞培养
人子宫颈癌Hela细胞株置于Dulbecco改良的Eagle培养基(DMEM)中,于5%CO2、37℃条件下培养箱中培养。培养基补充有10%胎牛血清、2 mmol/mL谷氨酰胺、100 U/mL青霉素和100 U/mL链霉素。
1.3 免疫荧光检测雷帕霉素处理后Hela细胞的微管稳定性
将Hela细胞铺板于盖玻片上36 h,长至80%融合时,处理组使用50 nmol/L雷帕霉素预处理24 h后,加入诺考达唑5 μmol分别处理30、60、120 min;对照组细胞仅加入诺考达唑进行处理。在室温下用PBS洗涤细胞3次,并在冰上用4%多聚甲醛固定30 min。用含有5%山羊血清、2%驴血清、2% BSA、0.1%Tween-20和0.3%Triton X-100的PBS在室温下封闭细胞1 h。PBS洗涤细胞3次,每次5 min,抗α-微管蛋白(1 ∶500)4 ℃下孵育过夜。PBS洗涤细胞3次,每次5 min,二抗(Alex Fluro 594-标记的山羊抗小鼠IgG)以1 ∶4 000稀释度常温下孵育2 h。PBS清洗细胞3次,每次10 min。用PBS稀释的DAPI染液(1 ∶3 000)室温避光孵育15 min。孵育结束后用PBS清洗细胞5次,每次5 min。使用倒置共聚焦激光显微镜拍照。
1.4 蛋白质印迹检测雷帕霉素处理后Hela细胞微管稳定性相关蛋白的表达
将Hela细胞分别种于两个培养皿,长至80%融合时,处理组加入50 nmol/L雷帕霉素,对照组不加。24 h后收集细胞,使用RIPA缓冲液裂解并进行蛋白定量,根据检测蛋白质相对分子质量配制相应浓度的分离胶及浓缩胶。蛋白质变性后行SDS-PAGE,70 V 2 h;350 mA转膜2 h,将凝胶分离的蛋白质转移到硝酸纤维素膜(PVDF)上。PVDF膜洗涤后5% BSA封闭1 h;抗stathmin、KIF2A、P70S6K、P-P70S6K(T389)、CLIP170、Katanin、Spastin抗体按说明书稀释,4℃孵育过夜。TBST洗膜3次,每次10 min,加HRP偶联的二抗(1 ∶2 000),室温孵育1 h,TBST洗膜3次,每次10 min,然后用ECL试剂盒曝光检测蛋白的表达。
1.5 免疫荧光检测ATG5敲减后Hela细胞的微管稳定性
1.5.1 质粒构建 针对ATG5的小干扰RNA(sh-RNA)由Sigma-Aldrich公司设计和合成,组装至pLKO1-TRC克隆载体。ATG5-shRNA-pLKO1序列:正向引物5′-CCGGCCTTTCATTCAGAAGCTGTTTCTC-GAGAAACAGCTTCTGAATGAAAGGTTTTTG-3′,反向引物5′-AATTCAAAAACCTGAACAGAATCATCCTT-AACTCGAGTTAAGGATGATTCAGG-3′。ATG5- scramble-pLKO1序列:正向引物 5′-CCGGCCTAAGGTTAAGTCGCCCTCGCTCGAGGAGGGCGACTTAACCTTA-GGTTTTTG-3′,反向引物 5′-AATTCAAAAACCTAAGGTTAAGTCGCCCTCGCTCGAGCGAGGGCGACTT AACCTTAGG-3′。
1.5.2 蛋白质印迹验证ATG5的干扰效率 使用293T细胞进行ATG5-shRNA及ATG5- Scramble (随机序列)质粒慢病毒的包装。将完整病毒转染Hela细胞,感染体系为1 mL正常培养基+1 mL病毒上清液,再加入2 μL聚凝胺(10 mg/mL)增强病毒感染细胞的效率。24 h后再次感染。随后用浓度为1 μg/mL的嘌呤霉素选择转染的细胞,挑取单克隆,通过蛋白质印迹检测ATG5干扰效率,方法同步骤“1.4”,一抗使用抗ATG5抗体,以GAPDH为内参。
1.5.3 免疫荧光检测微管稳定性 转染ATG5-scramble和ATG5-shRNA的Hela细胞分别加入诺考达唑5 μmol,处理0、30、60 min后,免疫荧光检测Hela细胞的微管稳定性,方法同步骤“1.3”。
1.6 免疫荧光检测 RhoA在mTORC1调节微管稳定性中的作用
1.6.1 蛋白质印迹检测雷帕霉素处理后Hela细胞RhoA的表达 将Hela细胞分别种于两个培养皿,长至80%融合时,处理组加入50 nmol/L雷帕霉素,对照组不加。24 h后收集细胞,蛋白质印迹检测RhoA的表达,方法同步骤“1.4”,一抗使用抗RhoA抗体,以GAPDH为内参。
1.6.2 RhoA活化实验 细胞分为对照组(未处理),雷帕霉素+诺考达唑处理组,雷帕霉素+诺考达唑+LPA(溶血磷脂酸,增加细胞RhoA活性)刺激处理组,雷帕霉素+诺考达唑+GFP RhoA-Q63L(RhoA正性质粒,具有RhoA活性)处理组。细胞处理120 min后,免疫荧光检测活化RhoA对微管稳定性的影响,方法同步骤“1.3”。
1.6.3 RhoA抑制实验 细胞分为对照组(未处理),诺考达唑处理组,诺考达唑+Y-27632(RhoA下游效应物的抑制剂)处理组,诺考达唑+GFP RhoA-N19处理组(RhoA负性质粒,抑制RhoA活性)。细胞处理120 min后,免疫荧光检测抑制RhoA对微管稳定性的影响,方法同步骤“1.3”。
1.7 免疫荧光检测p190RhoGAP在mTORC1调节微管稳定性中的作用
使用293T细胞进行病毒的包装。使用Lipofectamine 2000转染针对人p190Rho-GAP(正向引物:5′-GAACAGCGAUUUAAAGCAUTT-3′,反向引物:3′-AUGCUUUAAAUCGCUGUUCTT-5′)的对照siRNA(随机序列)或siRNA。将完整病毒转染Hela细胞24 h后,蛋白质印迹检测干扰效率,一抗为抗p190Rho-GAP抗体,以α-微管蛋白为内参。
细胞分为雷帕霉素+诺考达唑组,雷帕霉素+诺考达唑+p190RhoGAP 随机序列组,雷帕霉素+诺考达唑+p190RhoGAP-siRNA组。各组细胞处理120 min后,免疫荧光检测抑制RhoA对微管稳定性的影响,方法同步骤“1.3”。
2 结果
2.1 雷帕霉素作用后Hela细胞微管的稳定性
用5μmol的诺考达唑处理后,Hela细胞中微管的解聚呈时间依赖性,30 min微管开始出现解聚,120 min后微管完全解聚。用50 nmol/L雷帕霉素预处理后,诺考达唑诱导的解聚作用被延迟,120 min时仍能清楚地看到微管(图1)。雷帕霉素能够抑制诺考达唑引起的微管解聚,这表明mTORC1可能参与微管的稳定性。
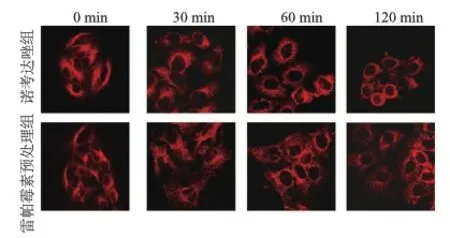
图1 免疫荧光观察Hela细胞微管的稳定性(×200倍)
2.2 霉帕霉素作用后Hela细胞微管稳定性相关蛋白的表达
蛋白质印迹结果显示,用50 nmol/L雷帕霉素处理Hela 24 h后,P-P70S6K(T389)表达减少,这表明mTORC1信号传导受到抑制;促微管解聚蛋白质(stathmin、KIF2A),促进微管聚合蛋白质(CLIP170)和微管切割蛋白(Katanin、Spastin)的表达未见明显差异,见图2。这表明mTORC1调节微管的稳定性可能与微管稳定性相关蛋白无关。

图2 雷帕霉素处理后Hela细胞微管稳定性相关蛋白的表达
2.3 ATG5基因敲低后Hela细胞的微管稳定性
蛋白质印迹(图3A)显示,转染ATG5-shRNA后Hela细胞ATG5蛋白表达下降,提示细胞自噬功能得到抑制。与对照细胞30 min和60 min相比,在ATG5敲低的Hela细胞中,诺考达唑诱导的微管解聚没有显著差异(图3B)。结果表明,Hela细胞的微管稳定性可能与ATG5基因无关。

图3 免疫荧光检测下调ATG5后Hela细胞微管的稳定性(×200倍)
2.4 RhoA活性在mTORC1调节微管稳定性中的作用
蛋白质印迹结果显示,50 nmol/L雷帕霉素处理24 h后,Hela细胞 RhoA表达下降,提示雷帕霉素可能通过下调RhoA维持微管的稳定性(图4A)。RhoA活化实验结果显示,与雷帕霉素+诺考达唑处理组相比,使用LPA刺激或转染GFP RhoA-Q63L上调RhoA后,Hela细胞的微管解聚加快,120 min 后完全消失(图4B)。RhoA抑制实验结果显示,与诺考达唑组相比,使用Y-27632处理或转染GFP RhoA-N19重组RhoA质粒抑制RhoA活性后,Hela细胞的微管解聚被抑制,120 min后微管仍然明显可见(图4C)。这些结果表明RhoA信号传导途径参与了Hela细胞微管稳定性的改变。

(A) 雷帕霉素处理后Hela细胞RhoA表达下降;(B) RhoA活化实验,1:对照组(未处理),2:雷帕霉素+诺考达唑处理组,3:雷帕霉素+诺考达唑+LPA处理组,4:雷帕霉素+诺考达唑+GFP RhoA-Q63L处理组;(C) RhoA抑制实验,5:对照组(未处理),6:诺考达唑处理组,7:诺考达唑+Y-27632处理组,8:诺考达唑+GFP RhoA-N19处理组
图4 免疫荧光检测RhoA 活化和抑制后Hela细胞的微管稳定性(×200倍)
2.5 p190RhoGAP在mTORC1调节微管稳定性中的作用
蛋白质印迹显示,转染p190RhoA-siRNA质粒后,Hela细胞p190RhoGAP表达下调;免疫荧光结果显示,与雷帕霉素+诺考达唑+p190RhoGAP随机序列组相比,转染p190RhoA-siRNA组细胞微管解聚加快,120 min 后完全消失(图5)。

1:雷帕霉素+诺考达唑组,2:雷帕霉素+诺考达唑+p190RhoGAP 随机序列组,3:雷帕霉素+诺考达唑+p190RhoGAP-siRNA组
图5 免疫荧光检测抑制 p190RhoGAP后Hela细胞的微管稳定性(×200倍)
3 讨论
目前,研究微管稳定性的常用方法是通过荧光显微镜或激光共聚焦显微镜观察微管的结构。诱导微管解聚有两种主要方法:低温处理和药物处理[11]。诺考达唑是一种特异性结合β-微管蛋白的药物,可诱导微管解聚。在实验使用雷帕霉素特异性抑制mTORC1,观察由诺考达唑诱导的微管解聚的变化。结果显示雷帕霉素预处理后Hela细胞中微管的解聚速率明显慢于未处理的细胞,即抑制mTORC1提高了微管的稳定性。上述结果表明mTORC1活性参与微管的稳定性调节。
mTORC1最重要的作用之一是调节自噬[12]。为了研究微管稳定性和自噬之间是否存在关系,我们构建了ATG5敲低Hela细胞系,结果显示在ATG5敲低Hela细胞中,诺考达唑诱导的微管解聚没有显著变化。该结果提示自噬依赖于稳定的微管,但微管的稳定性不依赖于自噬。
微管的稳定性受微管相关蛋白调节,例如促进微管解聚的stathmin和KIF2A,以及促进微管聚合的MAPs、CLIP170。本研究中,抑制mTORC1活性后微管解聚蛋白stathmin、KIF2A和微管聚合蛋白CLIP170均未见明显变化,微管裂解蛋白(Katanin、 Spastin)亦未见明显改变。已有研究表明GTP结合蛋白RhoA介导细胞骨架重组和细胞运动[13],因此,我们进一步观察RhoA是否直接参与雷帕霉素在Hela细胞中诱导的微管稳定性。蛋白质印迹结果显示,雷帕霉素处理后Hela细胞RhoA表达下降;随后使用RhoA信号传导途径的抑制剂或激活剂刺激细胞后,发现mTORC1调节微管的稳定性与小GTP酶RhoA的激活有关。有研究表明RhoA活性的下调与GTP酶活化蛋白如p190RhoGAP的激活有关[14],提示雷帕霉素可能是通过增加p190RhoGAP的活性抑制RhoA活性,从而维持微管的稳定性。本研究中沉默了p190RhoGAP基因后,Hela细胞微管解聚的能力得到部分恢复。综上所述,本研究结果显示mTORC1通过调控RhoA活性参与微管稳定性的调节,与其自噬功能无关。
