肝动脉化疗栓塞联合射频消融治疗原发性肝癌疗效的观察
2019-12-27严生基
陈 俊 严生基 李 凯 王 晨 关 荣 高 飞
新疆石河子市人民医院 832000
原发性肝癌为我国常见的恶性肿瘤之一,严重危害着国民的健康,它的预后较其他肿瘤差,如何提高其疗效一直是目前医学界的热点。它的治疗方法包括外科切除、肝移植、生物免疫治疗、放化疗、局部治疗等。外科治疗仍然是它首选且重要的治疗方式,但是我国肝癌患者90%以上患有乙型病毒性肝炎,合并肝功能不全、肝硬化、肿瘤多发、早期播散和远处转移,只有约20%的患者有手术切除的机会[1]。TACE是目前中晚期肝癌患者首选治疗之一,由于肿瘤双重供血、肝动脉解剖变异常见、门静脉供血以及术后侧支供血等常见的原因,TACE术后侧支血管的形成影响了疗效;如果多次TACE治疗会加剧肝功能衰竭,发生肿瘤复发也很难进一步控制。近些年,伴随影像学及微创技术的进展,各项微创技术得以很快发展。RFA治疗肝癌的成功开辟了肝癌介入治疗的新方法[2]。特别是用RFA治疗小肝癌,其疗效等同于传统的根治性手术[3-4]。所有治疗都有它的局限性,为了取得更好的疗效,如何正确选择适宜的综合治疗成为目前肝癌诊疗的首要问题。选择合适的治疗方法实施个体化的诊疗方案,可以增加患者获益率,尚未形成统一的共识。回顾分析我院自2014年1月—2018年1月期间治疗的81例原发性肝癌患者,做如下分析。
1 资料与方法
1.1 一般资料 收集我院在2014年1月—2018年1月期间符合条件并病例资料完整,病灶直径<5cm的81例原发性肝癌患者为研究对象。65例患者经肝穿刺活检后病理证实,其余患者均依据病史、甲胎蛋白(AFP)监测、肝脏超声、CT、MRI等检查明确诊断。TACE组:病灶<3个、无门静脉癌栓,总计42例。RFA组:病灶<3个、无门静脉癌栓,总计25例。联合治疗组:满足经TACE组条件或满足RFA组条件,总计14例。三组患者一般资料比较差异无统计学意义(P>0.05)。见表1。

表1 三组患者临床资料分析
1.2 选择标准 纳入标准:(1)肝功能分级Child A级或Child B级,既往未发生肝性脑病;(2)每个病灶直径<5cm,且不超过3个病灶;(3)治疗前无明确肝外转移或大量顽固性腹水;(4)无门静脉及肝静脉癌栓;(5)无明显凝血功能障碍;(6)不能手术或明确拒绝手术者。排除标准:要求自动出院或中途放弃治疗者,或病例资料随访不全者。
1.3 仪器设备 美国ANGO公司瑞达(RITA) RITA 1500X射频发生器为全自动化系统、1500X型射频发生器、StarBurst XL型射频电极针,发射频率为460Hz,温度控制范围在15~125℃;射频探针打开呈球状,最大径为5cm,消融后形成3~5cm球形凝固区,术中可经注水孔注入盐水、无水酒精等加强治疗效果;SIEMENS公司生产的SOMATOM 16排螺旋CT。
1.4 治疗方法 患者术前常规完善血尿常规、肝肾功能、甲胎蛋白、凝血功能、心电图、腹部B超、螺旋CT等检查,以全面评估患者身体状况,除外有禁忌证者。TACE:术前禁食水6h,局麻下采用改良Seldinger法行股动脉穿刺插管,先超选肠系膜上动脉行间接门脉造影明确门静脉的血流及方向、有无癌栓,有无向肝内肿瘤供血的异常起源血管,再插管肝动脉造影了解肿瘤的大小、数目、分布及供血情况,后微导管超选择插管至肿瘤供血分支血管,将化疗药物(顺铂、丝裂霉素、表柔比星)和液化碘油10~15ml按照肿瘤体积按1∶1混合后经导管推注,最后再次造影显示供血动脉栓塞完全。RFA:常规术前准备,常规止痛治疗,局麻后在CT引导下行RFA术。患者取合适体位,在CT引导下选择最佳穿刺路径,注意避免肝内重要血管及胆管、胆囊,膈肌、临近脏器、胸腔脏器的损伤。术前在CT引导下监视射频针进入靶点,根据病灶大小展开射频针,温度区间在85~105℃,初始功率定为50W,逐渐调至90W,达到预设温度后,消融时间一般为10~15min,肝内病灶消融结束后,退针过程中均行针道消融,减少针道出血和针道转移的概率。消融范围为越过肿瘤边界0.5cm。术后常规行上腹部扫描,了解病灶内及周围有无出血及其他损伤。如患者条件允许,可选择超声造影评估消融疗效。联合治疗:先行TACE治疗,l~2周后再行RFA治疗。TACE与RFA的方法与上述各单纯治疗时相同。
1.5 疗效评价 TACE和RFA疗效评价客观指标有:病灶的坏死范围、区域,内部有无血流。消融疗效判断的关键是肿瘤病灶增强扫描有无强化(肿瘤发生凝固性坏死后无活性)。肝癌RFA治疗后靶区周围的环状强化与残余癌鉴别要点为环行强化形态及密度改变不同。疗效评价分级:完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD)。总缓解率(RR):CR+PR率(稳定病例不计入)。并比较患者手术前后AFP浓度、瘤体大小及血供等变化来综合评价疗效。
1.6 随访 所有患者定期复查、电话等方式进行随访,观察肿瘤大小变化、血清肿瘤学指标水平。比较三组患者治疗后血清ALT变化、AFP下降率、病灶缓解率及6个月、1年、2年的生存率。随访时间最短24个月,最长36个月。

2 结果
2.1 三组患者的不良反应发生情况比较 三组患者在手术过程中部分出现肝区疼痛,出汗、心慌等不适。术后部分患者出现纳差,2d后可恢复,未见明显差异。部分患者出现转氨酶轻度升高,总蛋白降低,1周后恢复正常。各组患者均未出现严重并发症,术后顺利出院。
2.2 三组患者的术后缓解率、血清AFP浓度变化及生存率比较 TACE组、RFA组、联合治疗组治疗后3个月的缓解率分别为52.4%、68.0%、85.7%;以联合治疗组缓解率最高。三组患者治疗后1个月AFP浓度较治疗前均明显下降,差异有统计学意义(P<0.001)。治疗后三组患者2年生存率分别42.7%、52.4%、66.9%。见表2~4。
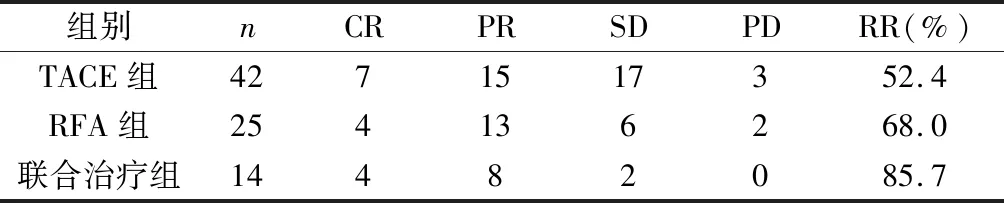
表2 三组患者治疗后3个月的缓解率
3 讨论
在我国,有大量的慢性病毒性肝炎患者,因此肝癌的发病率较其他国家或地区明显升高,它治疗仍是医学界关注的难点与焦点。目前公认的治疗方法首选是手术切除和肝脏移植,但是,在我国多数患者为肝硬化基础上发生的肝癌,只有不到5%的患者符合这一条件。肝脏为肝动脉及门静脉双重供血的特殊器官,吴美艳[5]用B超对TACE术后血流研究结果证实:TACE术后肝功能未见明显异常,门静脉血流无变化,但是给肿瘤滋养动脉血流明显下降。RFA是近些年才引入到肝癌的治疗领域,通过高频的射频波,它使组织细胞之间发生等离子震荡后发热,引起凝固及坏死,从而灭活肿瘤[6]。实验研究已证实高热可杀死局部肿瘤细胞,并同时破坏许多细胞器;大量坏死肿瘤细胞可刺激机体产生抗肿瘤免疫,提高了机体的免疫力,控制局部肿瘤的进展,从而延长患者生存期[7]。从TACE和RFA治疗机理分析,两者联合治疗可以互补,进而更大地发挥各自的优点,疗效得以提高。分析原因如下:(1)TACE治疗栓塞滋养血管,肿瘤细胞发生缺血缺氧坏死,原来细胞对温度敏感性增加,在此基础上行RFA治疗,减少血流带走的热量,提高疗效,且减少RFA后出血的概率;(2) TACE术后碘油沉积增加了肿瘤的阻抗,提高RFA的热能效应;(3)RFA清除肿瘤中心或外周残留癌细胞;能引起肿瘤周围滋养动脉闭塞;(4)在RFA术中高温增加肿瘤细胞对化疗药物敏感性,提高药效[8];(5)TACE术后碘油标记出肿瘤轮廓,可引导RFA手术操作,同时TACE可发现微小病灶,提高疗效。所以联合治疗不仅减少数次TACE对肝组织的损伤,还能减少RFA频次,为手术治疗创造机会。

表3 三组血清AFP阳性患者治疗1个月后浓度变化
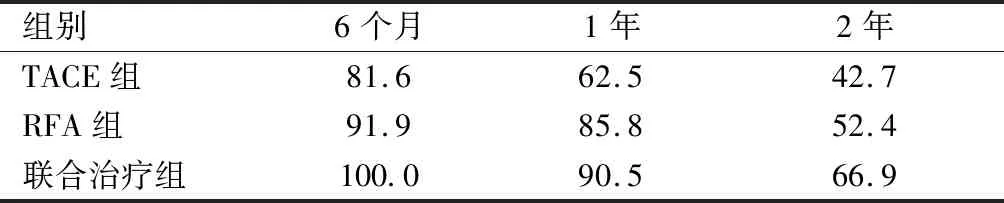
表4 三组患者治疗后的生存率(%)
本研究联合治疗组均为TACE治疗后1周,复查肝功能无异常再续贯RFA治疗;对比TACE组和RFA组,3个月后缓解率联合治疗组最高。比较三组治疗前后AFP的变化,治疗后三组AFP明显下降,差异有统计学意义(P<0.001)。三组患者术后均无严重并发症,部分患者肝功能轻度异常,经保肝治疗后正常。目前国内外学者关于联合治疗两种手术先后顺序暂无统一结论,大部分学者主张TACE治疗因在RFA之前[9],他们的观点认为RFA术后导致肿瘤主要供血血管闭塞,化疗药物及栓塞剂不易经肿瘤血管进入靶区反而影响TACE效果。宋斌等[10]对61例患者行TACE+RFA和RFA+TACE治疗对比分析发现,两组患者在AFP下降值、消融率、肿瘤缓解率、肿瘤血流信号及治疗后6个月、1年的生存率等监测指标均有统计学差异,TACE+RFA组疗效好于RFA+TACE组。笔者分析多项临床研究的结果认为:TACE+RFA联合治疗不单纯是治疗作用的叠加,而是二者治疗作用的相互促进,因此认为先行TACE再行RFA更优。关于TACE术后行RFA治疗的时限性,宋莉等[11]研究认为RFA在TACE术后4~5d进行疗效为佳,可能原因为术后癌细胞缺血对温度的敏感性更高,此观点需大样本研究进一步证实。
随着介入新技术、新材料的快速发展应用,运用综合治疗手段,原发性肝癌的临床疗效显著提高。由于本研究收集的病例数较少,本研究的不足之处为无法行多因素回顾分析对预后的影响,期待大样本的回顾性研究来分析和探讨,并通过多中心大规模随机的前瞻性临床实验得以支持。TACE与RFA联合治疗原发性肝癌安全有效、优势互补,疗效优于其单一疗法,具有很好的临床应用价值和前景。
