PKIB表达对胰腺癌细胞增殖与侵袭影响的实验研究*
2019-12-27程卓鑫王国才曲义坤刘伟新焦成斌
程卓鑫 刘 淘 王国才 曲义坤 徐 剑 刘伟新 焦成斌
佳木斯大学附属第一医院普通外科,黑龙江省佳木斯市 154002
PKIB是一种新的耐热蛋白,它由78个氨基酸残基组成是PKI家族的成员,研究显示PKIB基因与乳腺癌、前列腺癌及肺癌等众多肿瘤的发展密切相关[1-2],尤其是PKIB在乳腺癌细胞增殖中起重要作用[1]。而PKIB表达对胰腺癌细胞生物学行为影响的相关研究较少。笔者通过观察PKIB表达程度的改变对胰腺癌细胞的增殖和侵袭影响,探讨其与胰腺癌发生、发展的关系。
1 材料与方法
1.1 试剂 人胰腺癌细胞的细胞株PANC-1、正常胰腺导管上皮细胞购自中国科学院细胞库。β-肌动蛋白抗体购于美国加州圣克鲁斯生物技术公司。PKIB 抗体购于美国 Abcam (Cambridge, MA, USA)。其余实验所用材料均来自佳木斯大学实验室。
1.2 细胞培养 正常胰腺导管上皮细胞,人胰腺癌细胞株PANC-1培养在37℃、1640培养液加入10%的胎牛血清、青霉素100U/ml、链霉素100μg/ml、空气95%、二氧化碳5%的培养箱中。
1.3 shRNA-PKIB和PKIB过表达基因的构建和转染 shRNA-PKIB和PKIB过表达基因由上海吉玛制药技术有限公司合成。PANC-1细胞(4×105)接种于6孔板,无双抗RPMI 1640孵育24h,使细胞铺板面积至30%~50%,每孔加入LipofectamineTM2000 5μl及shRNA和PKIB过表达基因100pmol分别充分混匀后,于无血清及双抗的培养液中转染,37℃孵育6h后更换新鲜RPMI 1640培养液, 恒温常氧培养箱中继续培养12h后,并按设计进行分组实验。
1.4 Western blot检测PKIB蛋白表达 将经过不同处理的细胞以5×105个/孔接种于6孔板,培养48h后经过均匀加工和RIPS缓冲器超声处理。在4℃12 000g离心10min移除杂质。取50μg总蛋白经十二烷基硫酸钠—聚丙烯酰胺凝胶(SDS-PAGE)电泳分离后,然后移至聚偏氟乙烯(PVDF)薄膜。3%牛血清白蛋白(BSA)固定薄膜,加入一抗,接着PBST洗膜后加入二抗。加入硝基蓝四氮唑后显影。β-actin作为内参照。
1.5 RT-PCR检测PKIB的mRNA表达水平 应用Applied Biosystems 7300 Fast Real-Time PCR系统。引物由Applied Biosystems Primer Express 3.0特定设计。特定引物用BLAST 程序固定。每20μl反应包含 1x SYBR® Premix Ex Taq TM II,10μM正向和反向引物、0.4μl ROX reference染料、cDNA 2μl。ABI 7300 测序仪反应条件:95℃30s、95℃5s共40个周期、60℃30s。靶基因表达的相关定量(RQ)由2-ΔΔCT方法计算。RQ分析的第一步是检测标准β-肌动蛋白(ΔCt)靶基因表达水平。第二步是比较不同样本中标准靶基因表达的不同。每个样品的PCR反应重复3次。
1.6 MTT比色法检测细胞活力 取对数生长期PANC-1细胞以5×103个/孔接种于96孔板。该细胞培养24h后分别做不同处理后标记为shRNA-PKIB细胞组、PKIB过表达细胞组和空转载体对照组,继续在37℃条件下培养72h后各孔加入5g/L MTT 20μl,继续置于37℃ 5%CO2培养箱中培养4h,后各孔加入标准浓度二甲基亚砜(DMSO)200μl,震荡混匀15min,用酶标仪于540nm波长条件下测定吸光度值。实验重复3次。
1.7 结晶紫实验检测细胞存活率 不同的细胞分组以5×103个/孔被种植在6孔板,放置培养皿中培养7d,2~3d换1次培养基。然后用预先保温磷酸盐缓冲液洗涤细胞2次,之后保留的细胞用结晶紫溶液染色2h(0.5%结晶紫,20%甲醇)。将培养皿反复洗涤3次,除去结晶紫溶液。待培养皿在37℃下干燥后用照相机采取样本图片。
1.8 Transwell侵袭小室实验 于Transwell小室中加入60μg Matrigel胶(用2倍体积的无血清RPMI 1640稀释),37℃、30min待胶凝固,在小室下部分为含有10% FBS的RPMI-1640培养基。取对数生长期的细胞(5×104个)常规培养24h,取出小室,PBS洗涤,用棉签小心擦去微孔膜内层的细胞,95%酒精固定,结晶紫染色。每张膜计数5个100倍显微镜视野下的穿膜细胞数,照相并计数。
1.9 统计学方法 定性数据,包括蛋白免疫印迹和细胞图像等,每组至少重复3次。定量数据以均数±SD表示,统计两组之间的差异以双尾非配对t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 在胰腺癌细胞中PKIB的表达上调 为确定PKIB表达与胰腺癌的相关性,首先应用Western blot检测胰腺癌细胞和正常胰腺导管上皮细胞中PKIB的表达。结果胰腺癌细胞与正常胰腺导管上皮细胞相比较PKIB的表达明显上调(图1-1和图1-2)[PKIB:(0.15±0.03)VS(0.30±0.06),t=9.87,P<0.001]。由此说明PKIB可能与胰腺癌的发生、发展存在相关性。

图1-1 Western blot试验检测正常胰腺导管上皮细胞与PANC-1细胞PKIB蛋白的表达情况
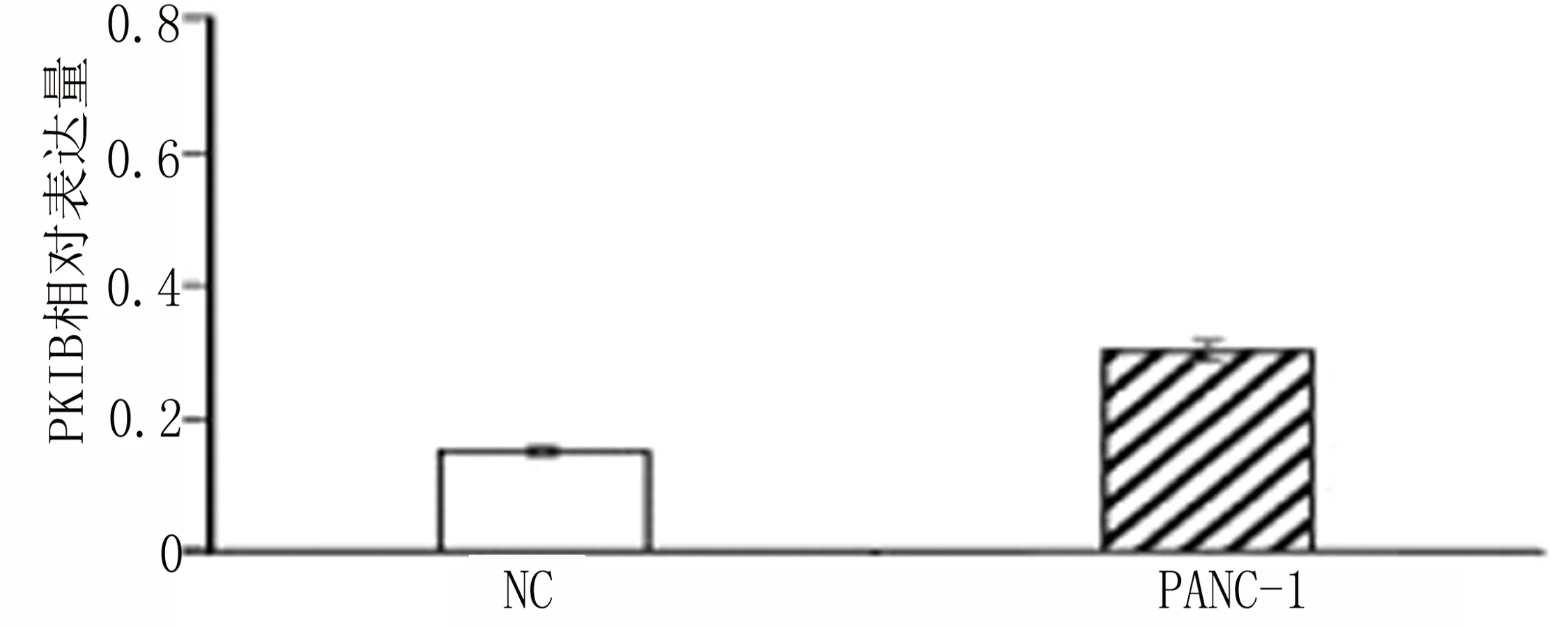
图1-2 正常胰腺导管上皮细胞与PANC-1细胞PKIB蛋白相对表达量
2.2 PKIB过表达促进PANC-1细胞增殖 PKIB过表达基因转染PANC-1后,应用RT-PCR与Western blot检测PKIB mRNA与蛋白的表达情况,结果表明PKIB mRNA表达增多(图2-1)[mRNA:(1.00±0.30)VS(2.20±0.51),t=9.23,P<0.001],同时蛋白表达增多(图2-2和图2-3)[PKIB:(0.30±0.09)VS(0.59±0.11),t=9.73,P<0.001]。然后应用MTT检测PKIB过表达对PANC-1存活能力的影响,结果表明PKIB过表达PANC-1的存活能力增强(图2-4)[存活:(1±0.29)VS(1.7±0.34),t=7.22,P<0.001]。应用结晶紫实验检测PANC-1的增殖能力,结果表明PKIB过表达增强胰腺癌的增殖能力(图 2-5)。以上结果显示PKIB的过表达可促进胰腺癌细胞的增殖,并提高其生存能力。
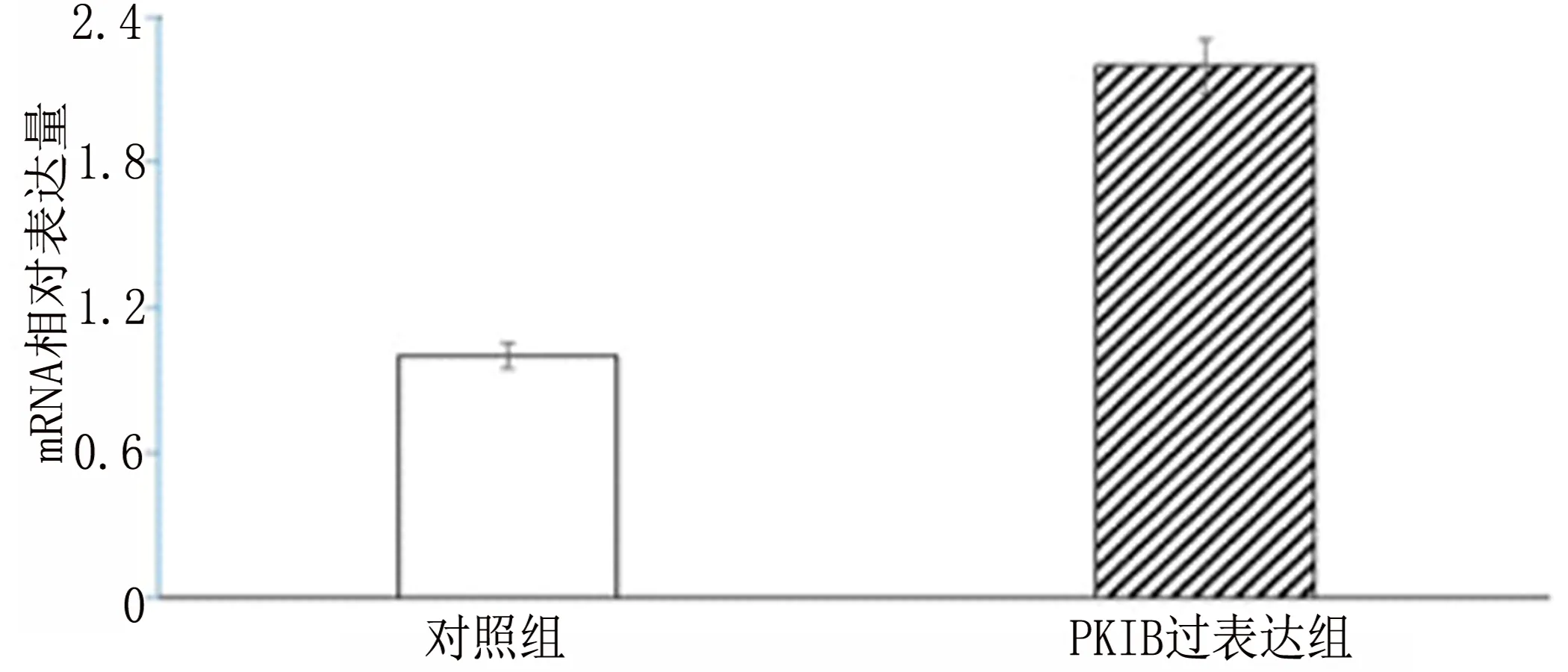
图2-1 RT-PCR检测对照组与实验组mRNA表达情况
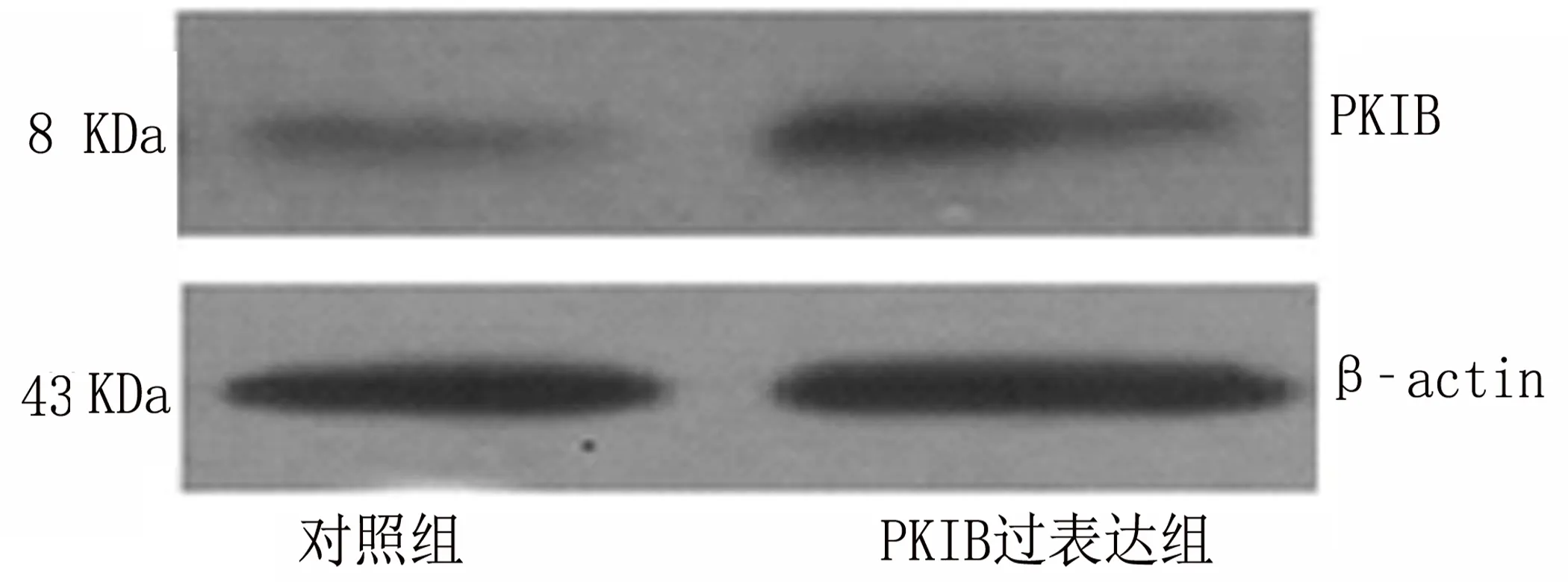
图2-2 Western blot试验检测对照组与实验组蛋白的表达情况
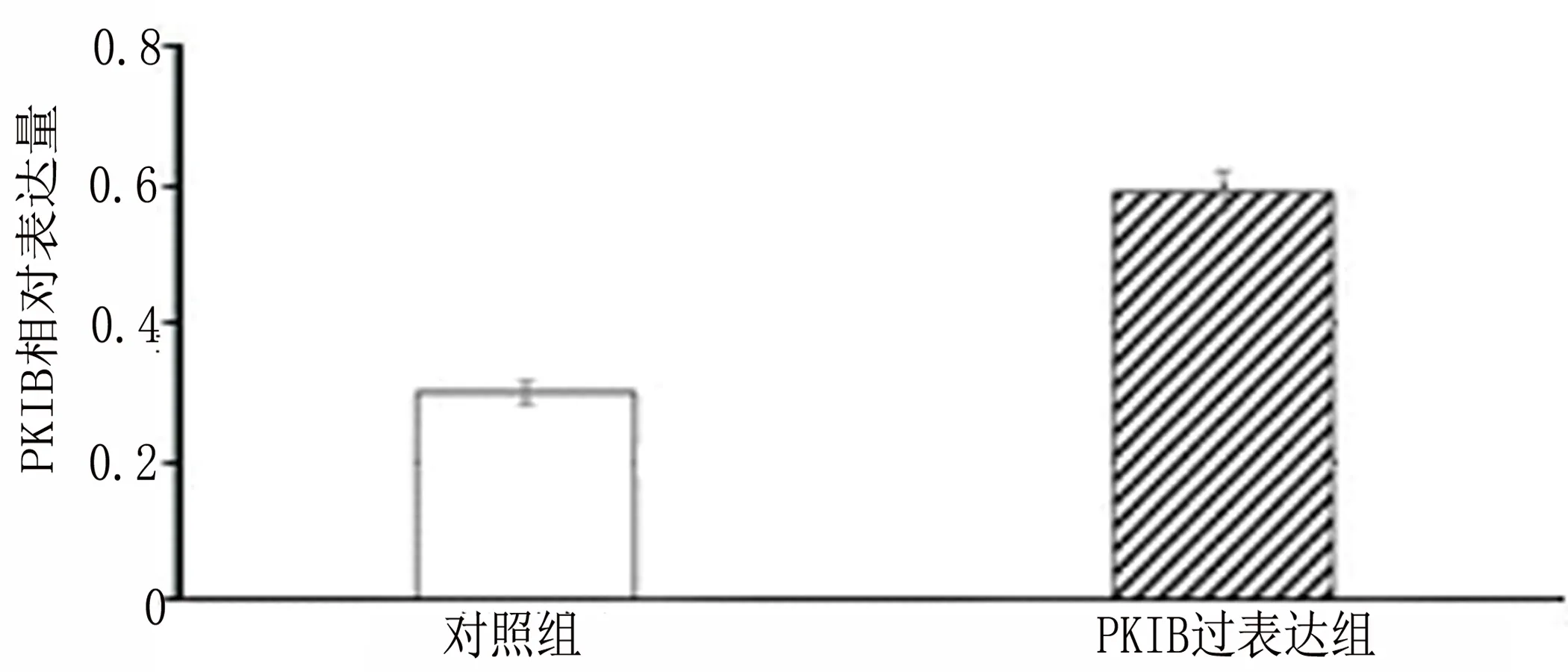
图2-3 对照组与实验驵PKIB蛋白相对表达量
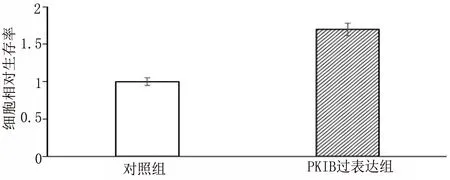
图2-4 MTT试验检测对照组与实验组细胞间的相对活力
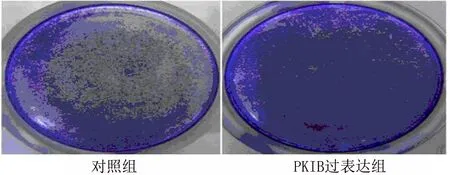
图2-5 结晶紫试验检测细胞增殖能力
2.3 沉默PKIB表达可抑制PANC-1细胞增殖 shRNA-PKIB转染PANC-1后沉默PKIB的表达PKIB mRNA(图3-1)[mRNA:(1.00±0.26)VS(0.30±0.08),t=11.67,P<0.001]与蛋白表达量明显减少(图3-2 和图3-3)[PKIB:(0.28±0.05)VS(0.06±0.01),t=9.23,P<0.001]。应用MTT检测PKIB表达减少对PANC-1存活能力的影响,结果表明沉默PKIB表达降低PANC-1的存活能力(图3-4)[存活:(1.00±0.39)VS(0.53±0.20),t=4.85,P<0.001]。应用结晶紫实验检测PANC-1的增殖能力,结果表明沉默PKIB表达抑制PANC-1的增殖(图3-5)。由此说明沉默PKIB表达可抑制PANC-1细胞增殖,降低其存活能力。
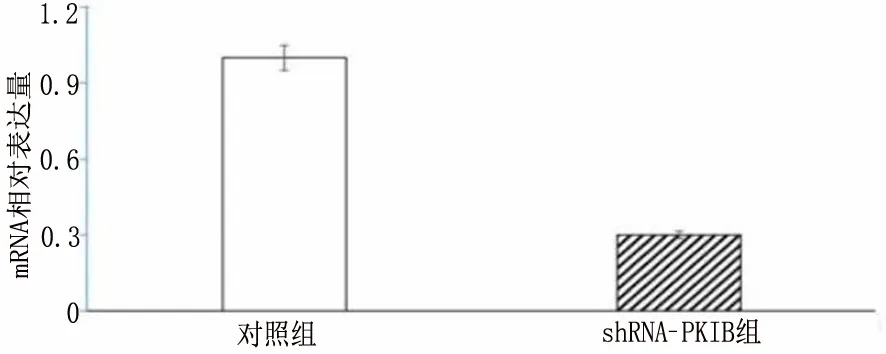
图3-1 RT-PCR检测对照组与实验组mRNA表达情况

图3-2 Western blot试验检测对照组与实验组蛋白的表达情况

图3-3对照组与实验组PKIB蛋白相对表达量
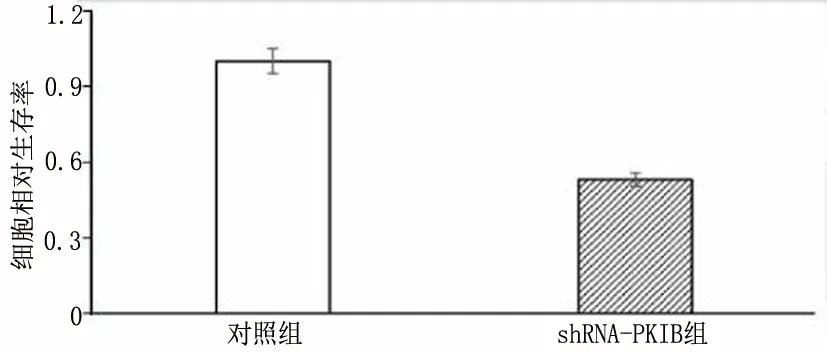
图3-4 MTT试验检测对照组与实验组细胞间的相对活力
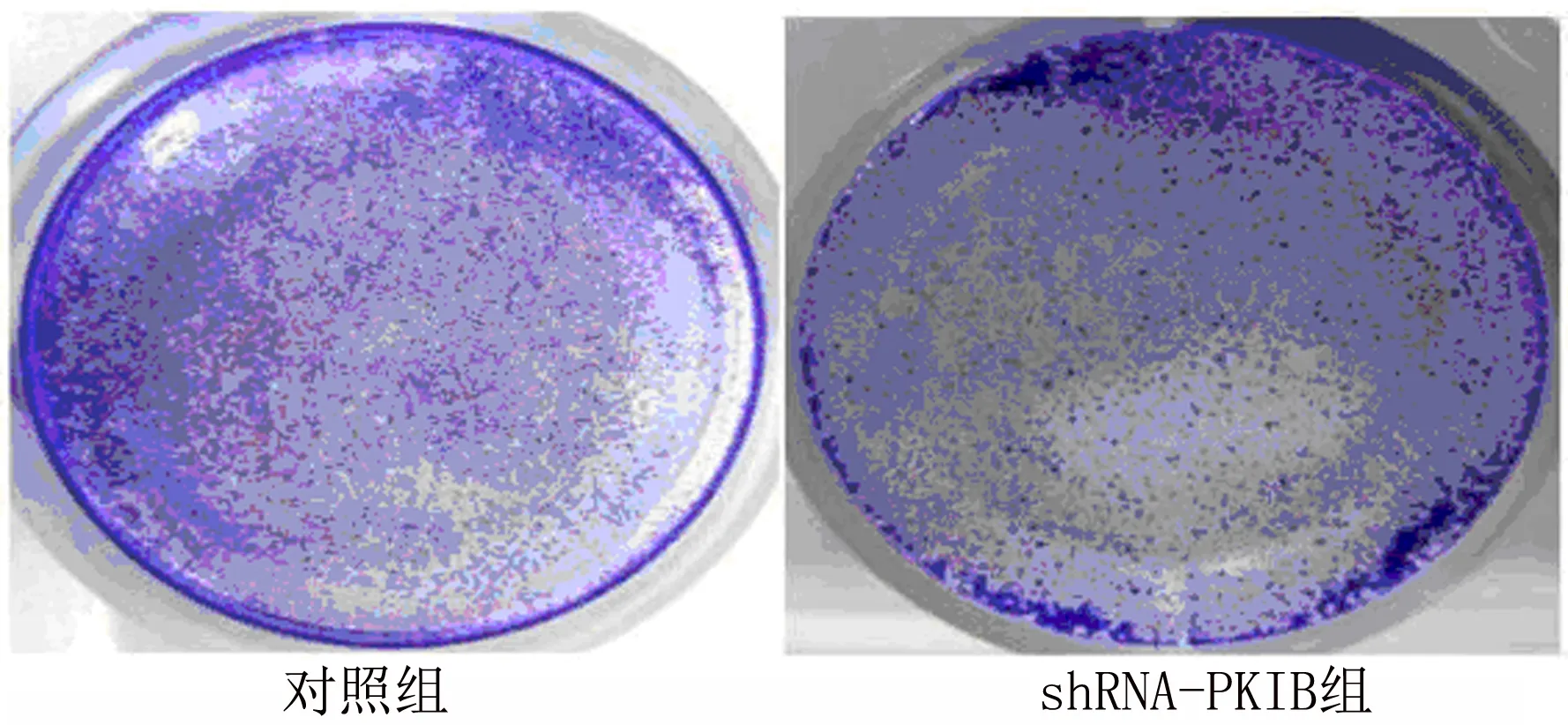
图3-5 结晶紫试验检测细胞增殖能力
2.4 PKIB表达程度影响PANC-1侵袭能力 胰腺癌细胞的侵袭是导致胰腺癌患者死亡的主要原因。通过检测PKIB的表达程度来说明其对胰腺癌细胞侵袭能力的影响。结果表明PKIB过表达增强PANC-1侵袭能力(图4-1和图4-2)[侵袭:(1.00±0.32)VS(2.70±0.39),t=15.64,P<0.001],沉默PKIB表达后PANC-1的侵袭数明显减少(图4-3和图4-4)[侵袭:(1.00±0.26)VS(0.40±0.14),t=9.23,P<0.001]。由此可说明PKIB在胰腺癌的发生、发展中起到关键作用。

图4-1 Transwell侵袭试验

图4-2 对照组与实验组侵袭细胞相对数
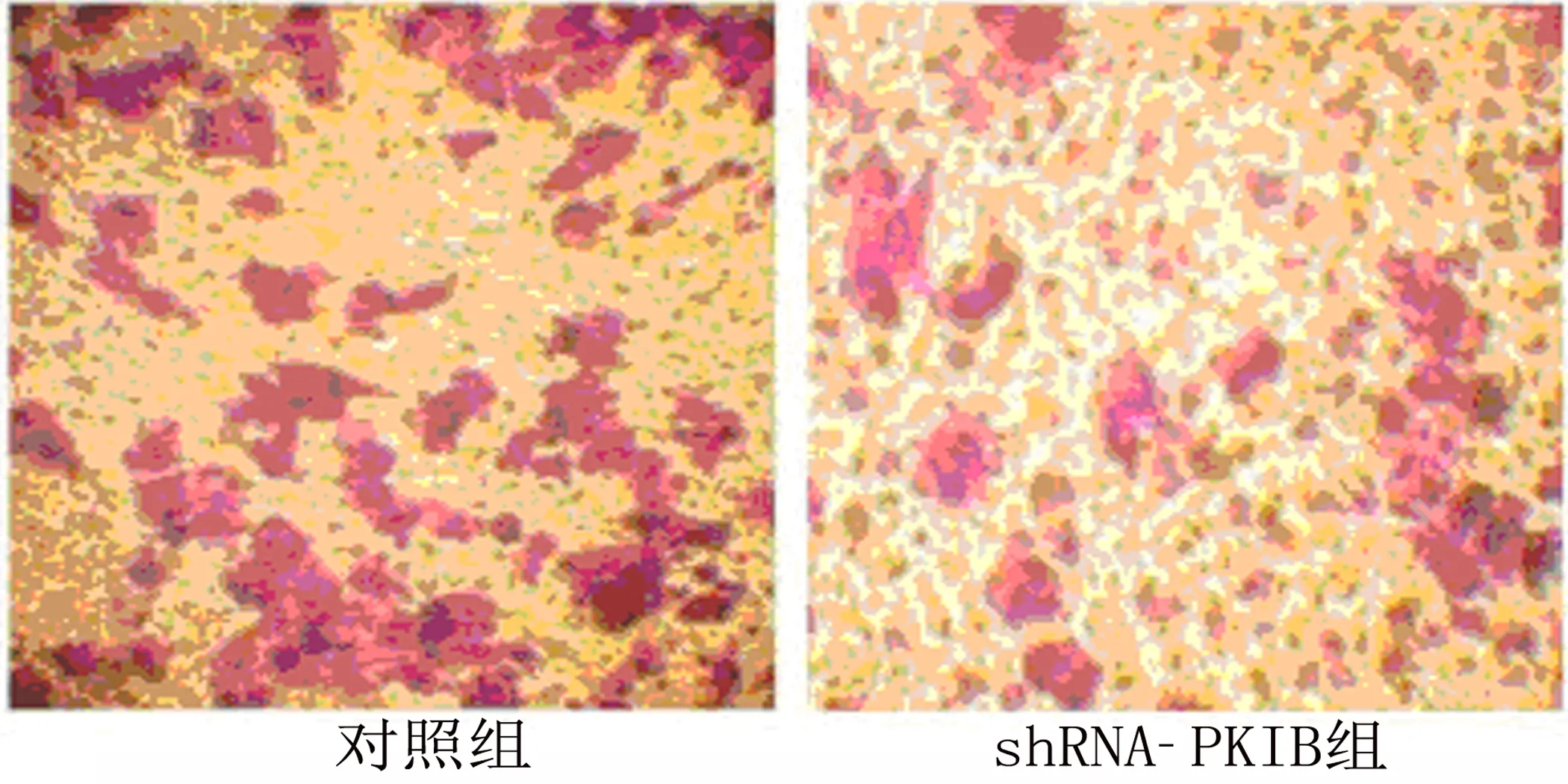
图4-3 Transwell侵袭试验
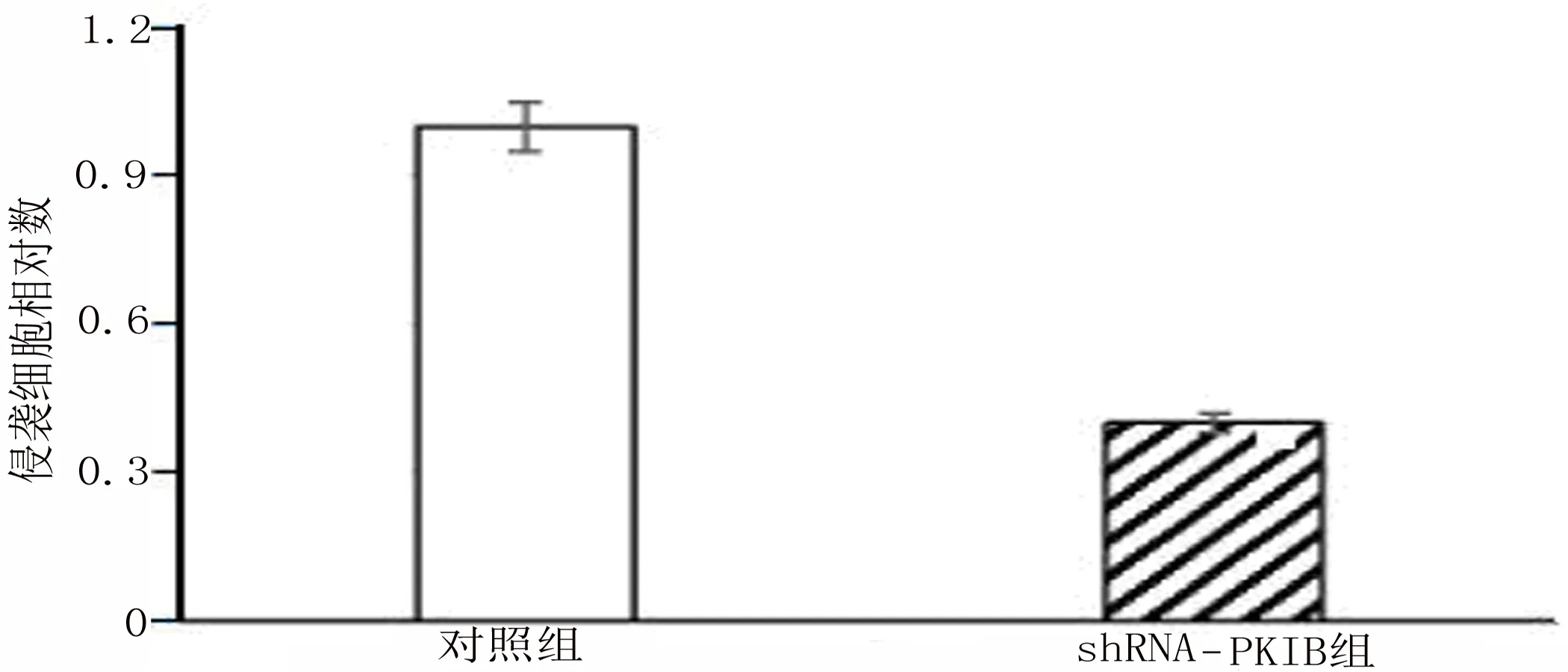
图4-4 对照组与实验组侵袭细胞相对数
3 讨论
胰腺癌是常见的消化系统恶性肿瘤,目前5年生存率不足5%[3]。胰腺癌临床发病隐匿,发展迅速,临床上的确定诊断病例大多为晚期,大部分患者就诊时已失去手术机会,而进展期胰腺癌的治疗由于其恶性度高,对化疗药物有耐药性,当前尚缺乏理想的化疗药物。胰腺癌患者的低生存率和对化疗药物的敏感性差是目前胰腺癌治疗中面临的最大困难,然而靶向分子治疗已成为胰腺癌治疗的新热点。PKIB是一种新的耐热蛋白,它由78个氨基酸残基组成是PKI家族的成员,PKI包括3个不同的亚型:PKIα、PKIβ、PKIγ,每个亚型在脑中均有表达。PKIβ最初是从兔睾丸分离得到,在人和大鼠组织中也被证实[5]。已有研究表明PKIB基因与众多肿瘤的生物学行为密切相关。PKIB的表达对乳腺癌的发生、发展起重要作用,并且与Akt存在密切的关联[1]。PKIB过表达可增强前列腺癌的侵袭能力,同样与Akt关系密切[2]。而先前大量的实验研究表明Akt的异常表达与激活可调控胰腺癌细胞的生长和凋亡,影响胰腺癌细胞的生存能力,并对胰腺癌细胞的侵袭能力起重要作用[6]。PI3K/Akt信号通路广泛参与细胞增殖、生存、抗凋亡,59%的胰腺癌患者中发现存在PI3K/Akt信号通路[7],本实验就此探究PKIB表达对胰腺癌增殖与侵袭的影响。本研究发现胰腺癌细胞和正常胰腺导管上皮细胞相比PKIB的表达明显上调。而且PKIB表达程度与胰腺癌细胞的增殖和侵袭密切相关。由此可说明PKIB极可能作为一种致癌基因调控胰腺癌的增殖和侵袭。
肿瘤细胞的无限增殖及转移是肿瘤发生并导致患者死亡的重要原因,而肿瘤细胞增殖能力的提升和其凋亡的抑制直接导致了肿瘤细胞的过度增长。以此为出发点可为肿瘤的分子靶向治疗提供一个新的靶点。本实验研究显示PKIB的表达程度与胰腺癌的生物学行为息息相关。PKIB过表达促进PANC-1细胞的增殖,而沉默其表达可抑制PANC-1细胞增殖。由此可说明PKIB参与胰腺癌细胞的增殖并且起促进作用。导致癌症患者死亡的另一重要的原因为肿瘤细胞的侵袭和转移。本实验证明了PKIB表达对胰腺癌细胞的侵袭起重要作用。结果表明PKIB过表达增强PANC-1侵袭能力,而沉默PKIB表达抑制PANC-1侵袭能力。以上结果虽然可证明PKIB作为原癌基因参与调节胰腺癌细胞的增殖,但其作用机制和相关信号转导通路的确定还需进一步的研究。此外,本实验是在体外细胞系进行,PKIB对发病的影响还应在动物实验行更深一步研究。
综上所述,PKIB的表达是胰腺癌细胞增殖和侵袭的关键调节器,影响了胰腺癌细胞的生物学行为。调节PKIB的表达或许是胰腺癌治疗的一种新策略,为胰腺癌的治疗提供了新的、潜在的治疗靶点。
