心电图V1导联P波终末电势水平对急性冠脉综合征患者预后的影响
2019-12-26孙萌高永红李长运林慧中
孙萌,高永红,李长运,林慧中
(北京航天总医院:1干部医疗科,2心血管内科,北京 100076;3福建医科大学附属协和医院心血管内科,福州 350001)
1964年,有学者最早提出V1导联P波终末电势(P wave terminal force in lead V1,PtfV1)的概念,并在心瓣膜病方面对其进行了研究[1]。国内外学者先后发现PtfV1在冠心病、肺源性心脏病、心力衰竭、高血压等方面均具有临床应用价值。急性冠脉综合征(acute coronary syndrome,ACS)患者心肌会有
不同程度的缺血、坏死,从而引起心腔内血流动力学变化,如心功能不全等,导致心房的负荷变大,可能使PtfV1值产生变化[2]。PtfV1的改变与一系列心血管事件具有相关性,甚至可出现在心房形态发生改变(如增大)之前。本研究旨在探讨PtfV1对ACS患者心血管事件发生率的影响。
1 对象与方法
1.1 研究对象
收集2017年5月至2018年6月期间在北京航天总医院干部医疗科及心血管内科住院治疗的ACS患者308例。纳入标准:(1)年龄在18~80岁之间;(2)确诊为ACS,包括不稳定型心绞痛、非ST段抬高型ACS和ST抬高型心肌梗死,诊断依据为《2015 急性ST段抬高型心肌梗死诊断和治疗指南》[3]和《非ST段抬高型急性冠状动脉综合征诊断和治疗指南(2016)》[4];(3)配合随访。排除标准:(1)心律失常(心房颤动,心房扑动,室性心动过速,心室颤动,心室扑,房性心动过速,交界性心动过速等);(2)心脏永久起搏器植入史;(3)心脏瓣膜病、先天性心脏病、心肌病等。本研究经北京航天总医院伦理委员会审核批准,伦理批准文号为KS20190801。
1.2 PtfV1的测量及分组
患者入院后均采用清华心仪12道数字心电图机EM-1201记录同步12导联心电图(走纸速度为25 mm/s,振幅为1 mV/10 mm),以窦性心律为前提,测量PtfV1值。PtfV1的计算为:当V1导联P波呈正负双相时,以终末负性P波振幅(mm)乘以负向P波的时间(ms)的绝对值计算(单位为mm·ms);当呈直立时,以0计算。采用分规进行测量时,自P波起始水平线下缘作水平延长线与P波下降支相交,此交点与P波终点之间的水平间距为P的负向波宽度,水平线与负向波底端的垂直距离为波的深度(如P波终点偏离参考水平线,测量方法仍然相同),对同一心电图多次重复测量后分别在直尺上读取数值,取平均值。对PtfV1值的界定范围尚无统一意见,多数文献资料提示正常人PtfV1值大多数为0,少数人<20 mm·ms,如>40 mm·ms则为异常[5,6]。据此,本研究将入选患者分为3组:PtfV1<20 mm·ms组(n=106),20 mm·ms≤PtfV1≤40 mm·ms组(n=100)和PtfV1>40 mm·ms组(n=102)。
1.3 随访
对入选患者进行不少于6个月的随访,以电话随访为主,结合临床随访。以发生主要不良心血管事件(major adverse cardiovascular events,MACEs)为随访终点,包括心源性死亡、需入院的心力衰竭、恶性心律失常、非致死性再次心肌梗死(包括ST段抬高型和非ST段抬高型)、心绞痛或心肌缺血需要再次行血管成形术[经皮冠状动脉介入(percutaneous coronary intervention,PCI)或冠状动脉旁路移植术(coronary artery bypass grafting,CABG)]。
1.4 统计学处理
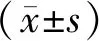
2 结 果
2.1 3组患者一般资料比较
3组患者一般资料比较,差异均无统计学意义(P>0.05;表1)。
2.2 随访结果比较
随访时间6~30(12.5±7.2)个月。截止随访结束,PtfV1<20 mm·ms组发生终点事件2例(占1.89%),均为心力衰竭再入院;20 mm·ms≤PtfV1≤40 mm·ms组发生终点事件7例(占7.00%),其中不稳定型心绞痛1例,再次心肌梗死2例,心力衰竭再入院3例,恶性心律失常1例;PtfV1>40 mm·ms组发生终点事件12例(占11.76%),其中心源性死亡1例,再次心肌梗死3例,不稳定型心绞痛3例,恶性心律失常1例,心力衰竭再入院4例。3组患者MACEs发生率间差异具有统计学意义(P<0.05),其中以PtfV1>40 mm·ms组患者MACEs发生率最高。
2.3 Kaplan-Meier生存曲线分析
3组患者Kaplan-Meier生存曲线见图1。进行Log-rank检验,结果表明,3组患者的MACEs发生率间差异具有统计学意义(χ2=8.152,P=0.017),其中PtfV1<20 mm·ms组患者MACEs发生率显著低于PtfV1>40 mm·ms组(χ2=8.079,P=0.004)。
3 讨 论
本研究结果显示,在ACS患者中,随着PtfV1值增大,心血管事件的发生率也随之上升,以PtfV1>40 mm·ms组MACEs发生率最高,提示PtfV1的值与心血管事件发生率有关,可以作为ACS患者远期心血管事件发生率及预后的预测指标。心电图P波是左、右心房除极时产生的波形,右心房先除极产生P波的前半部分,左心房后除极产生P波后半部分,当心房传导异常时将出现P波时限及振幅的变化。随着心力衰竭患者心功能分级增高,心肌收缩力下降,致使心搏出量下降,舒张末期压力增加,引起左心房容积和压力负荷过度增加、左房肥大、左房缺血或房间束供血不足[7],这些原因可引起左房除极时间延长及除极向量增大,导致P向量环比正常更指向左后并偏上,致使PtfV1值增大。当心力衰竭纠正后,心肌收缩力有所改善,心房容积及压力降低,PtfV1值也随之减小,故PtfV1与患者心功能间有密切关系[8]。此外,PtfV1值的大小与患者发生恶性心律失常亦有一定相关性。有研究显示,随着PtfV1值增大,心血管疾病患者恶性心律失常的患病率明显增高[9,10],这可能与多种因素有关。(1)随着PtfV1值增大,患者可伴随心肌结构的改变及不同程度的损害,窦房结、房室结的自律性降低;(2)PtfV1值增大是基于各种原因引起的房间束传导时间延长、左心房传导延迟,而这正是心力衰竭患者并发心律失常的常见病因;(3)心房细胞溶解、消失,最后由纤维结缔组织代替,房间束可受累,致房间隔传导、房内传导延缓。另有研究显示,PtfV1的变化与肺源性心脏病、冠状动脉血管病变等均有一定相关性。近年有国外的研究显示,在社区人群中PtfV1值增大与全因死亡率和心血管死亡率风险增加相关[11]。

表1 3组患者一般资料比较Table 1 Comparison of baseline data among three groups
PtfV1: P wave terminal force in lead V1; LDL-C: low-density lipoprotein cholesterol; PCI: percutaneous coronary intervention; CABG: coronary artery bypass grafting; MI: myocardial infarction; LVEF: left ventricular ejection fraction. 1 mmHg=0.133 kPa.
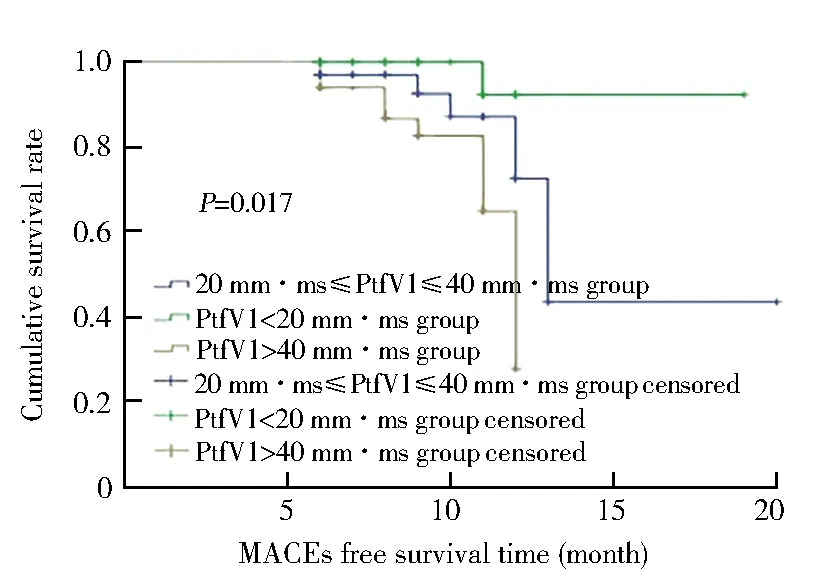
图1 3组患者Kaplan-Meier生存曲线Figure 1 Kaplan-Meier survival curves for three groups PtfV1: P wave terminal force in lead V1; MACEs: major adverse cardiovascular events.
ACS患者由于心肌缺血缺氧可引起左心功能下降及心肌组织纤维化,病情严重的患者在心电图上表现为PtfV1负值增大。ACS患者经急性期处理、病情稳定后,仍可能因冠状动脉粥样硬化病变持续发展,引起恶性心律失常、再次心肌梗死、心力衰竭、甚至心源性死亡,严重影响患者的生活质量和寿命[12,13]。若能在患者入院时常规行心电图检查后测量PtfV1值,可以预警MACEs的发生,对PtfV1值增大的患者可提前给予改善心肌供血及降低左心负荷等预防及治疗,从而降低病死率,改善患者的预后。
综上所述,PtfV1水平在预测ACS患者远期心血管事件发生率方面有重要的临床价值,且PtfV1检测设备简单、方便无创、价格低廉、重复性好,通过PtfV1值的测量,可及时积极采取相应的治疗措施,降低心血管事件发生率,改善患者的生活质量。本研究样本量还不够大,可以在增加样本量的基础上延长随访时间,行进一步研究。
