早期肠内营养干预对老年肺部炎性疾病伴营养不良患者的治疗效果
2019-12-26纪文哲张涛高坤付岭肖文革
纪文哲,张涛,高坤,付岭,肖文革
(唐山市开滦总医院:1营养科,2血液科,4感染科,唐山 063000;3唐山市协和医院急诊内科,唐山 063000)
近年来,随着老龄化进程的加剧,我国老年人群占比呈现逐年上升趋势[1]。而老年肺部疾病,尤其是肺部炎性疾病如支气管炎、肺炎、慢性阻塞性肺疾病等作为临床常见的老年疾病,引起的炎症反应往往导致患者营养恶性消耗;加之老年人自身生理机能减退,免疫力低下,影响了其疾病的康复[2-4]。对于老年肺部炎性疾病患者,其自身营养摄入及消化的能力较年轻群体减弱,且多合并营养不良,加以疾病影响,导致其营养摄取能力减弱更为明显,从而进一步影响患者的免疫功能,加重机体应激反应,使炎症反应增强,最终导致患者肺功能降低,生活质量下降[5,6]。笔者认为,在老年肺部炎性疾病患者中,进行营养干预对其肺功能改善具有积极促进作用,但目前关于早期肠内营养(early enteral nutrition,EEN)支持的应用分析较少,笔者就此进行研究,以期为临床此类患者提供可靠的营养治疗方法,报道如下。
1 对象与方法
1.1 研究对象
选取2017年5月至2018年12月唐山市开滦总医院营养科收治的老年肺部炎性疾病患者96例,年龄65~81(68.79±3.66)岁。所有患者均经过营养风险筛查-营养不良评定-肠内营养支持疗法[7]步骤筛选。根据随机数表法分为对照组和研究组,每组48例。纳入标准:(1)胸部影像学结果显示不规则斑片状阴影、边缘模糊等典型表现及咳嗽、气喘等典型症状;(2)年龄≥65岁;(3)患者及其家属均知情同意。排除标准:(1)合并严重肝肾功能、凝血功能障碍;(2)合并严重免疫系统疾病;(3)合并其他部位炎性疾病;(4)合并外伤或恶性肿瘤、心脑血管疾病。本研究经我院医学伦理委员会批准通过(20190001)。对照组患者男性25例,女性23例,年龄65~79(68.72±3.49)岁;研究组患者男性22例,女性26例,年龄66~81(68.84±3.51)岁。经统计学检验,2组患者年龄(P=0.540)、性别(P=0.867)比较差异无统计学意义,可继续进行研究。
1.2 方法
所有患者入组后均给予抗炎、抗感染、止咳化痰等常规治疗。对照组:给予常规饮食干预,包括指导患者选用清淡且能量丰富的食物,忌辛辣、油腻等。研究组:在对照组治疗基础上加用EEN干预,给予患者瑞素肠内营养乳剂(华瑞制药有限公司,国药准字H20020588,500 ml/瓶)口服,对神志不清醒或昏迷患者使用鼻饲管喂养。该组患者入院24 h后开始干预,按照Hrris Benedict(HB)公式[8]计算基础能量消耗(basal energy expenditure,BEE),男性BEE(kcal/d)=66.473 0+13.751 6W+5.003 3H-6.755 0A,女性BEE(kcal/d)=655.095 5+9.563 4W+1.849 6H-4.675 6A,其中W=体质量(kg),H=身高(cm),A=年龄(岁)。第1天给予患者BEE全量的25%,第2天给予全量的50%,自第3天起给予全量,每天均分为3次口服。2组患者均连续干预14 d。
1.3 观察指标
取干预前后2组患者外周静脉血备用。(1)营养状况。使用全自动生化分析仪检测血清总蛋白(total protein,TP)、白蛋白(albumin,ALB)及血红蛋白(hemoglobin,Hb)水平。(2)肺功能。使用肺功能仪检测患者用力肺活量(forced vital capacity,FVC)、第1秒用力呼气容积(forced expiratory volume in 1 second,FEV1),并计算FEV1/FVC。(3)免疫功能。外周静脉血静置10 min后3 000转/min离心,取上清液,使用流式细胞仪检测CD3+、CD4+、CD4+/CD8+及IgA、IgG、IgM水平。(4)炎症因子。将外周静脉血低速离心后取上清液,酶联免疫吸附试验检测白细胞介素-6(interleukin-6,IL-6)、IL-10和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平。
1.4 质量控制
2组患者除营养干预不同外,其余均完全一致。所有患者均严格按照纳入与排除标准进行筛选。所有患者的原始数据均严格准确录入,数据处理均进行二次检验,避免错误。
1.5 统计学处理
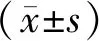
2 结 果
2.1 干预前后2组患者营养相关指标比较
干预前2组患者TP、ALB及Hb水平比较差异不显著(P>0.05)。干预后,研究组患者TP、ALB及Hb水平显著高于对照组(P<0.05)。与干预前比较,干预后对照组ALB显著升高,同时研究组TP、ALB及Hb水平显著升高,差异有统计学意义(P<0.05;表1)。
2.2 干预前后2组患者肺功能比较
干预前2组患者肺功能指标差异不显著(P>0.05)。干预后,研究组FVC、FEV1、及FEV1/FVC水平均显著高于对照组(P<0.05)。与干预前比较,干预后2组患者FVC、FEV1、及FEV1/FVC水平均显著升高,差异有统计学意义(P<0.05;表2)。
2.3 干预前后2组患者免疫功能比较
干预前,2组患者免疫功能相关指标差异均不显著(P>0.05)。干预后,研究组CD3+、CD4+、CD4+/CD8+及IgA、IgG、IgM水平均显著高于对照组,差异均有统计学意义(P<0.05)。与干预前比较,干预后研究组上述指标均显著升高,对照组CD3+、CD4+、CD4+/CD8+水平显著升高,差异有统计学意义(P<0.05;表3)。
2.4 干预前后2组患者炎症因子比较
干预前,2组患者IL-10、IL-6 和TNF-α水平比较差异不显著(P>0.05)。干预后,与对照组比较,研究组患者IL-6、TNF-α水平显著降低,IL-10水平显著升高,差异有统计学意义(P<0.05)。与干预前比较,干预后2组患者上述指标均发生显著改善,差异有统计学意义(P<0.05;表4)。
3 讨 论
肺部炎性疾病,如肺炎、慢性阻塞性肺疾病等是临床常见的老年疾病[8]。研究发现,患者营养状态在上述病情发生发展过程中占据重要地位[9,10],其中营养不良已成为老年肺部炎性疾病患者死亡的独立危险因素之一,对于未达到目标营养状态的患者,其死亡风险显著升高[11]。笔者通过多年工作经验及相关研究分析认为,对于老年肺部炎性疾病患者,其呼吸功能及肺功能减弱、机体长期处于缺氧状态,可能会引起低氧血症及高碳酸血症,从而影响患者消化功能,并可能导致其电解质代谢紊乱,最终影响患者的营养消化及摄取能力。同时,此类患者多使用广谱抗生素进行治疗,导致其肠道菌群及胃肠功能受损,影响营养吸收[13]。除此之外,患者机体缺氧,出现氧合障碍,影响了细胞的正常代谢,因此进一步加重了营养不良。当患者机体出现营养不良后,其肺部顺应性降低,弥散能力减弱,肌肉蛋白及收缩蛋白分解,引起患者呼吸肌萎缩,从而加重病情及机体应激反应,并反向促进患者机体炎性因子的释放。免疫力是维持机体内环境稳定的重要因素[14],若患者营养不良会引起淋巴细胞及抗体生成功能减弱,导致体液免疫及细胞免疫功能降低。有研究指出[15],在各类危重疾病中,患者机体营养状况与其免疫功能呈正相关。由此可见,营养不良、免疫力下降、炎症反应是老年肺部炎性疾病病情发生发展过程中的重要因素,三者互为因果,密不可分。因此采用合理的方法改善老年肺部炎性疾病营养状态可能对病情的转归具有重要意义。

表1 干预前后2组患者营养状况比较Table 1 Comparison of nutritional status between two groups before and after intervention (n=48, g/L,
TP: total protein; Hb: hemoglobin; ALB: albumin. Compared with before intervention,*P<0.05; compared with control group,#P<0.05.

表2 干预前后2组患者肺功能比较Table 2 Comparison of pulmonary function between two groups before and after intervention (n=48,
FEV1: forced expiratory volume in 1 second; FVC: forced vital capacity. Compared with before intervention,*P<0.05; compared with control group,#P<0.05.

表3 干预前后2组患者免疫功能比较Table 3 Comparison of immune function between two groups before and after intervention (n=48,
Compared with before intervention,*P<0.05; compared with control group,#P<0.05.
表4 干预前后2组患者炎症因子比较


GroupIL-10Before interventionAfter interventionIL-6Before interventionAfter interventionTNF-αBefore interventionAfter interventionControl8.12±0.8111.37±1.36∗20.03±2.019.12±0.87∗41.58±4.1619.82±1.99∗Research8.09±0.7916.39±1.60∗#19.89±1.975.87±0.59∗#42.01±4.0910.35±1.08∗#
IL-6: interleukin 6; IL-10: interleukin 10; TNF-α: tumor necrosis factor α. Compared with before intervention,*P<0.05; compared with control group,#P<0.05.
本研究结果可见,实施干预前,2组患者营养状态、肺功能、免疫功能及炎症因子水平差异不显著,而干预后,研究组上述情况均得到显著改善,提示EEN干预可改善基础治疗水平的疗效。笔者通过深入分析发现可能与以下几种情况有关。(1)首先,免疫、炎症及营养三者互为因果,患者营养状态的改善可直接对其免疫功能及炎症反应造成影响;其次,在研究组患者营养乳剂中,含有配比为2.5∶1.0的ω-6、ω-3脂肪酸,其能调节患者炎症平衡,达到抑炎效果;再者,营养乳剂中含有的ω-3脂肪酸即核苷酸,具有促进蛋白质分解因子释放的作用,从而增强免疫力效果;最后,肠内营养干预利于维持患者肠道面黏膜及结构完整,促进T淋巴细胞增殖及免疫抗体的合成。(2)营养干预后,患者营养状态得到改善,肺泡表面活性物质及肺组织弹力纤维数量增加,提高了患者肺顺应性,加之患者免疫功能增强,炎症反应减弱,进一步缓解了炎症对患者肺功能的负面影响,从而使肺功能得到改善。
综上,EEN能有效改善老年肺部炎性疾病患者营养状态,提高患者免疫力并减弱其炎症反应,进而提高患者肺功能,具有临床推广意义。但本研究选取样本较少,且全为我院患者,加之因各类原因无法进行远期的随访,可能对本研究结果可信度造成一定影响,因此有待多中心、大样本实验证实。
