不对称皮层血管征预测急性脑梗死静脉溶栓后出血转化
2019-12-25刘勇林卢节开王雅芝陈仰昆
刘勇林 卢节开 王雅芝 陈仰昆
东莞市人民医院神经内科,广东 东莞 523000
目前,应用重组组织纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)进行静脉溶栓(intravenous thrombolysis,IVT)是治疗发生在4.5 h内的急性缺血性脑卒中(acute ischemic stroke,AIS)的有效方法[1-2]。出血转化(hemorrhagic transformation,HT)是IVT的主要并发症,其中症状性出血转化(symptomatic hemorrhagic transformation,sHT)发生率为3%~7%,是IVT不良预后的独立危险因子[3-4],是接受rt-PA静脉溶栓患者7~10 d内死亡的主要原因[5]。HT的危险因素主要为年龄、基线美国国立卫生研究院卒中评分(National Institute of Health stroke score,NIHSS)、基线血糖水平、基线收缩压、发病至治疗时间(onset to treatment time,OTT)、心房纤颤、CT的早期缺血征象等[6-8]。磁共振(magnetic resonance,MR)磁敏感成像(susceptibility-weighted imaging,SWI)正越来越广泛应用于AIS的诊断中,SWI相中的不对称皮层血管征(asymmetrical cortical vessel sign,ACVS)反映梗死部位低灌注,并与脑梗死90 d不良预后有关[9-10],但尚无ACVS与HT关系的相关研究。本研究旨在探讨ACVS与急性前循环脑梗死IVT后早期HT的关系。
1 资料与方法
1.1病例收集本研究纳入201-01―2018-12入住东莞市人民医院接受rt-PA 静脉溶栓治疗的AIS患者。入选标准:(1)>18岁;(2)MRI证实为前循环AIS;(3)发病4.5 h以内并采用rt-PA治疗;(4)改良Rankin评分(mRS)≤1;(5)有MRI-SWI检查。排除标准:(1)弥散加权成像(DWI)未发现急性病变;(2)MRI证实后循环AIS;(3)IVT后桥接血管内治疗。
1.2变量收集临床资料主要收集人口统计学数据,包括年龄、性别、高血压史、糖尿病、吸烟、房颤和既往卒中、NIHSS评分、OTT、基线血压以及实验室检查资料(包括血小板、血糖等)。所有患者均于发病72 h内完成头颅MR(3.0T,Skyra,Siemens Medical,Germany)检查,包括T1加权成像(T1WI)、T2加权成像(T2WI)、液体衰减反转恢复成像(fluid-attenuated inversion recovery,FLAIR)、弥散成像(diffusion-weighted imaging,DWI)、SWI和磁共振血管成像(magnetic resonance angiography,MRA)。
1.3ACVS的定义ACVS定义为在SWI中,一侧半球出现较另一侧半球更多或更大的低信号的血管影像[11]。典型ACVS见图1。
1.4HT定义按影像学 CT 表现将 HT 分为出血性梗死(hemorrhagic infarction,HI)和 实质性血肿(parenchymal hematoma,PH)。HI 被定义为无占位效应的瘀点性梗死,包括 HI1型(小的瘀点状出血)和HI2型(融合的瘀点状出血);PH被定义为具有占位效应的出血,包括 PH1型(血肿面积小于等于梗死区域 30%伴轻 度占位效应)和 PH2型(血肿面积大于梗死区域 30%伴明显占位效应或梗死灶远隔部位的出血)[12]。sHT定义为NIHSS评分增加≥4 分[13]。
本研究经医院伦理委员会批准。所有受试者均按照《赫尔辛基宣言》获得知情同意。
1.5统计学处理采用SPSS 20.0软件(v.20.0,SPSS Inc.,Chicago,IL,USA)进行统计分析。符合正态分布的连续变量以均值±标准差表示,非正态分布变量以中位值(四分位间距)表示。变量比较采用t检验、卡方检验或Fisher精确检验。将单变量分析中P<0.05的变量纳入二元多变量Logistic回归。统计学意义定为P<0.05(双侧)。
2 结果
2.1一般资料276例AIS患者在发病4.5 h内接受rt-PA静脉溶栓治疗。其中,131例患者因以下原因被排除:(1)IVT后桥接血管内治疗(n=2);(2)基线mRS≥2 (n=2);(3)未能完成MR检查 (n=19),4)DWI未发现急性梗死病灶(n=15),4)后循环AIS(n=53),5)未行SWI扫描(n=40)。因此,共145例患者纳入本研究。纳入组与排除组年龄[(62.2±12.2)岁vs (62.2±11.9)岁,P=0.987)、性别(男性,66.2% vs75.0%,P=0.127)、基线NIHSS[7(4~11)vs 6(4~11),P=0.391]、OTT[(206.4±57.1)min vs(195.2±54.2)min,P=0.391)]差异无统计学意义。35例(24.1%)患者在MRI 的SWI成像上表现为ACVS。43例(42.2%)患者出现出血转化,其中,H1型28例,H2型11例,PH1型2例,PH2型2例,sHT2例。人口学和临床特征见表1。
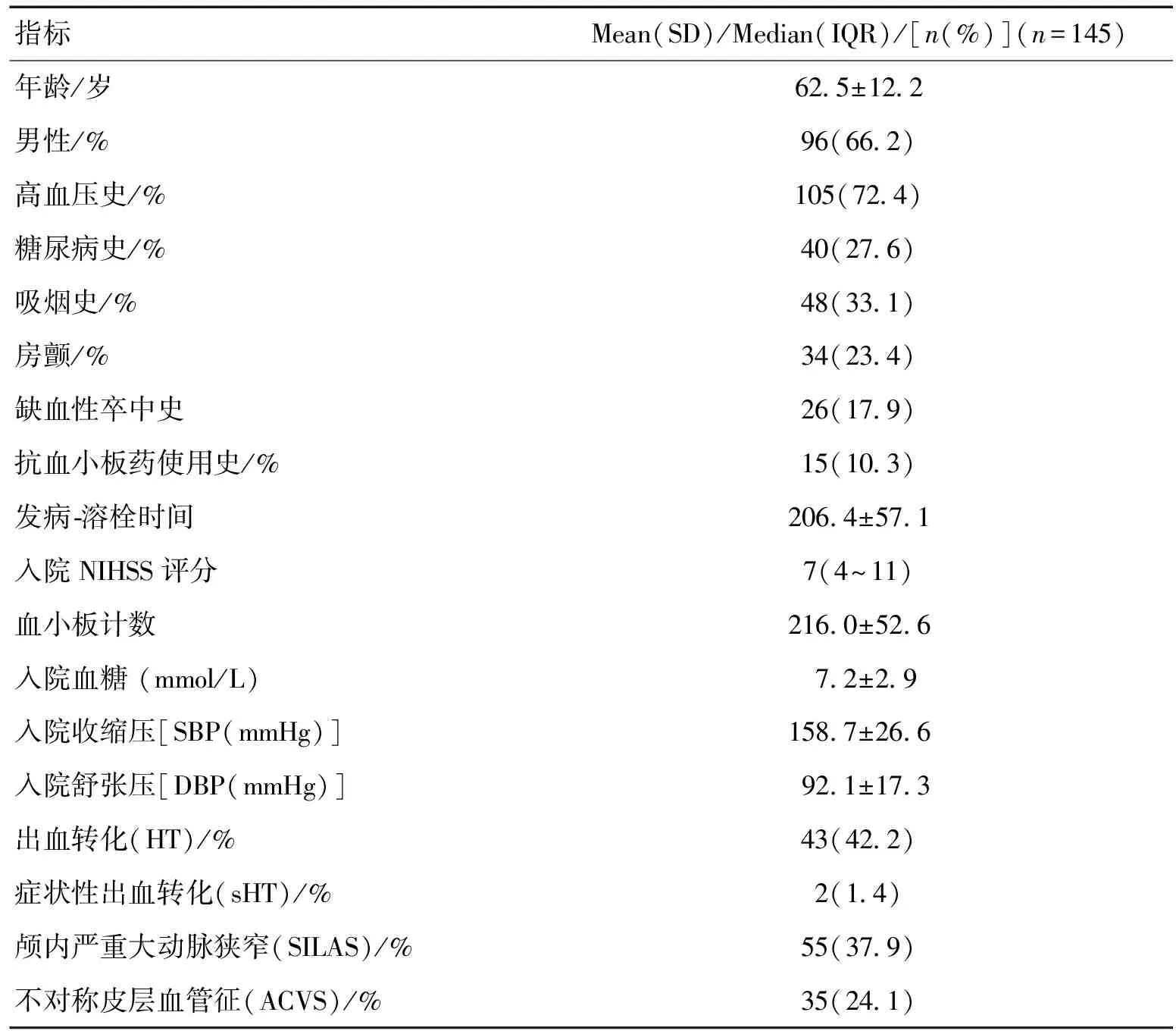
表1 人口学与临床特征 [n(%)]
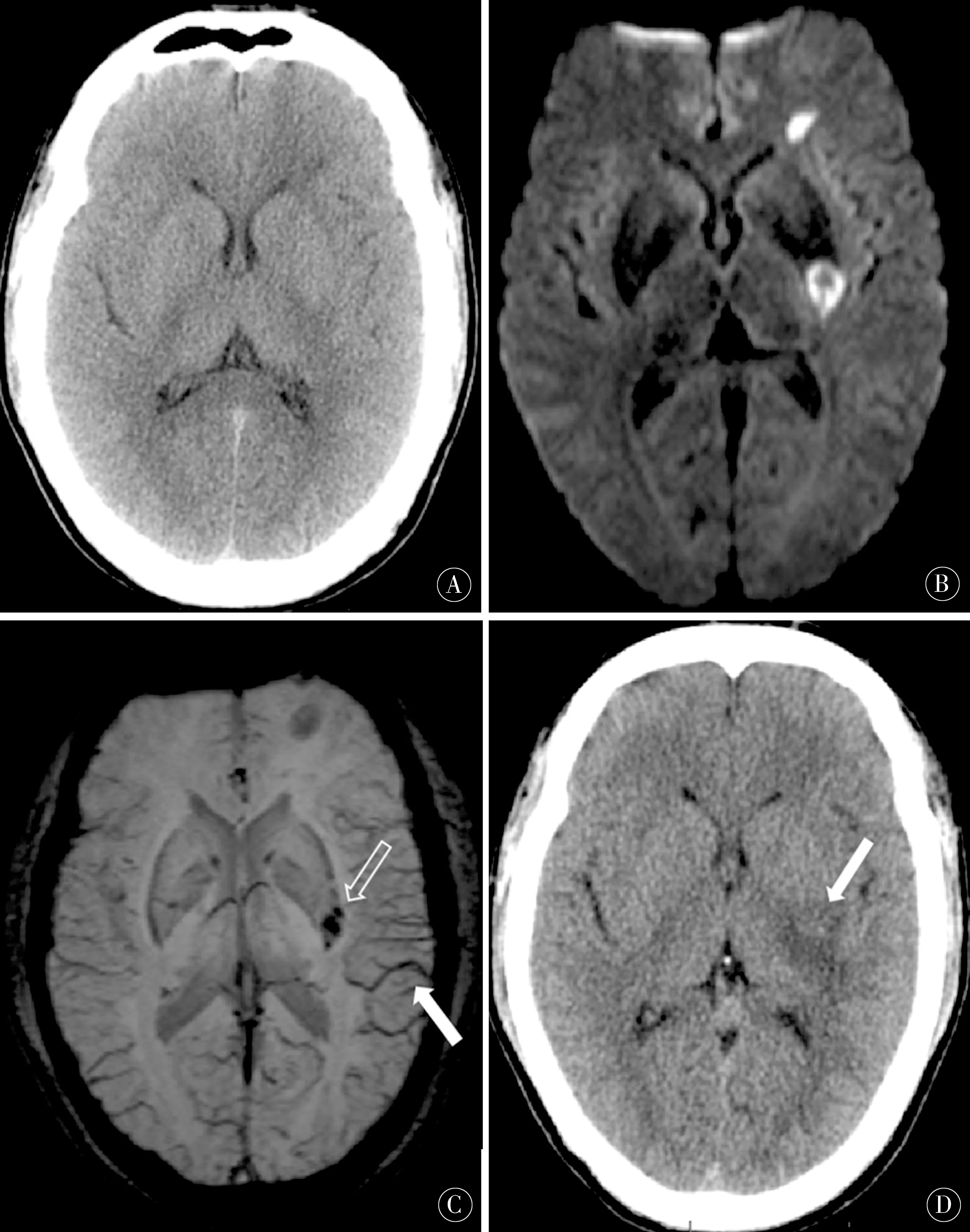
图1 男性,46岁,因右侧肢体乏力4 h入院 急诊头颅CT未见出血(图A),予阿替普酶静脉溶栓治疗;第2天头颅MR-DWI显示左侧基底节区、额叶急性脑梗死(图B);SWI显示左侧大脑中动脉供血区增多、增宽的血管影(不对称皮层血管征,ACVS)(图C,白色箭头);SWI显示左侧基底节区低信号病灶(图C,空心箭头),复查头颅CT显示相应位置高密度病灶(图D,白色箭头),明确为出血转化(HI1型)
2.2单因素分析选取年龄、性别、基线NIHSS、高血压史、糖尿病史、吸烟史、房颤、缺血性卒中史、抗血小板药物使用史、发病-溶栓时间、入院时血小板计数、入院时血糖、入院时收缩压、入院时舒张压、严重大动脉狭窄、不对称皮层血管征纳入分析。结果显示,基线NIHSS(P<0.001)、房颤(P<0.001)、入院时血小板计数(P=0.003)、入院时收缩压(P=0.009)、入院时舒张压(P=0.032)和ACVS差异有统计学意义(P=0.002)。见表2。
2.3Logistic回归分析将单因素分析中P<0.05的参数纳入Logistic回归方程,结果显示,血小板计数(OR=0.998,95%CI=0.978~0.999,P=0.025)、NIHSS (OR=1.096,95%CI=1.007~1.192,P=0.034)、房颤(OR=4.682,95%CI=1.920~11.418,P=0.001)和ACVS(OR=2.960,95%CI=1.208~7.250,P=0.018)与静脉溶栓后出血转化存在显著关系(P<0.05)。Logistic回归结果见表3。
3 讨论
HT可以是缺血性卒中病程中自然转归的结果,发生率约为8.5%[14]。rt-PA静脉溶栓可增加HT尤其是sHT发生率,在ECASS-Ⅱ研究中,溶栓组sHT发生率为对照组的2.5倍,PH2型发生率为对照组的10倍[13]。不同的研究报道的溶栓后 HT发生率存在差异,可能与研究方法、研究对象(种族差异及是否应用抗栓药物等)、影像学检查的类型和时机等因素有关[14]。本研究的HT发生率42.2%,与既往研究所报道的结果相符[15-25]。HT的发生与多种机制有关,包括血脑屏障受损、局部炎性反应、缺血再灌注(氧化应激)和侧支循环的建立等[26]。近年来很多研究探讨了溶栓后 HT的危险因素,包括卒中严重程度(NIHSS评分)、患者特征(年龄、血压、血糖等)、血压变异性、脑微出血、心房颤动史、抗栓药物的应用、白质疏松、粒细胞-淋巴细胞比率等[6,14,27-35]。本研究中,心房颤动为HT的主要危险因素(OR=4.682,P=0.001),卒中严重程度(NIHSS评分)也与HT明显相关(OR=1.096,P=0.034),与既往研究相符。但年龄、血压、血糖、抗栓药物应用等未显示与HT有显著关系,可能与本研究样本数较小有关。
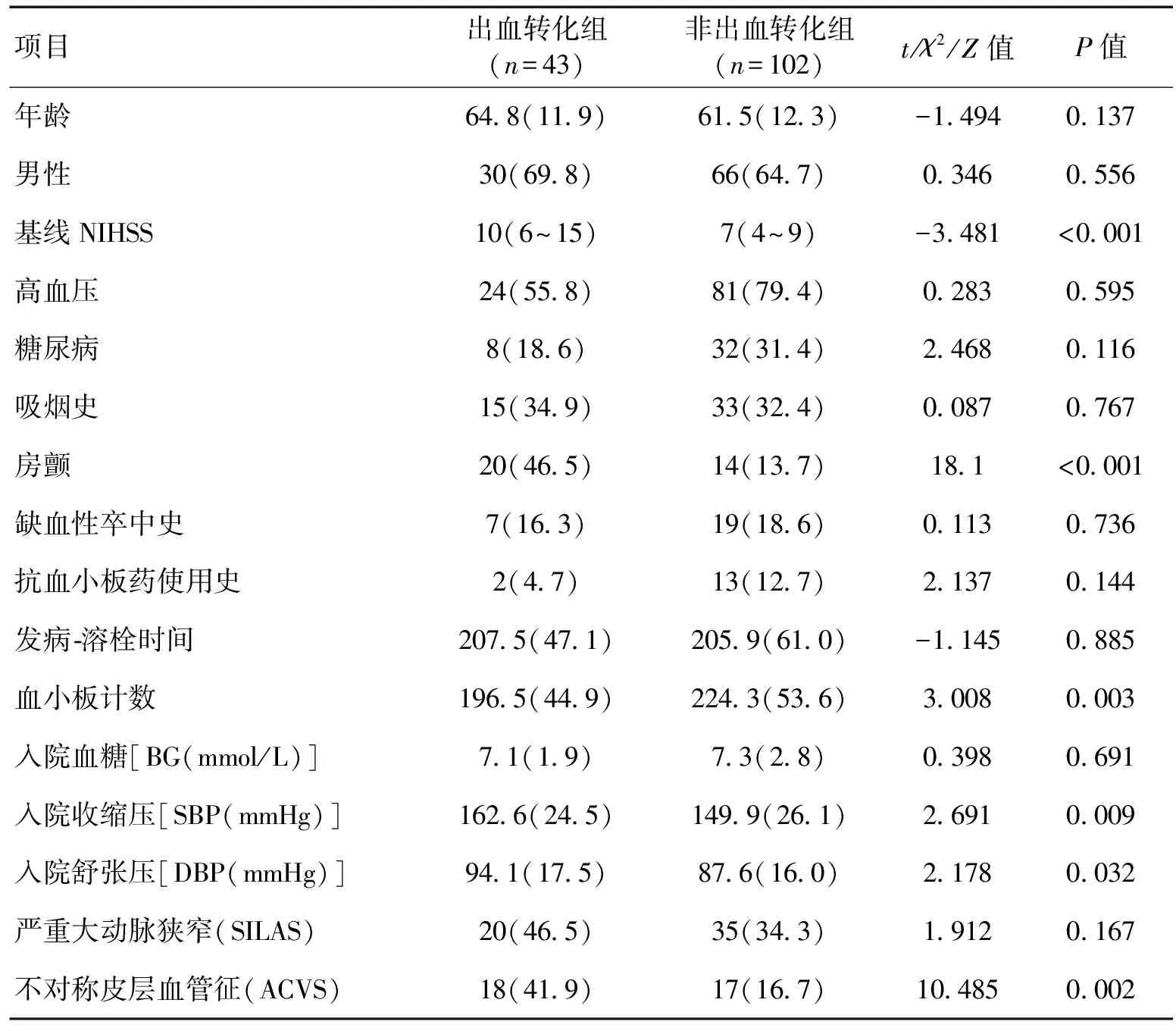
表2 静脉溶栓后出血转化危险因素的单因素分析 [n(%)]

表3 静脉溶栓后出血转化危险因素的多元回归分析
MR的SWI序列对脱氧血红蛋白和含铁血黄素等顺磁性物质高度敏感[36-37],能够提供区域灌注状态的间接信息。近年来,SWI上的不对称皮质血管征(ACVS)被证实与AIS患者预后不良有关[9-10]。ACVS的存在被推测与脱氧血红蛋白的增加有关[37-38],导致血氧饱和度降低[39]。一些研究表明ACVS可以作为低灌注的指标[40]。而低灌注、缺氧导致血脑屏障破坏,是HT的可能发病机制[26]。因而我们推断,ACVS的存在可预测HT。本研究中,ACVS与HT显著相关(OR=2.960,P=0.018),这符合我们的假设。提示对于存在ACVS的接受IVT的AIS患者,具有较高可能性出现出血转化,应动态复查头颅CT或MR以及早识别HT。既往文献报道,ACVS多见于存在颈内动脉或大脑中动脉重度狭窄的病例中[40],故本研究只纳入前循环的AIS。本研究显示,严重大动脉狭窄与HT无显著关系,这可能与侧支循环的建立有关系,良好的侧支循环能代偿梗死后低灌注[41],从而减少血脑屏障破坏。由于本研究属于回顾性研究,且样本量相对较少,ACVS对预测HT的作用有待大型前瞻性研究进一步证实。
